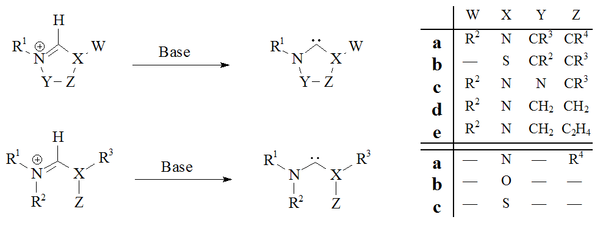
Carbeno persistente - Persistent carbene
Un carbeno persistente (también conocido como carbeno estable ) es un tipo de carbeno que muestra una estabilidad particular. Los ejemplos más conocidos y, con mucho, el subgrupo más grande son los carbenos N-heterocíclicos (NHC) (a veces llamados carbenos Arduengo ), por ejemplo, diaminocarbenos con la fórmula general (R 2 N) 2 C :, donde las 'R son típicamente alquilo y grupos arilo. Los grupos pueden unirse para dar carbenos heterocíclicos , como los derivados de imidazol , imidazolina , tiazol o triazol .
Tradicionalmente, los carbenos se consideran tan reactivos que solo se estudiaron indirectamente, por ejemplo, mediante reacciones de atrapamiento. Esta situación ha cambiado drásticamente con la aparición de carbenos persistentes. Aunque son sustancias bastante reactivas, es decir, que experimentan dimerización , muchas pueden aislarse como sustancias puras.
Los carbenos persistentes tienden a existir en el singlete . Su estabilidad se debe solo en parte al impedimento estérico por grupos voluminosos. Algunos carbenos singlete son termodinámicamente estables y pueden aislarse y almacenarse indefinidamente. Otros se dimerizan lentamente durante días. Los carbenos en estado triplete tienen vidas medias medidas en segundos y, por lo tanto, pueden observarse pero no almacenarse.
Historia
Evidencia temprana
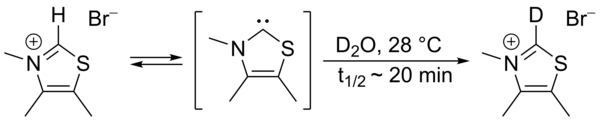
En 1957, Ronald Breslow propuso que un carbeno nucleofílico relativamente estable , un derivado de tiazol-2-ilideno , estaba involucrado en el ciclo catalítico de la vitamina B 1 (tiamina) que produce furoína a partir del furfural . En este ciclo, el anillo de tiazolio de la vitamina intercambia un átomo de hidrógeno (unido al carbono 2 del anillo) por un residuo de furfural. En agua deuterada , se encontró que el protón C2 se intercambia rápidamente por un deuterón en un equilibrio estadístico .
Se propuso que este intercambio procediera mediante la intermediación de un tiazol-2-ilideno. En 2012 se informó del aislamiento del llamado intermedio de Breslow .
En 1960, Hans-Werner Wanzlick y colaboradores conjeturaron que los carbenos derivados de dihidroimidazol-2-ilideno se producían mediante pirólisis al vacío de los correspondientes compuestos de 2-triclorometil dihidroimidazol con pérdida de cloroformo . Conjeturaron que el carbeno existía en equilibrio con su dímero , un derivado de tetraaminoetileno , el llamado equilibrio de Wanzlick . Esta conjetura fue desafiada por Lemal y colaboradores en 1964, quienes presentaron evidencia de que el dímero no se disociaba; y por Winberg en 1965. Sin embargo, experimentos posteriores de Denk, Herrmann y otros han confirmado este equilibrio, aunque en circunstancias específicas.
Aislamiento de carbenos persistentes
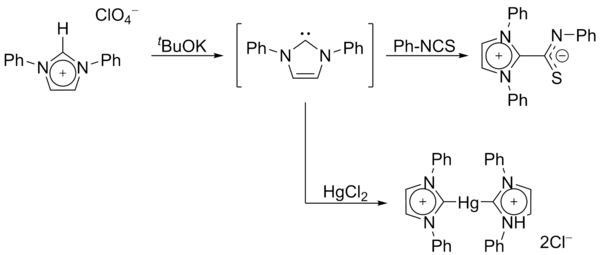
En 1970, el grupo de Wanzlick generó carbenos de imidazol-2-iliden mediante la desprotonación de una sal de imidazolio . Wanzlick y Roald Hoffmann propusieron que estos carbenos basados en imidazol deberían ser más estables que sus análogos 4,5-dihidro, debido a la aromaticidad de tipo Hückel . Wanzlick, sin embargo, no aisló imidazol-2-ilidenos, sino sus compuestos de coordinación con mercurio e isotiocianato :
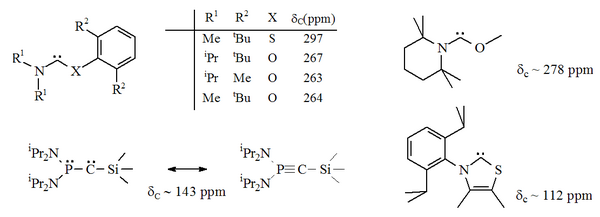
En 1988, Guy Bertrand y otros aislaron un fosfinocarbeno . Estas especies se pueden representar como λ 3 -fosfinocarbeno o λ 5 - fosfaacetileno :
Estos compuestos se denominaron carbenos push-pull en referencia a las afinidades electrónicas contrastantes de los átomos de fósforo y silicio. Presentan reactividad carbénica y alquínica . No se ha obtenido una estructura de rayos X de esta molécula y en el momento de la publicación quedaban algunas dudas sobre su naturaleza carbénica exacta.
En 1991, Arduengo y colaboradores cristalizaron un diaminocarbeno por desprotonación de un catión imidazolio:
Este carbeno, el precursor de una gran familia de carbenos con núcleo de imidazol-2-ilideno, es indefinidamente estable a temperatura ambiente en ausencia de oxígeno y humedad. Se derrite a 240–241 ° C sin descomponerse. Los 13 C Espectro de RMN muestra una señal en 211 ppm para el átomo de carbenic. La estructura de rayos X reveló longitudes de enlace N-C más largas en el anillo del carbeno que en el compuesto de imidazolio original, lo que indica que estos enlaces tenían muy poco carácter de doble enlace .
El primer carbeno ilídico estable al aire, un miembro clorado de la familia de los imidazol-2-ilidenos, se obtuvo en 1997.
En 2000, Bertrand obtuvo carbenos adicionales del tipo fosfanilo, incluido el (fosfanil) (trifluorometil) carbeno, estable en solución a -30 ° C y un (amino) (aril) carbeno moderadamente estable con un solo heteroátomo adyacente al átomo carbénico.
Factores que afectan la estabilidad de los carbenos estabilizados con heteroátomos

( Ver la estructura 3D con visor externo )
La estabilidad de los carbenos Arduengo se atribuyó inicialmente a los voluminosos sustituyentes N- adamantilo , que evita que el carbeno se dimerice debido al impedimento estérico . El reemplazo de los grupos N-adamantilo por grupos metilo también produce NHC estables. Por tanto, los imidazol-2-ilidenos son termodinámicamente estables .
También se había conjeturado que el doble enlace entre los carbonos 4 y 5 de la cadena principal del anillo de imidazolio, que daba carácter aromático a ese sistema, era importante para la estabilidad del carbeno. Esta conjetura fue refutada en 1995 por el grupo de Arduengo, que obtuvo un derivado del dihidroimidazol-2-ilideno , que carecía del doble enlace. La estabilidad termodinámica de este compuesto y el papel de la protección estérica en la prevención de la dimerización han sido un tema de controversia.
El primer carbeno persistente acíclico se informó en 1996, lo que demuestra que no era necesario un esqueleto cíclico para su estabilidad. A diferencia de los derivados cíclicos, los carbenos acíclicos son flexibles con respecto a la rotación de los enlaces al átomo carbénico. Midiendo la barrera a la rotación de estos enlaces, se pudo medir la extensión de su carácter de doble enlace y se pudo determinar la naturaleza ilídica de este carbeno. Al igual que los diaminocarbenos cíclicos, las variantes sin obstáculos tienden a dimerizarse.
La mayoría de los carbenos persistentes se estabilizan mediante dos centros de nitrógeno flanqueantes. El aminotiocarbeno y un aminooxicarbeno son valores atípicos. y un. En estos compuestos estables, el átomo carbénico se encuentra entre un átomo de nitrógeno y un átomo de azufre u oxígeno:
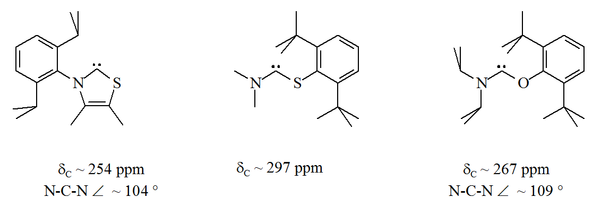
A diferencia de los NHC, estos carbenos no son termodinámicamente estables pero tienden a dimerizarse.
En bis (diisopropilamino) ciclopropenilideno , que es estable a temperatura ambiente, el átomo de carbeno está conectado a dos átomos de carbono, en un anillo de tres miembros que retiene la aromaticidad y geometría del anillo ciclopropenilideno . Este ejemplo demostró que la presencia de heteroátomos junto al carbeno tampoco es necesaria para la estabilidad.
Clases de carbenos estables
Los siguientes son ejemplos de las clases de carbenos estables aislados hasta la fecha:
Imidazol-2-ilidenos
Los primeros carbenos estables que se aislaron se basaron en un anillo de imidazol , con el hidrógeno en el carbono 2 del anillo (entre los dos átomos de nitrógeno) eliminado y otros hidrógenos reemplazados por varios grupos. Estos imidazol-2-ilidenos siguen siendo la familia de carbenos persistentes más estable y mejor estudiada y comprendida.
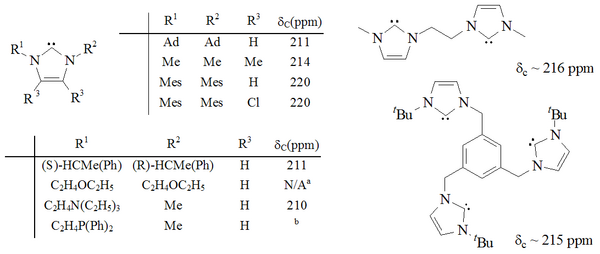
Se ha sintetizado una gama considerable de imidazol-2-ilidenos, incluidos aquellos en los que las posiciones 1,3 se han funcionalizado con sustituyentes alquilo , arilo , alquiloxi, alquilamino, alquilfosfino e incluso quirales :
( Vea la estructura 3D con un visor externo ) .
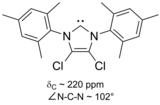
En particular, la sustitución de dos átomos de cloro por los dos hidrógenos en las posiciones 4 y 5 del anillo produjo el primer carbeno estable al aire. Su estabilidad adicional probablemente se deba al efecto de extracción de electrones de los sustituyentes de cloro , que reducen la densidad de electrones en el átomo de carbono que lleva el par solitario , a través de la inducción a través de la columna sigma.
También se han sintetizado moléculas que contienen dos e incluso tres grupos imidazol-2-ilideno.
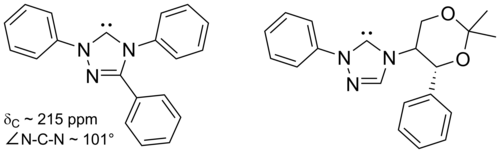
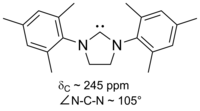
Carbenos basados en imidazol son termodinámicamente estables y generalmente tienen de diagnóstico 13 C RMN valores de desplazamiento químico entre 210 y 230 ppm para el carbono carbenic. Por lo general, las estructuras de rayos X de estas moléculas muestran ángulos de enlace NCN de 101 a 102 °.
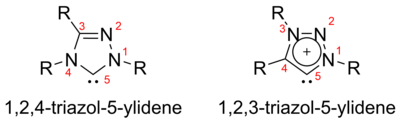
Triazol-5-ilidenos
Dependiendo de la disposición de los tres átomos de nitrógeno en el triazol-5-ilideno, existen dos isómeros posibles, a saber, 1,2,3-triazol-5-ilidenos y 1,2,4-triazol-5-ilidenos.
Los triazol-5-ilidenos basados en el anillo de 1,2,4-triazol se muestran a continuación y fueron preparados por primera vez por Enders y colaboradores mediante pirólisis al vacío a través de la pérdida de metanol de 2-metoxitriazoles. Sólo se ha informado de una gama limitada de estas moléculas, estando disponible comercialmente la molécula trifenil sustituida.
Triazol basados en carbenos son termodinámicamente estables y tienen diagnóstico 13 C RMN valores de desplazamiento químico entre 210 y 220 ppm para el carbono carbenic. La estructura de rayos X del carbeno trifenil sustituido anterior muestra un ángulo de enlace NCN de aprox. 101 °. El 5-metoxitriazol precursor de este carbeno se obtuvo mediante el tratamiento de una sal de triazolio con metóxido de sodio, que ataca como nucleófilo . Esto puede indicar que estos carbenos son menos aromáticos que los imidazol-2-ilidenos, ya que los precursores de imidazolio no reaccionan con los nucleófilos debido a la pérdida de aromaticidad resultante.
Otros diaminocarbenos
Las dos familias anteriores pueden verse como casos especiales de una clase más amplia de compuestos que tienen un átomo carbénico que une dos átomos de nitrógeno. Una gama de tales diaminocarbenos ha sido preparada principalmente por el grupo de investigación de Roger Alder . En algunos de estos compuestos, la unidad NCN es miembro de un anillo no aromático de 5 o 6 miembros, incluido un ejemplo bicíclico. En otros ejemplos, los nitrógenos adyacentes están conectados solo a través del átomo carbénico y pueden o no ser parte de anillos separados.
A diferencia de los imidazol-2-ilidenos o triazol-5-ilidenos aromáticos, estos carbenos parecen no ser termodinámicamente estables, como se muestra por la dimerización de algunos ejemplos cíclicos y acíclicos sin obstáculos. Los estudios sugieren que estos carbenos se dimerizan mediante la dimerización catalizada por ácido (como en el equilibrio de Wanzlick ).
Diaminocarbenes tienen de diagnóstico 13 C RMN valores de desplazamiento químico entre 230 y 270 ppm para el átomo de carbenic. La estructura de rayos X del dihidroimidazol-2-ilideno muestra un ángulo de enlace NCN de aprox. 106 °, mientras que el ángulo del carbeno acíclico es de 121 °, ambos mayores que los observados para los imidazol-2-ilidenos.
Carbenos heteroamino
Existen varias variantes de los carbenos estables anteriores donde uno de los átomos de nitrógeno adyacentes al centro del carbeno (los nitrógenos α ) ha sido reemplazado por un heteroátomo alternativo, como oxígeno, azufre o fósforo .
En particular, la sustitución formal de azufre por uno de los nitrógenos en imidazol produciría el compuesto heterocíclico aromático tiazol . Se ha preparado y caracterizado mediante cristalografía de rayos X un carbeno a base de tiazol (análogo al carbeno postulado por Breslow). Se han preparado otros aminocarbenos no aromáticos con átomos de O, S y P adyacentes (es decir, alfa) al centro del carbeno, por ejemplo, se han caracterizado carbenos basados en tio- y oxiiminio mediante cristalografía de rayos X.
Dado que el oxígeno y el azufre son divalentes , la protección estérica del centro carbénico es limitada, especialmente cuando la unidad NCX es parte de un anillo. Estos carbenos acíclicos tienen de diagnóstico 13 C RMN valores de desplazamiento químico entre 250 y 300 ppm para el carbono carbenic, más campo abajo que cualquier otro tipo de carbeno estable. Las estructuras de rayos X han mostrado ángulos de enlace NCX de ca. 104 ° y 109 ° respectivamente.
Se espera que los carbenos que se derivan formalmente de imidazol-2-ilidenos mediante la sustitución de azufre, oxígeno u otros calcógenos por ambos α- nitrógenos sean inestables, ya que tienen el potencial de disociarse en un alquino (R 1 C≡CR 2 ) y un dicalcogenuro de carbono (X 1 = C = X 2 ).
Carbenos no amino
Se propone la reacción de disulfuro de carbono (CS 2 ) con derivados de acetileno deficientes en electrones para dar carbenos de 1,3-ditiolio transitorios (es decir, donde X 1 = X 2 = S), que luego se dimerizan para dar derivados de tetratiafulveno . Por tanto, es posible que lo contrario de este proceso pueda estar ocurriendo en carbenos similares.
Carbenos de Bertrand
En los carbenos persistentes de Bertrand, el carbono insaturado está unido a un fósforo y un silicio . Sin embargo, estos compuestos parecen exhibir algunas propiedades alquínicas y, cuando se publicaron, se debatió la naturaleza carbénica exacta de estos aceites rojos.
Otros carbenos nucleofílicos
Un carbeno N-heterocíclico estable tiene una estructura análoga a la borazina con un átomo de boro reemplazado por un grupo metileno . Esto da como resultado un compuesto plano de 6 electrones.

Ciclopropenilidenos
Otra familia de carbenos se basa en un núcleo de ciclopropenilideno , un anillo de tres carbonos con un doble enlace entre los dos átomos adyacentes al carbénico. Esta familia está ejemplificada por bis (diisopropilamino) ciclopropenilideno .
Trío de carbenos estatales
En 2001, Hideo Tomioka y sus asociados pudieron producir un carbeno triplete comparativamente estable ( bis (9-anthryl) carbeno , con una vida media de 19 minutos), aprovechando la deslocalización de electrones .
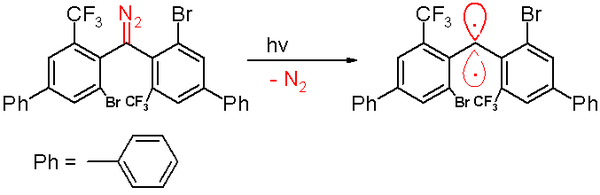
En 2006, el mismo grupo informó de un triplete de carbeno con una vida media de 40 minutos. Este carbeno se prepara mediante la descomposición fotoquímica de un precursor de diazometano por luz de 300 nanómetros en benceno con expulsión de gas nitrógeno .
La exposición al oxígeno (un dirradical triplete) convierte este carbeno en la benzofenona correspondiente . El compuesto de difenilmetano se forma cuando es atrapado por ciclohexa-1,4-dieno . Al igual que con los otros carbenos, esta especie contiene grandes sustituyentes voluminosos, a saber, bromo y los grupos trifluorometilo en los anillos de fenilo, que protegen al carbeno y previenen o ralentizan el proceso de dimerización a 1,1,2,2-tetra (fenil ) alqueno. Según simulaciones por computadora , se afirma que la distancia del átomo de carbono divalente a sus vecinos es de 138 picómetros con un ángulo de enlace de 158,8 °. Los planos de los grupos fenilo están casi en ángulo recto entre sí (el ángulo diedro es de 85,7 °).
Carbenos mesoiónicos
Los carbenos mesoiónicos (MIC) son similares a los carbenos N-heterocíclicos (NHC) excepto que las estructuras de resonancia canónica con el carbeno representado no se pueden dibujar sin añadir cargas adicionales. Los carbenos mesoiónicos también se denominan carbenos N-heterocíclicos anormales (aNHC) o carbenos N-heterocíclicos remotos (rNHC). Se pueden aislar una variedad de carbenos libres que son estables a temperatura ambiente. Otros carbenos libres no son estables y son susceptibles a las vías de descomposición intermolecular.
Propiedades químicas
Basicidad y nucleofilia
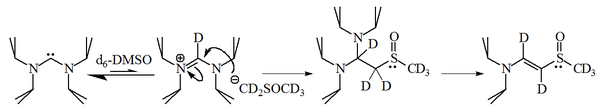
Los imidazol-2-ilidenos son bases fuertes, que tienen un pKa de aprox. 24 para el ácido conjugado en dimetilsulfóxido (DMSO):
Sin embargo, trabajos posteriores mostraron que los diaminocarbenos desprotonan el disolvente DMSO, reaccionando el anión resultante con la sal de amidinio resultante.
La reacción de imidazol-2-ilidenos con 1-bromohexano dio el 90% del aducto 2-sustituido, con solo el 10% del alqueno correspondiente , lo que indica que estas moléculas también son razonablemente nucleófilas .
Los valores de pKa para los ácidos conjugados de varias familias de NHC se han examinado en solución acuosa. Los valores de pKa de los iones de triazolio se encuentran en el rango de 16,5 a 17,8, alrededor de 3 unidades de pKa más ácidos que los iones de imidazolio relacionados.
Dimerización
En un momento, se pensó que los carbenos estables se dimerizaban reversiblemente a través del llamado equilibrio de Wanzlick . Sin embargo, los imidazol-2-ilidenos y triazol-5-ilidenos son termodinámicamente estables y no se dimerizan, y se han almacenado en solución en ausencia de agua y aire durante años. Esto se debe presumiblemente a la naturaleza aromática de estos carbenos, que se pierde con la dimerización. De hecho, los imidazol-2-ilidenos son tan termodinámicamente estables que sólo en condiciones muy restringidas estos carbenos se ven obligados a dimerizarse.
Chen y Taton hicieron un diimidazol-2-ilideno doblemente unido desprotonando la sal de diimidazolio respectiva. Solo la desprotonación de la sal de diimidazolio doblemente unida con el puente de metileno más corto (-CH 2 -) dio como resultado el dímero de dicarbeno:
Si este dímero existiera como un dicarbeno, los pares de electrones solitarios en el carbono carbénico se verían forzados a estar muy próximos. Presumiblemente, las interacciones electrostáticas repulsivas resultantes tendrían un efecto desestabilizador significativo. Para evitar esta interacción electrónica, las unidades de carbeno se dimerizan.
Por otro lado, se ha demostrado que los heteroaminocarbenos ( por ejemplo, R 2 N-C: -OR o R 2 N-C: -SR) y los carbenos no aromáticos como los diaminocarbenos ( por ejemplo, R 2 N-C: -NR 2 ) se dimerizan, aunque con bastante lentitud. . Se ha supuesto que esto se debe a la alta barrera para la dimerización del estado singlete :
Los diaminocarbenos no se dimerizan realmente, sino que forman el dímero por reacción a través de las sales de formamidinio , una especie precursora protonada. Por consiguiente, esta reacción puede catalizarse con ácido. Esta reacción se produce porque, a diferencia de los carbenos basados en imidazolio, no hay pérdida de aromaticidad en la protonación del carbeno.
A diferencia de la dimerización de los carbenos en estado triplete, estos carbenos en estado singlete no se acercan cabeza a cabeza ("movimiento mínimo"), sino que el par solitario de carbeno ataca el orbital p del carbono vacío ("movimiento no mínimo"). La dimerización del carbeno puede ser catalizada tanto por ácidos como por metales.
Reactividad
La química de los carbenos estables no se ha explorado completamente. Sin embargo, Enders et al.
have performed a range of organic reactions involving a triazol-5-ylidene. These reactions are outlined below and may be considered as a model for other carbenes.

| a | 3,6-difenil-1,2,4,5-tetrazina, tolueno | 92% | mi | 2 equiv., PhNCO, tolueno, reflujo | 92% | |
|---|---|---|---|---|---|---|
| B | RXH, RT | 95–97% | F | CS 2 , tolueno o PhNCS, THF, RT | 71–90% | |
| C | O 2 , S 8 o Se, tolueno, reflujo | 54–68% | gramo | Maleimida, THF, RT | 47–84% | |
| D | R 1 CH = CHR 2 , THF, RT | 25–68% | h | Dicarboxilato de dimetilacetileno, THF, reflujo | 21% |
Estos carbenos tienden a comportarse de un nucleófilo de la manera ( e y f ), la realización de reacciones de inserción ( b ), reacciones de adición ( c ), [2 + 1] cicloadiciones ( d , g y h ), [4 + 1] cicloadiciones ( una ) así como simples desprotonaciones . Las reacciones de inserción ( b ) probablemente proceden mediante desprotonación, lo que da como resultado la generación de un nucleófilo ( - XR) que puede atacar la sal generada dando la impresión de una inserción de HX.
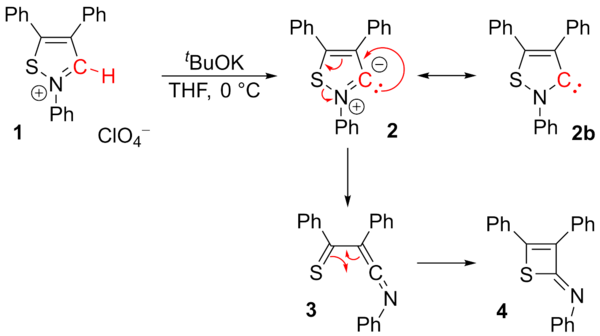
Se cuestionó el carbeno de isotiazol estable informado ( 2b ) derivado de un perclorato de isotiazolio ( 1 ). Los investigadores solo pudieron aislar 2-imino-2H-thiete ( 4 ). El intermedio 3 se propuso mediante una reacción de transposición . El carbeno 2b ya no se considera estable.
Complejación de carbeno
Se ha demostrado que los imidazol-2-ilidenos, triazol-5-ilidenos (y menos, los diaminocarbenos) se coordinan en una plétora de elementos, desde metales alcalinos , elementos del grupo principal , metales de transición e incluso lantánidos y actínidos . Una tabla periódica de elementos da una idea de los complejos que se han preparado y, en muchos casos, estos han sido identificados mediante cristalografía de rayos X de monocristal . Se cree que los carbenos estables se comportan de manera similar a las organofosfinas en sus propiedades de coordinación con los metales. Estos ligandos se dice que son buenos sigma-donantes a través de la carbenic par solitario , pero pobres pi-aceptores debido a interno ligando back-donación de los de nitrógeno átomos adyacentes al centro de carbeno, y así son capaces de coordinar a incluso relativamente electrones metales deficientes. Enders y Hermann han demostrado que estos carbenos son sustitutos adecuados de los ligandos de fosfina en varios ciclos catalíticos . Aunque han descubierto que estos ligandos no activan el catalizador metálico tanto como los ligandos de fosfina, a menudo dan como resultado catalizadores más robustos. Hermann y Enders han estudiado varios sistemas catalíticos, utilizando catalizadores que contienen ligandos de carbeno de imidazol y triazol, con un éxito moderado. Grubbs ha informado de la sustitución de un ligando de fosfina (PCy 3 ) con un imidazol-2-ilideno en el catalizador de metátesis de olefinas RuCl 2 (PCy 3 ) 2 CHPh, y observó un aumento de la metátesis de cierre de anillo, además de exhibir "una notable estabilidad al aire y al agua". . Se han preparado moléculas que contienen dos y tres restos carbeno como posibles ligandos carbeno bidentados y tridentados .
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | dieciséis | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Periodo |
|
|||||||||||||||||||
| 1 | 1 H |
|
2 Él |
|||||||||||||||||
| 2 | 3 Li |
4 Ser |
|
5 B |
6 C |
7 norte |
8 O |
9 F |
10 Nordeste |
|||||||||||
| 3 | 11 N / A |
12 Mg |
|
13 Alabama |
14 Si |
15 PAG |
dieciséis S |
17 Cl |
18 Arkansas |
|||||||||||
| 4 | 19 K |
20 California |
21 Carolina del Sur |
22 Ti |
23 V |
24 Cr |
25 Minnesota |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Georgia |
32 Ge |
33 Como |
34 Se |
35 Br |
36 Kr |
||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nótese bien |
42 Mes |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 CD |
49 En |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
||
| 6 | 55 Cs |
56 Licenciado en Letras |
|
71 Lu |
72 Hf |
73 Ejército de reserva |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Correos |
85 A |
86 Rn |
|
| 7 | 87 P. |
88 Real academia de bellas artes |
|
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Monte |
110 Ds |
111 Rg |
112 Cn |
113 Nueva Hampshire |
114 Florida |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|
|
|
||||||||||||||||||||
|
|
57 La |
58 Ce |
59 Pr |
60 Dakota del Norte |
61 Pm |
62 Sm |
63 UE |
64 Di-s |
sesenta y cinco Tuberculosis |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
||||||
|
|
89 C.A |
90 Th |
91 Pensilvania |
92 U |
93 Notario público |
94 Pu |
95 Soy |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Maryland |
102 No |
||||||
- Leyenda
- Complejo de carbeno con elemento conocido
- Sin complejo de carbeno con elemento conocido
Carbenos en química organometálica y catálisis
Los carbenos se pueden estabilizar como especies organometálicas . Estos complejos de carbeno de metales de transición se dividen en dos categorías:
- Carbenos de Fischer en los que los carbenos están unidos a un metal y a un grupo captador de electrones (normalmente un carbonilo),
- Carbenos Schrock ; en el que los carbenos están atados a un metal y un grupo donador de electrones . Las reacciones en las que participan estos carbenos son muy diferentes de aquellas en las que participan los carbenos orgánicos.
Química del carbeno en estado triplete
Es probable que los carbenos en estado triplete persistente tengan una reactividad muy similar a la de otros carbenos en estado triplete no persistente .
Propiedades físicas
Los carbenos que se han aislado hasta la fecha tienden a ser sólidos incoloros con puntos de fusión bajos. Estos carbenos tienden a sublimarse a bajas temperaturas bajo alto vacío.
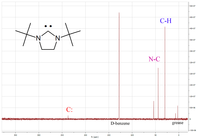
Una de las propiedades físicas más útiles es el desplazamiento químico de diagnóstico del átomo de carbono carbenic en el 13 C- RMN espectro. Típicamente este pico está en el intervalo entre 200 y 300 ppm, donde pocos otros picos aparecen en el 13 C- RMN espectro. A la izquierda se muestra un ejemplo de un diaminocarbeno cíclico que tiene un pico carbénico a 238 ppm.
Tras la coordinación con los centros metálicos, la resonancia de carbeno 13 C generalmente cambia de campo alto, dependiendo de la acidez de Lewis del fragmento complejo. Con base en esta observación, Huynh et al. desarrollado una nueva metodología para determinar las fortalezas de los donantes de ligando por 13 análisis C RMN de trans -paladio (II) complejos -carbene. El uso de un 13 carbeno N-heterocíclico marcado con C ligando también permite el estudio de complejos de carbeno-fosfina mixtos, que se someten a trans - cis -isomerization debido al efecto trans .
Aplicaciones
Los NHC se utilizan ampliamente como ligando auxiliar en la química organometálica . Una aplicación práctica es el rutenio basado en Grubbs' catalizador y NHC-Palladium Complejos para reacciones de acoplamiento cruzado. Los complejos NHC-metal, específicamente los complejos Ag (I) -NHC, han sido ampliamente probados para sus aplicaciones biológicas.
Métodos de preparación
Los NHC son a menudo fuertemente básicos (el valor de pKa del ácido conjugado de un imidazol-2-ilideno se midió en aproximadamente 24) y reaccionan con el oxígeno . Claramente, estas reacciones se realizan utilizando técnicas sin aire , evitando compuestos de acidez incluso moderada . Aunque las sales de imidazolio son estables a la adición nucleofílica , otras sales no aromáticas no lo son (es decir, sales de formamidinio ).
En estos casos, se evitan los nucleófilos fuertes sin obstáculos, ya sea que se generen in situ o estén presentes como una impureza en otros reactivos (por ejemplo, LiOH en BuLi).
Se han desarrollado varios enfoques para preparar carbenos estables, que se describen a continuación.
Desprotonación
La desprotonación de las sales precursoras de carbeno con bases fuertes ha demostrado ser una ruta fiable para casi todos los carbenos estables:
Se han preparado imidazol-2-ilidenos y dihidroimidazol-2-ilidenos, por ejemplo, IMes , mediante la desprotonación de las respectivas sales de imidazolio y dihidroimidazolio . Los carbenos acíclicos y los carbenos basados en tetrahidropirimidinilo se prepararon mediante desprotonación utilizando bases homogéneas fuertes.
Se han empleado varias bases y condiciones de reacción con éxito variable. El grado de éxito ha dependido principalmente de la naturaleza del precursor que se desprotona. El principal inconveniente de este método de preparación es el problema del aislamiento del carbeno libre de los iones metálicos utilizados en su preparación.
Bases de hidruros metálicos
Se podría creer que el hidruro de sodio o potasio sería la base ideal para desprotonar estas sales precursoras. El hidruro debería reaccionar irreversiblemente con la pérdida de hidrógeno para dar el carbeno deseado, eliminándose los subproductos inorgánicos y el exceso de hidruro por filtración. En la práctica, esta reacción es a menudo demasiado lenta y requiere la adición de DMSO o t -BuOH . Estos reactivos generan catalizadores solubles , que aumentan la velocidad de reacción de este sistema heterogéneo, mediante la generación de terc-butóxido o anión dimsilo . Sin embargo, estos catalizadores han demostrado ser ineficaces para la preparación de aductos distintos de imidazolio, ya que tienden a actuar como nucleófilos hacia las sales precursoras y, al hacerlo, se destruyen. La presencia de iones hidróxido como impureza en el hidruro metálico también podría destruir sales no aromáticas.
Se ha informado de desprotonación con hidruro de sodio o potasio en una mezcla de amoníaco líquido / THF a –40 ° C para los carbenos a base de imidazol. Arduengo y sus colaboradores lograron preparar un dihidroimidazol-2-ilideno usando NaH. Sin embargo, este método no se ha aplicado a la preparación de diaminocarbenos. En algunos casos, se puede emplear terc-butóxido de potasio sin la adición de un hidruro metálico.
Alquil-litio
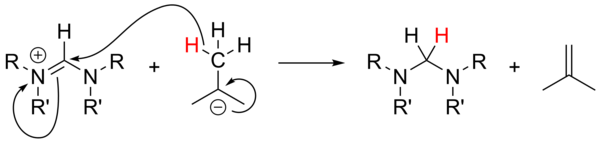
El uso de alquil-litio como bases fuertes no se ha estudiado ampliamente y no ha sido confiable para la desprotonación de sales precursoras. Con sales no aromáticas, n-BuLi y PhLi pueden actuar como nucleófilos, mientras que t-BuLi en ocasiones puede actuar como fuente de hidruro, reduciendo la sal con la generación de isobuteno :
Bases de amidas
Las amidas de litio como la diisopropilamida (LDA) y la ( tetrametilpiperidida (LiTMP) ) generalmente funcionan bien para la desprotonación de todo tipo de sales, siempre que no haya demasiado LiOH presente en el n- butillitio utilizado para fabricar la amida de litio. La titulación de amida de litio se puede utilizar para determinar la cantidad de hidróxido en solución. La desprotonación de sales precursoras con hexametildisilazidas metálicas funciona de manera muy limpia para la desprotonación de todo tipo de sales, excepto las sales de formamidinio sin obstáculos, donde esta base puede actuar como un nucleófilo para dar un aducto de triaminometano.
Preparación de carbeno sin metales

La preparación de carbenos estables libres de cationes metálicos se ha buscado con ahínco para permitir un estudio más profundo de las especies de carbeno en aislamiento de estos metales. La separación de un carbeno de un complejo carbeno-metal puede resultar problemática debido a la estabilidad del complejo. Por consiguiente, es preferible hacer que el carbeno esté libre de estos metales en primer lugar. De hecho, algunos iones metálicos, en lugar de estabilizar el carbeno, se han visto implicados en la dimerización catalítica de ejemplos sin obstáculos.
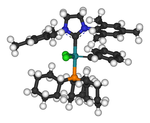
A la derecha se muestra una estructura de rayos X que muestra un complejo entre un diaminocarbeno y un HMDS de potasio . Este complejo se formó cuando se utilizó un exceso de KHMDS como base fuerte para desprotonar la sal de formamidinio . La eliminación de iones de litio resultantes de la desprotonación con reactivos como la diisopropilamida de litio (LDA) puede ser especialmente problemática. Los subproductos de las sales de sodio y potasio tienden a precipitarse de la solución y pueden eliminarse. Los iones de litio pueden eliminarse químicamente al unirse a especies como criptandos o éteres corona .
Los carbenos libres de metales se han preparado de varias formas, como se describe a continuación:
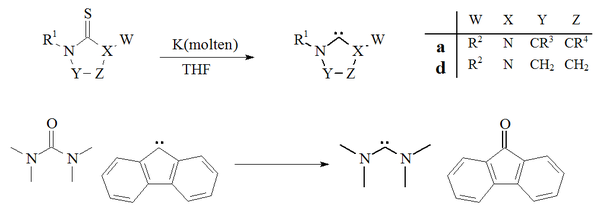
Descalcogenación
Otro método de preparación de carbenos se ha basado en la desulfuración de tioureas con potasio en THF . Un factor que contribuye al éxito de esta reacción es que el subproducto, el sulfuro de potasio , es insoluble en el disolvente. Las temperaturas elevadas sugieren que este método no es adecuado para la preparación de carbenos dimerizantes inestables. También se ha informado de un solo ejemplo de desoxigenación de una urea con un carbeno derivado de fluoreno para dar tetrametildiaminocarbeno y fluorenona:
La desulfuración de tioureas con potasio fundido para dar imidazol-2-ilidenos o diaminocarbenos no se ha utilizado ampliamente. El método se utilizó para preparar carbenos de dihidroimidazol.
Pirólisis al vacío
La pirólisis al vacío, con la eliminación de subproductos volátiles neutros, es decir, metanol o cloroformo, se ha utilizado para preparar carbenos basados en dihidroimidazol y triazol. Históricamente, Wanzlick utilizó la eliminación de cloroformo mediante pirólisis al vacío de los aductos A en sus primeros intentos de preparar dihidroimidazol-2-ilidenos, pero este método no se usa ampliamente. El laboratorio de Enders ha utilizado la pirólisis al vacío del aducto B para generar un triazol-5-ilideno.
Bis (trimetilsilil) mercurio
Bis (trimetilsilil) mercurio (CH 3 ) 3 Si-Hg-Si (CH 3 ) 3 reacciona con cloro- iminio y cloro- amidinio sales para dar un carbeno libre de metal y elemental mercurio . Por ejemplo, (CH 3 ) 3 Si-Hg-Si (CH 3 ) 3 + R 2 N = C (Cl) -NR 2 + Cl - → R 2 N-C: -NR 2 + Hg (l) + (CH 3 ) 3 Si-Cl
Descomposición fotoquímica
Se han preparado carbenos en estado triplete persistente mediante descomposición fotoquímica de un producto de diazometano mediante la expulsión de gas nitrógeno , a una longitud de onda de 300 nm en benceno.
Purificación
Los carbenos estables son muy reactivos, por lo que es deseable la mínima manipulación utilizando técnicas sin aire . Sin embargo, siempre que se utilicen materiales rigurosamente secos, relativamente no ácidos y libres de aire, los carbenos estables son razonablemente resistentes a la manipulación per se . A modo de ejemplo, un carbeno estable preparado a partir de hidruro de potasio se puede filtrar a través de una almohadilla de celita seca para eliminar el exceso de KH (y las sales resultantes) de la reacción. A una escala relativamente pequeña, se puede dejar sedimentar una suspensión que contiene un carbeno estable en solución y empujar la solución sobrenadante a través de un filtro de jeringa de membrana seca . Los carbenos estables son fácilmente solubles en disolventes no polares tales como hexano, por lo que normalmente la recristalización de carbenos estables puede ser difícil debido a la falta de disponibilidad de disolventes polares no ácidos adecuados. La sublimación sin aire, como se muestra a la derecha, puede ser un método eficaz de purificación, aunque se prefieren temperaturas por debajo de 60 ° C bajo alto vacío, ya que estos carbenos son relativamente volátiles y también podrían comenzar a descomponerse a estas temperaturas más altas. De hecho, la sublimación en algunos casos puede producir monocristales adecuados para el análisis de rayos X. Sin embargo, una fuerte complejación con iones metálicos como el litio evitará en la mayoría de los casos la sublimación.
Referencias
Otras lecturas
Reseñas sobre carbenos persistentes:
- Hopkinson, MN; Richter, C .; Schedler, M .; Glorius, F. (2014). "Una descripción general de carbenos N-heterocíclicos". Naturaleza . 510 (7506): 485–496. Código bibliográfico : 2014Natur.510..485H . doi : 10.1038 / nature13384 . PMID 24965649 . S2CID 672379 ..
- Química del carbeno: de intermedios fugaces a potentes reactivos, (Capítulo 4, Hideo Tomioka (estado triplete); Capítulo 5 (estado singlete), Roger W. Alder) - ed. Guy Bertrand
- Química intermedia reactiva Por Robert A. Moss, Matthew Platz, Maitland Jones (Capítulo 8, Carbenes de camiseta estable, Guy Bertrand)
- RW Alder, en 'Diaminocarbenes: exploración de estructura y reactividad', ed. G. Bertrand, Nueva York, 2002
- M. Regitz (1996). "Carbenos estables: ¿ilusión o realidad?". Angew. Chem. En t. Ed. 30 (6): 674–676. doi : 10.1002 / anie.199106741 .
Para una revisión de las propiedades físico-químicas (electrónica, estérica, ...) de los carbenos N-heterocíclicos:
- T. Dröge; F. Glorius (2010). "La medida de todos los anillos - carbenos N-heterocíclicos". Angew. Chem. En t. Ed. 49 (39): 6940–6952. doi : 10.1002 / anie.201001865 . PMID 20715233 .