Cetena - Ketene
Una cetena es un compuesto orgánico de la forma R'R ″ C = C = O, donde R y R 'son dos grupos químicos monovalentes arbitrarios (o dos sitios de sustitución separados en la misma molécula). El nombre también puede referirse al compuesto específico etenona H
2C = C = O , la cetena más simple.
Aunque son muy útiles, la mayoría de las cetenos son inestables . Cuando se utilizan como reactivos en un procedimiento químico, normalmente se generan cuando se necesitan y se consumen tan pronto como (o mientras) se producen.
Historia
Las cetenas fueron estudiadas por primera vez como clase por Hermann Staudinger antes de 1905.
Las cetenos fueron investigadas sistemáticamente por Hermann Staudinger en 1905 en forma de difenilceteno (conversión de cloruro de -clorodifenil acetilo con zinc). Staudinger se inspiró en los primeros ejemplos de intermedios orgánicos reactivos y radicales estables descubiertos por Moses Gomberg en 1900 (compuestos con grupo trifenilmetilo).
Propiedades
Las cetenos son altamente electrofílicas en el átomo de carbono unido al heteroátomo, debido a su carácter sp . La cetena se puede formar con diferentes heteroátomos unidos al átomo de carbono sp , como O , S o Se , denominados respectivamente ceteno, tioceteno y selenoceteno .
La etenona , la cetena más simple, tiene diferentes longitudes experimentales para cada uno de los dobles enlaces; el enlace C = O es 1,160 Å y el enlace C = C es 1,314Å. El ángulo entre los dos átomos de H es 121,5 °, similar al ángulo teóricamente ideal formado en los alquenos entre el átomo de carbono sp 2 y los sustituyentes H.
Las cetenos son inestables y no se pueden almacenar. En ausencia de nucleófilos con los que reaccionar, la etenona se dimeriza para dar β-lactona , un éster cíclico . Si la cetena está disustituida, el producto de dimerización es una ciclobutadiona sustituida. Para las cetenos monosustituidas, la dimerización podría proporcionar el éster o el producto dicetona.
Síntesis
La etenona se puede generar por pirólisis (craqueo térmico) de acetona :
- CH 3 −CO − CH 3 → CH 2 = C = O + CH 4
Esta reacción se denomina síntesis de cetena de Schmidlin.
Se pueden preparar otras cetenos a partir de cloruros de acilo mediante una reacción de eliminación en la que se pierde HCl :
En esta reacción, una base, generalmente trietilamina , elimina el protón ácido alfa del grupo carbonilo , induciendo la formación del doble enlace carbono-carbono y la pérdida de un ión cloruro :
Las cetenos también se pueden formar a partir de α- diazocetonas por transposición de Wolff .
Otra forma de generar cetenos es mediante termólisis instantánea al vacío (FVT) con 2- piridilaminas . Plüg y Wentrup desarrollaron un método en 1997 que mejoró las reacciones de FVT para producir cetenos con un FVT estable que es insensible a la humedad, usando condiciones suaves (480 ° C). Las N-piridilaminas se preparan mediante una condensación con R- malonatos con N-amino ( pirideno ) y DCC como disolvente.
Un método más robusto para preparar cetenos es la carbonilación de carbenos metálicos y la reacción in situ de las cetenos altamente reactivas así producidas con reactivos adecuados tales como iminas , aminas o alcoholes . Este método es una manera eficiente de un solo recipiente protocolo en tándem de la carbonilación de compuestos α-diazocarbonyl y una variedad de N -tosylhydrazones catalizada por Co (II) - porfirina metalloradicals que conducen a la formación de cetonas, que posteriormente reacciona con una variedad de nucleófilos y iminas para formar ésteres , amidas y β-lactámicos . Este sistema tiene un amplio alcance de sustrato y se puede aplicar a varias combinaciones de precursores de carbeno , nucleófilos e iminas .
Reacciones y aplicaciones
Debido a sus dobles enlaces acumulados , las cetenos son muy reactivas.
Formación de ésteres de ácido carboxílico
Por reacción con alcoholes , se forman ésteres de ácido carboxílico :
Formación de anhídridos carboxílicos.
Los cetenos reaccionan con ácidos carboxílicos para formar anhídridos de ácido carboxílico :
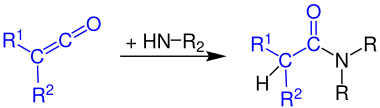
Formación de amidas de ácido carboxílico.
Las cetenos reaccionan con el amoníaco a amidas primarias :
La reacción de cetenos con aminas primarias produce amidas secundarias :
Los cetenos reaccionan con aminas secundarias para dar amidas terciarias:
Hidrólisis
Por reacción con el agua, los ácidos carboxílicos se forman a partir de cetenos.
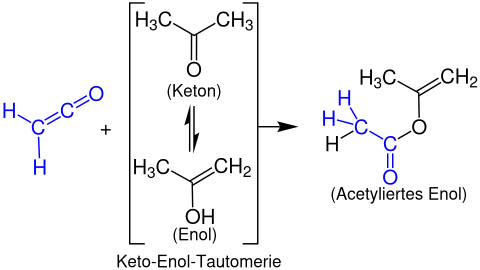
Formación de ésteres enólicos
Los ésteres enólicos se forman a partir de cetenos con compuestos carbonílicos enolizables . El siguiente ejemplo muestra la reacción de etenona con acetona para formar un acetato de propen-2-ilo:
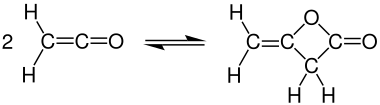
Dimerización
A temperatura ambiente, la cetena se dimeriza rápidamente a dicetena , pero la cetena se puede recuperar calentando:
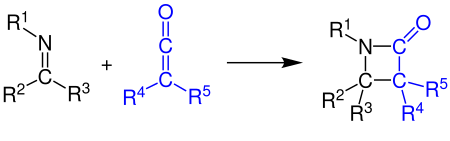
[2 + 2] -Cicloadición
Los cetenos pueden reaccionar con alquenos , compuestos carbonílicos , carbodiimidas e iminas en una cicloadición [2 + 2] . El ejemplo muestra la síntesis de un β-lactámico mediante la reacción de una cetena con una imina (ver Síntesis de Staudinger ):
Aplicaciones
Los cetenos son generalmente muy reactivos y participan en diversas cicloadiciones . Un proceso importante es la dimerización para dar propiolactonas . Un ejemplo específico es la dimerización de la cetena del ácido esteárico para producir dímeros de alquilcetena , que se utilizan ampliamente en la industria del papel. Los AKD reaccionan con los grupos hidroxilo de la celulosa mediante una reacción de esterificación .
También sufrirán reacciones de cicloadición [2 + 2] con alquinos ricos en electrones para formar ciclobutenonas , o grupos carbonilo para formar beta- lactonas . Con iminas se forman betalactámicos . Esta es la síntesis de Staudinger , una ruta fácil para esta importante clase de compuestos. Con acetona , la cetena reacciona para dar acetato de isopropenilo .
Una variedad de compuestos hidroxílicos se pueden agregar como nucleófilos, formando productos enol o éster . Como ejemplos, una molécula de agua se agrega fácilmente a la cetena para dar 1,1-dihidroxieteno y el anhídrido acético se produce mediante la reacción del ácido acético con la cetena. Las reacciones entre dioles (HO − R − OH) y bis-cetenos (O = C = CH − R′ − CH = C = O) producen poliésteres con una unidad repetida de (−O − R − O − CO − R′− CO).
El acetoacetato de etilo , un material de partida importante en la síntesis orgánica, se puede preparar usando un diceteno en reacción con etanol . Forman directamente acetoacetato de etilo y el rendimiento es alto cuando se realiza en circunstancias controladas; por tanto, este método se utiliza industrialmente.
Ver también
Referencias
enlaces externos
-
 Medios relacionados con ketenes en Wikimedia Commons
Medios relacionados con ketenes en Wikimedia Commons