Acetilación de proteínas - Protein acetylation
La acetilación (y desacetilación) de proteínas son reacciones de acetilación que ocurren dentro de las células vivas como metabolismo de fármacos , por enzimas en el hígado y otros órganos (p. Ej., El cerebro). Los productos farmacéuticos emplean con frecuencia la acetilación para permitir que dichos ésteres atraviesen la barrera hematoencefálica (y la placenta ), donde son desacetilados por enzimas ( carboxilesterasas ) de una manera similar a la acetilcolina . Ejemplos de productos farmacéuticos acetilados son diacetilmorfina (heroína), ácido acetilsalicílico (aspirina), THC-O-acetato y diacereína . Por el contrario, los fármacos como la isoniazida se acetilan en el hígado durante el metabolismo del fármaco. Un fármaco que depende de tales transformaciones metabólicas para actuar se denomina profármaco .
La acetilación es una modificación importante de proteínas en biología celular ; y los estudios de proteómica han identificado miles de proteínas de mamíferos acetiladas. La acetilación ocurre como una modificación cotraduccional y postraduccional de proteínas , por ejemplo, histonas , p53 y tubulinas . Entre estas proteínas, las proteínas de la cromatina y las enzimas metabólicas están muy representadas, lo que indica que la acetilación tiene un impacto considerable en la expresión y el metabolismo de los genes . En las bacterias , el 90% de las proteínas implicadas en el metabolismo central de Salmonella enterica están acetiladas.
Acetilación N-terminal

La acetilación N-terminal es una de las modificaciones covalentes cotraduccionales más comunes de proteínas en eucariotas , y es crucial para la regulación y función de diferentes proteínas. La acetilación N-terminal juega un papel importante en la síntesis, estabilidad y localización de proteínas. Aproximadamente el 85% de todas las proteínas humanas y el 68% de las levaduras están acetiladas en su extremo Nα. Varias proteínas de procariotas y arqueas también se modifican mediante acetilación N-terminal.
La acetilación N-terminal es catalizada por un conjunto de complejos enzimáticos, las acetiltransferasas N-terminales (NAT). Los NAT transfieren un grupo acetilo de la acetil-coenzima A (Ac-CoA) al grupo α-amino del primer residuo de aminoácido de la proteína. Diferentes NAT son responsables de la acetilación de la proteína N-terminal naciente, y se encontró que la acetilación era irreversible hasta ahora.
Acetiltransferasas N-terminales
Hasta la fecha, se han encontrado siete NAT diferentes en humanos: NatA, NatB, NatC, NatD, NatE, NatF y NatH. Cada uno de estos diferentes complejos enzimáticos es específico para diferentes aminoácidos o secuencias de aminoácidos que se muestran en la siguiente tabla.
Tabla 1. Composición y especificidad de sustrato de los NAT.
| NAT | Subunidades (las subunidades catalíticas están en negrita ). | Sustratos |
|---|---|---|
| NatA | Naa10 (Ard1) Naa15 (Nat1) | Ser -, Ala -, Gly -, Thr-, Val -, Cys - N-termini |
| NatB | Naa20 (Nat3) Naa25 (Mdm20) | Met - Glu -, Met - Asp -, Met - Asn -, Met - Gln - N-terminal |
| NatC | Naa30 (Mak3) Naa35 (Mak10) Naa38 (Mak31) | Met - Leu -, Met -Ile-, Met -Trp-, Met - Phe - N-termini |
| NatD | Naa40 (Nat4) | Ser - Gly - Gly -, Ser - Gly - Arg - N-termini |
| NatE | Naa50 (Nat5) Naa10 (Ard1) Naa15 (Nat1) | Met -Leu-, Met - Ala -, Met - Lys -, Met - Met - N-terminal |
| NatF | Naa60 | Met - Lys -, Met - Leu -, Met -Ile-, Met -Trp-, Met - Phe - N-termini |
| NatH | Naa80 | Actina - N-terminal |
NatA

NatA se compone de dos subunidades, la subunidad catalítica Naa10 y la subunidad auxiliar Naa15. Las subunidades NatA son más complejas en eucariotas superiores que en eucariotas inferiores. Además de los genes NAA10 y NAA15 , los genes específicos de mamíferos NAA11 y NAA16 producen productos génicos funcionales, que forman diferentes complejos NatA activos. Estas cuatro proteínas forman cuatro posibles dímeros auxiliares catalíticos de hNatA. Sin embargo, Naa10 / Naa15 es la NatA más abundante.
NatA acetila Ser , Ala -, Gly -, Thr-, Val - y Cys N-terminal después de la iniciador de metionina se elimina por la metionina amino-peptidasas. Estos aminoácidos se expresan con mayor frecuencia en el extremo N-terminal de las proteínas en eucariotas, por lo que NatA es el principal NAT correspondiente al número total de sus sustratos potenciales.
Varios socios de interacción diferentes están involucrados en la acetilación N-terminal por NatA. La proteína que interactúa con la huntingtina K (HYPK) interactúa con hNatA en el ribosoma para afectar la acetilación N-terminal de un subconjunto de sustratos de NatA. Las subunidades hNaa10 y hNaa15 aumentarán la tendencia a la agregación de Huntingtin si se agota HYPK. También se ha encontrado que el factor inducible por hipoxia (HIF) -1α interactúa con hNaa10 para inhibir la activación de la actividad transcripcional de β-catenina mediada por hNaa10.
NatB
Los complejos NatB están compuestos por la subunidad catalítica Naa20p y la subunidad auxiliar Naa25p, que se encuentran tanto en levaduras como en seres humanos. En la levadura , todas las subunidades de NatB están asociadas a ribosomas; pero en los seres humanos, se encuentra que las subunidades NatB están asociadas a ribosomas y no ribosomales. NatB acetila la metionina N-terminal de los sustratos comenzando con Met - Glu -, Met - Asp -, Met - Asn - o Met - Gln - N terminales.
NatC
El complejo NatC consta de una subunidad catalítica Naa30p y dos subunidades auxiliares Naa35p y Naa38p. Las tres subunidades se encuentran en el ribosoma de la levadura, pero también se encuentran en formas NAT no ribosómicas como Nat2. NaTC acetilatos complejos la metionina N-terminal de los sustratos Met - Leu -, Met -Ile-, Met Trp- o Met - Phe N-terminales.
NatD
NatD solo está compuesto con la unidad catalítica Naa40p y Naa40p y es conceptualmente diferente de los otros NAT. Al principio, solo se han identificado dos sustratos, H2A y H4, en levaduras y seres humanos. En segundo lugar, la especificidad de sustrato de Naa40p se encuentra dentro de los primeros 30-50 residuos que son bastante más grandes que la especificidad de sustrato de otros NAT. La acetilación de histonas por NatD está parcialmente asociada con ribosomas y los sustratos de aminoácidos son los mismos residuos N-terminales, lo que lo hace diferente de las lisina N-acetiltransferasas (KAT).
NatE
El complejo NatE consta de la subunidad Naa50p y dos subunidades NatA, Naa10p y Naa15p. El extremo N de los sustratos de Naa50p es diferente de los acetilados por la actividad NatA de Naa10p. El NAA50 en las plantas es esencial para controlar el crecimiento, el desarrollo y las respuestas al estrés de las plantas, y la función del NAA50 está muy conservada entre los seres humanos y las plantas.
NatF
NatF es un NAT que se compone de la enzima Naa60. Inicialmente, se pensó que NatF solo se encontraba en eucariotas superiores, ya que estaba ausente de la levadura. Sin embargo, más tarde se descubrió que Naa60 se encuentra en todo el dominio eucariota, pero se perdió secundariamente en el linaje de los hongos. En comparación con la levadura, NatF contribuye a una mayor abundancia de acetilación N-terminal en humanos. NATF acetilatos complejos la metionina N-terminal de los sustratos Met - Lys -, Met - Leu -, Met -Ile-, Met Trp- y Met - Phe N termini que se solapan en parte con NaTC y Nate. Se ha demostrado que NatF tiene una localización organelar y acetila los extremos N citosólicos de las proteínas transmembrana. La localización organellar de Naa60 está mediada por su único extremo C-terminal, que consta de dos hélices alfa que periféricamente asocian con la membrana y las interacciones mediatas con PI (4) P .
NAA80 / NatH
NAA80 / NatH es una acetiltransferasa N-terminal que acetila específicamente el N-terminal de la actina .
Función de acetilación N-terminal
Estabilidad proteica
La acetilación N-terminal de proteínas puede afectar la estabilidad de las proteínas, pero los resultados y el mecanismo no eran muy claros hasta ahora. Se creía que la acetilación N-terminal protege a las proteínas de la degradación, ya que se suponía que los N-terminales de Nα-acetilación bloquean la ubiquitinación N-terminal y la subsiguiente degradación de la proteína . Sin embargo, varios estudios han demostrado que la proteína acetilada N-terminal tiene una tasa de degradación similar a la de las proteínas con un N-terminal no bloqueado.
Localización de proteínas
Se ha demostrado que la acetilación N-terminal puede dirigir la localización de proteínas. Arl3p es una de las GTPasas 'tipo Arf' (Arl) , que es crucial para la organización del tráfico de membranas. Requiere su grupo Nα-acetilo para dirigirse a la membrana de Golgi mediante la interacción con la proteína Sys1p que reside en la membrana de Golgi. Si Phe o Tyr se reemplaza por un Ala en el N-terminal de Arl3p, ya no puede localizarse en la membrana de Golgi, lo que indica que Arl3p necesita sus residuos N-terminales naturales que podrían acetilarse para una localización adecuada.
Metabolismo y apoptosis.
También se ha demostrado que la acetilación N-terminal de proteínas se relaciona con la regulación del ciclo celular y la apoptosis con experimentos de eliminación de proteínas. La caída del complejo NatA o NatC conduce a la inducción de apoptosis dependiente de p53 , lo que puede indicar que las proteínas antiapoptóticas eran menos funcionales o ya no funcionaban debido a la reducción de la acetilación del extremo N de la proteína. Pero, por el contrario, la caspasa-2 , que es acetilada por NatA, puede interactuar con la proteína adaptadora RIP asociada a la proteína homóloga Ich-1 / Ced-3 con un dominio de muerte (RAIDD). Esto podría activar la caspasa-2 e inducir la apoptosis celular .
Síntesis de proteínas
Las proteínas ribosómicas juegan un papel importante en la síntesis de proteínas, que también podrían acetilarse en el extremo N-terminal. La acetilación N-terminal de las proteínas del ribosoma puede tener un efecto sobre la síntesis de proteínas. Se observó una disminución del 27% y 23% en la tasa de síntesis de proteínas con las cepas de deleción NatA y NatB. Se observó una reducción de la fidelidad de la traducción en la cepa de deleción de NatA y se observó un defecto en el ribosoma en la cepa de deleción de NatB.
Cáncer
Se ha sugerido que los NAT actúan como oncoproteínas y supresores de tumores en cánceres humanos, y la expresión de NAT puede aumentar y disminuir en las células cancerosas. La expresión ectópica de hNaa10p aumentó la proliferación celular y la regulación positiva del gen involucrado en la proliferación y el metabolismo de la supervivencia celular . La sobreexpresión de hNaa10p estaba en el cáncer de vejiga urinaria , cáncer de mama y carcinoma de cuello uterino . Pero un alto nivel de expresión de hNaa10p también podría suprimir el crecimiento tumoral y un nivel reducido de hNaa10p expresado se asocia con un mal pronóstico, tumores grandes y más metástasis en los ganglios linfáticos.
Tabla 2. Resumen de la expresión de subunidades de NatA en varios tejidos cancerosos
| Subunidades nat | Tejido canceroso | Patrón de expresión |
|---|---|---|
| hNaa10 | cáncer de pulmón , cáncer de mama , cáncer colorrectal , carcinoma hepatocelular | alto en tumores |
| hNaa10 | cáncer de pulmón , cáncer de mama , cáncer de páncreas , cáncer de ovario | pérdida de heterocigosidad en tumores |
| hNaa10 | cáncer de mama , cáncer gástrico , cáncer de pulmón | alto en tumores primarios, pero bajo con metástasis en los ganglios linfáticos |
| hNaa10 | Cáncer de pulmón de células no pequeñas | bajo en tumores |
| hNaa15 | carcinoma papilar de tiroides , cáncer gástrico | alto en tumores |
| hNaa15 | neuroblastoma | alto en tumores en estadio avanzado |
| hNaa11 | carcinoma hepatocelular | pérdida de heterocigosidad en tumores |
Acetilación y desacetilación de lisina
Las proteínas se acetilan típicamente en residuos de lisina y esta reacción se basa en acetil-coenzima A como donante de grupo acetilo. En la acetilación y desacetilación de histonas, las proteínas de histonas se acetilan y desacetilan en residuos de lisina en la cola N-terminal como parte de la regulación génica . Normalmente, estas reacciones son catalizadas por enzimas con actividad histona acetiltransferasa (HAT) o histona desacetilasa (HDAC), aunque las HAT y HDAC también pueden modificar el estado de acetilación de proteínas que no son histonas.
La regulación de factores de transcripción, proteínas efectoras, chaperonas moleculares y proteínas citoesqueléticas por acetilación y desacetilación es un importante mecanismo regulador postraduccional. Estos mecanismos reguladores son análogos a la fosforilación y desfosforilación por la acción de quinasas y fosfatasas . El estado de acetilación de una proteína no solo puede modificar su actividad, sino que se ha sugerido recientemente que esta modificación postraduccional también puede dialogar con la fosforilación , metilación , ubiquitinación , sumoilación y otras para el control dinámico de la señalización celular. La regulación de la proteína tubulina es un ejemplo de esto en neuronas de ratón y astroglia. Una tubulina acetiltransferasa se encuentra en el axonema y acetila la subunidad α-tubulina en un microtúbulo ensamblado. Una vez desmontada, esta acetilación es eliminada por otra desacetilasa específica en el citosol celular. Por tanto, los microtúbulos axonémicos, que tienen una vida media larga, llevan una "acetilación característica", que está ausente en los microtúbulos citosólicos que tienen una vida media más corta.
En el campo de la epigenética , se ha demostrado que la acetilación (y desacetilación ) de histonas son mecanismos importantes en la regulación de la transcripción de genes. Sin embargo, las histonas no son las únicas proteínas reguladas por la acetilación postraduccional . Los siguientes son ejemplos de varias otras proteínas con funciones en la regulación de la transducción de señales, cuyas actividades también se ven afectadas por la acetilación y desacetilación.
p53
La proteína p53 es un supresor de tumores que juega un papel importante en las transacciones de señales en las células, especialmente en el mantenimiento de la estabilidad del genoma al prevenir la mutación. Por lo tanto, también se le conoce como "el guardián del genoma". También regula el ciclo celular y detiene el crecimiento celular activando un regulador del ciclo celular, p21 . En caso de daño severo del ADN , también inicia la muerte celular programada . de p53 está regulada negativamente por la oncoproteína Mdm2 . Los estudios sugirieron que Mdm2 formará un complejo con p53 y evitará que se una a genes específicos que responden a p53.
Acetilación de p53
La acetilación de p53 es indispensable para su activación. Se ha informado que el nivel de acetilación de p53 aumentará significativamente cuando la célula sufra estrés. Se han observado sitios de acetilación en el dominio de unión al ADN (K164 y K120) y el terminal C. Los sitios de acetilación demuestran una redundancia significativa: si solo un sitio de acetilación se inactiva por mutación a arginina, todavía se observa la expresión de p21 . Sin embargo, si se bloquean múltiples sitios de acetilación, la expresión de p21 y la supresión del crecimiento celular causada por p53 se pierden por completo. Además, la acetilación de p53 evita su unión al represor Mdm2 en el ADN. Además, se sugiere que la acetilación de p53 es crucial para sus funciones proapoptóticas independientes de la transcripción . Se investigó un sitio de acetilación del extremo C-terminal mediante simulaciones de dinámica molecular y espectroscopía de dicroísmo circular , y se sugirió que la acetilación cambia el conjunto estructural del extremo C-terminal.
Implicaciones para la terapia del cáncer
Dado que la función principal de p53 es supresor de tumores , la idea de que la activación de p53 es una estrategia atractiva para el tratamiento del cáncer. Nutlin-3 es una molécula pequeña diseñada para apuntar a la interacción p53 y Mdm2 que evitó que p53 se desactivara. Los informes también mostraron que la célula cancerosa bajo el tratamiento con Nutilina-3a, se observó acetilación de lys 382 en el c-terminal de p53.
Microtúbulos
La estructura de los microtúbulos es un cilindro largo y hueco ensamblado dinámicamente a partir de dímeros de tubulina α / β . Desempeñan un papel esencial en el mantenimiento de la estructura de la célula, así como en los procesos celulares, por ejemplo, el movimiento de los orgánulos . Además, los microtúbulos se encargan de formar el huso mitótico en las células eucariotas para transportar los cromosomas en la división celular .
Acetilación de tubulina
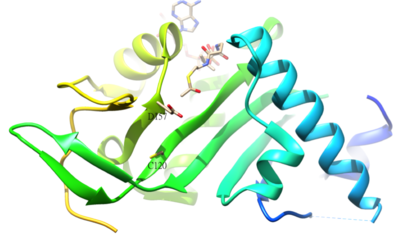
El residuo acetilado de α- tubulina es K40, que es catalizado por α-tubulina acetiltransferasa (α-TAT) en humanos. La acetilación de K40 en α-tubulina es un sello distintivo de los microtúbulos estables . Los residuos del sitio activo D157 y C120 de α-TAT1 son responsables de la catálisis debido a la forma complementaria de α-Tubulina. Además, algunas características estructurales únicas como las regiones de horquilla β4-β5 , bucle C-terminal y bucle α1-α2 son importantes para el reconocimiento molecular específico de la α-tubulina . La reacción inversa de la acetilación es catalizada por la histona desacetilasa 6.
Implicaciones para la terapia del cáncer
Dado que los microtúbulos desempeñan un papel importante en la división celular , especialmente en la fase G2 / M del ciclo celular , se han realizado intentos para impedir la función de los microtúbulos utilizando inhibidores de moléculas pequeñas, que se han utilizado con éxito en clínicas como terapias contra el cáncer. Por ejemplo, los alcaloides y taxanos de la vinca se unen e inhiben selectivamente los microtúbulos , lo que conduce a la detención del ciclo celular. La identificación de la estructura cristalina de la acetilación de la α-tubulina acetiltransferasa (α-TAT) también arroja luz sobre el descubrimiento de una molécula pequeña que podría modular la estabilidad o despolimerización de la tubulina . En otras palabras, al dirigirse a α-TAT, es posible evitar la acetilación de la tubulina y dar como resultado la desestabilización de la tubulina, que es un mecanismo similar para los agentes desestabilizadores de tubulina.
STAT3
El transductor de señal y activador de la transcripción 3 ( STAT3 ) es un factor de transcripción que es fosforilado por quinasas asociadas al receptor , por ejemplo, tirosina quinasas de la familia Janus , y que se transloca al núcleo . STAT3 regula varios genes en respuesta a factores de crecimiento y citocinas y juega un papel importante en el crecimiento celular. Por lo tanto, STAT3 facilita la oncogénesis en una variedad de vías relacionadas con el crecimiento celular. Por otro lado, también juega un papel en el supresor de tumores .
Acetilación de STAT3
La acetilación de Lys685 de STAT3 es importante para STAT3 homo-dimerización, que es esencial para la unión al ADN y la activación transcripcional de oncogenes . La acetilación de STAT3 es catalizada por la histona acetiltransferasa p300 y revertida por la histona desacetilasa tipo 1 . La acetilación de lisina de STAT3 también está elevada en las células cancerosas.
Implicaciones terapéuticas para la terapia del cáncer
Dado que la acetilación de STAT3 es importante por su actividad oncogénica y el hecho de que el nivel de STAT3 acetilado es alto en las células cancerosas, se da a entender que apuntar a STAT3 acetilado para quimioprevención y quimioterapia es una estrategia prometedora. Esta estrategia está respaldada por el tratamiento del resveratrol , un inhibidor de la acetilación de STAT3, en la línea de células cancerosas que revierte la metilación aberrante de la isla CpG.