Tubulina - Tubulin
| Tubulina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 kif1a estructura del complejo cabeza-microtúbulos en forma atp
| |||||||||
| Identificadores | |||||||||
| Símbolo | Tubulina | ||||||||
| Pfam | PF00091 | ||||||||
| Clan pfam | CL0442 | ||||||||
| InterPro | IPR003008 | ||||||||
| PROSITE | PDOC00201 | ||||||||
| SCOP2 | 1tub / SCOPe / SUPFAM | ||||||||
| |||||||||
Tubulina en biología molecular puede referirse a la superfamilia de proteínas de tubulina de proteínas globulares , o una de las proteínas miembro de esa superfamilia. Las α y β-tubulinas se polimerizan en microtúbulos , un componente principal del citoesqueleto eucariótico . Los microtúbulos funcionan en muchos procesos celulares esenciales, incluida la mitosis . Los fármacos que se unen a la tubulina matan las células cancerosas al inhibir la dinámica de los microtúbulos, que son necesarios para la segregación del ADN y, por lo tanto, la división celular .
En eucariotas hay seis miembros de la superfamilia de tubulina, aunque no todos están presentes en todas las especies (ver más abajo ). Tanto las tubulinas α como las β tienen una masa de alrededor de 50 kDa y, por lo tanto, están en un rango similar en comparación con la actina (con una masa de ~ 42 kDa). Por el contrario, los polímeros de tubulina (microtúbulos) tienden a ser mucho más grandes que los filamentos de actina debido a su naturaleza cilíndrica.
Durante mucho tiempo se pensó que la tubulina era específica de los eucariotas . Más recientemente, sin embargo, se ha demostrado que varias proteínas procariotas están relacionadas con la tubulina.
Caracterización
La tubulina se caracteriza por la familia de tubulina / FtsZ conservada evolutivamente, dominio de proteína GTPasa .
Este dominio de la proteína GTPasa se encuentra en todas las cadenas de tubulina eucariotas, así como en la proteína bacteriana TubZ, la proteína de arqueas CetZ y la familia de proteínas FtsZ muy extendida en Bacteria y Archaea .
Función
Microtúbulos
La α y β-tubulina se polimerizan en microtúbulos dinámicos . En eucariotas , los microtúbulos son uno de los componentes principales del citoesqueleto y funcionan en muchos procesos, incluido el soporte estructural, el transporte intracelular y la segregación del ADN.
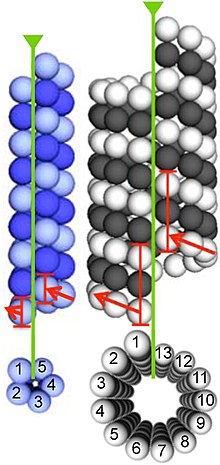
Los microtúbulos se ensamblan a partir de dímeros de α y β-tubulina. Estas subunidades son ligeramente ácidas con un punto isoeléctrico entre 5,2 y 5,8. Cada uno tiene un peso molecular de aproximadamente 50 kDa.
Para formar microtúbulos, los dímeros de α- y β-tubulina se unen a GTP y se ensamblan en los extremos (+) de los microtúbulos mientras se encuentran en el estado de unión a GTP. La subunidad de β-tubulina se expone en el extremo positivo del microtúbulo mientras que la subunidad de α-tubulina se expone en el extremo negativo. Después de que el dímero se incorpora al microtúbulo, la molécula de GTP unida a la subunidad de β-tubulina finalmente se hidroliza en GDP a través de contactos entre dímeros a lo largo del protofilamento del microtúbulo . La molécula de GTP unida a la subunidad α-tubulina no se hidroliza durante todo el proceso. El hecho de que el miembro de β-tubulina del dímero de tubulina esté unido a GTP o GDP influye en la estabilidad del dímero en el microtúbulo. Los dímeros unidos a GTP tienden a ensamblarse en microtúbulos, mientras que los dímeros unidos a GDP tienden a desintegrarse; por tanto, este ciclo de GTP es esencial para la inestabilidad dinámica de los microtúbulos.
Microtúbulos bacterianos
Se han identificado homólogos de α- y β-tubulina en el género de bacterias Prosthecobacter . Se denominan BtubA y BtubB para identificarlos como tubulinas bacterianas. Ambos exhiben homología tanto con la α- como con la β-tubulina. Aunque estructuralmente son muy similares a las tubulinas eucariotas, tienen varias características únicas, que incluyen el plegamiento sin chaperón y la dimerización débil. La microscopía electrónica criogénica mostró que BtubA / B forma microtúbulos in vivo , y sugirió que estos microtúbulos comprenden solo cinco protofilamentos, en contraste con los microtúbulos eucariotas, que generalmente contienen 13. Estudios posteriores in vitro han demostrado que BtubA / B forma cuatro hebras 'mini -microtúbulos '.
División procariota
FtsZ se encuentra en casi todas las bacterias y arqueas , donde funciona en la división celular , localizándose en un anillo en el medio de la célula en división y reclutando otros componentes del divisoma, el grupo de proteínas que juntas constriñen la envoltura celular para pellizcar el célula, produciendo dos células hijas. FtsZ puede polimerizar en tubos, láminas y anillos in vitro y forma filamentos dinámicos in vivo .
TubZ funciona segregando plásmidos de bajo número de copias durante la división celular bacteriana . La proteína forma una estructura inusual para un homólogo de tubulina; dos filamentos helicoidales se envuelven entre sí. Esto puede reflejar una estructura óptima para esta función, ya que la proteína de partición de plásmidos no relacionada ParM exhibe una estructura similar.
Forma de la celda
CetZ funciona en cambios de forma celular en Haloarchaea pleomórfica . En Haloferax volcanii , CetZ forma estructuras citoesqueléticas dinámicas necesarias para la diferenciación de una forma de célula en forma de placa en una forma en forma de barra que exhibe motilidad de natación.
Tipos
Eucariota
La superfamilia de tubulina contiene seis familias (alfa- (α), beta- (β), gamma- (γ), delta- (δ), épsilon- (ε) y zeta- (ζ) tubulinas).
α-tubulina
Los subtipos de α-tubulina humana incluyen:
β-tubulina

Todos los fármacos que se sabe que se unen a la tubulina humana se unen a la β-tubulina. Estos incluyen paclitaxel , colchicina y los alcaloides de la vinca , cada uno de los cuales tiene un sitio de unión distinto en la β-tubulina.
Además, varios fármacos antiparasitarios se dirigen preferentemente al sitio de colchicina de la β-tubulina en los gusanos en lugar de en eucariotas superiores. Mientras que el mebendazol aún conserva cierta afinidad de unión a la β-tubulina humana y de Drosophilia , el albendazol se une casi exclusivamente a la β-tubulina de gusanos y otros eucariotas inferiores.
La β-tubulina de clase III es un elemento de microtúbulos expresado exclusivamente en neuronas y es un identificador popular específico para neuronas en el tejido nervioso. Se une a la colchicina mucho más lentamente que otros isotipos de β-tubulina.
La β1-tubulina , a veces llamada β-tubulina de clase VI, es la más divergente a nivel de secuencia de aminoácidos. Se expresa exclusivamente en megacariocitos y plaquetas en humanos y parece jugar un papel importante en la formación de plaquetas. Cuando la β-tubulina de clase VI se expresó en células de mamíferos, causan la interrupción de la red de microtúbulos, la formación de fragmentos de microtúbulos y, en última instancia, pueden causar estructuras en forma de bandas marginales presentes en megacariocitos y plaquetas.
La katanina es un complejo proteico que corta los microtúbulos en las subunidades de β-tubulina y es necesaria para el transporte rápido de microtúbulos en las neuronas y en las plantas superiores.
Los subtipos de β-tubulinas humanas incluyen:
γ-tubulina
La γ-tubulina, otro miembro de la familia de la tubulina, es importante en la nucleación y orientación polar de los microtúbulos. Se encuentra principalmente en centrosomas y cuerpos polares del huso , ya que estas son las áreas de nucleación de microtúbulos más abundantes. En estos orgánulos, varias moléculas de γ-tubulina y otras proteínas se encuentran en complejos conocidos como complejos de anillo de γ-tubulina (γ-TuRC), que imitan químicamente el extremo (+) de un microtúbulo y, por lo tanto, permiten que los microtúbulos se unan. La γ-tubulina también se ha aislado como un dímero y como parte de un pequeño complejo de γ-tubulina (γTuSC), de tamaño intermedio entre el dímero y el γTuRC. La γ-tubulina es el mecanismo mejor entendido de nucleación de microtúbulos, pero ciertos estudios han indicado que ciertas células pueden adaptarse a su ausencia, como lo indican los estudios de mutación y ARNi que han inhibido su expresión correcta. Además de formar un γ-TuRC para nuclear y organizar los microtúbulos, la γ-tubulina puede polimerizar en filamentos que se ensamblan en haces y mallas.
Los subtipos de γ-tubulina humana incluyen:
Miembros del complejo de anillos de γ-tubulina:
δ y ε-tubulina
Se ha descubierto que la tubulina delta (δ) y épsilon (ε) se localiza en los centríolos y puede desempeñar un papel en la estructura y función de los centríolos , aunque ninguna de las dos está tan bien estudiada como las formas α y β.
Los genes de δ- y ε-tubulina humanos incluyen:
ζ-Tubulina
La zeta-tubulina ( IPR004058 ) está presente en muchos eucariotas, pero falta en otros, incluidos los mamíferos placentarios. Se ha demostrado que está asociado con la estructura basal del pie de los centriolos en células epiteliales multiciliadas.
Procariota
BtubA / B
BtubA ( Q8GCC5 ) y BtubB ( Q8GCC1 ) se encuentran en algunas especies bacterianas del género Verrucomicrobiano Prosthecobacter . Su relación evolutiva con las tubulinas eucariotas no está clara, aunque pueden haber descendido de un linaje eucariota por transferencia lateral de genes . En comparación con otros homólogos bacterianos, son mucho más similares a las tubulinas eucariotas. En una estructura ensamblada, BtubB actúa como α-tubulina y BtubA actúa como β-tubulina.
FtsZ
Muchas células bacterianas y euriarqueotales usan FtsZ para dividirse mediante fisión binaria . Todos los cloroplastos y algunas mitocondrias , ambos orgánulos derivados de la endosimbiosis de bacterias, también utilizan FtsZ. Fue la primera proteína citoesquelética procariota identificada.
TubZ
TubZ ( Q8KNP3 ; pBt156) se identificó en Bacillus thuringiensis como esencial para el mantenimiento del plásmido . Se une a una proteína de unión al ADN llamada TubR ( Q8KNP2 ; pBt157) para tirar del plásmido.
CetZ
CetZ ( D4GVD7 ) se encuentra en los clados euryarchaeal de Methanomicrobia y Halobacteria , donde funciona en la diferenciación de la forma celular.
Tubulinas fagos
Los fagos del género Phikzlikevirus , así como el fago PCH45 de Serratia , utilizan una proteína de capa ( Q8SDA8 ) para construir una estructura similar a un núcleo llamada núcleo del fago. Esta estructura encierra el ADN, así como la maquinaria de replicación y transcripción. Protege el ADN del fago de las defensas del huésped, como las enzimas de restricción y los sistemas CRISPR- Cas de tipo I. Una tubulina formadora de huso , denominada de forma diversa PhuZ ( B3FK34 ) y gp187 , centra el núcleo en la célula.
Farmacología
Las tubulinas son el objetivo de los medicamentos contra el cáncer , como los alcaloides de la vinca , vinblastina y vincristina , y paclitaxel . Los fármacos anti-gusano mebendazol y albendazol , así como la anti- gota agente colchicina se unen a la formación de microtúbulos de tubulina e inhiben. Mientras que el primero conduce finalmente a la muerte celular en los gusanos, el segundo detiene la motilidad de los neutrófilos y disminuye la inflamación en los seres humanos. El fármaco antifúngico griseofulvina se dirige a la formación de microtúbulos y tiene aplicaciones en el tratamiento del cáncer.
Modificaciones postraduccionales
Cuando se incorpora a los microtúbulos, la tubulina acumula una serie de modificaciones postraduccionales , muchas de las cuales son exclusivas de estas proteínas. Estas modificaciones incluyen destirosinación , acetilación , poliglutamilación , poliglicilación , fosforilación , ubiquitinación , sumoilación y palmitoilación . La tubulina también es propensa a la modificación oxidativa y la agregación durante, por ejemplo, una lesión celular aguda.
En la actualidad existen muchas investigaciones científicas sobre la acetilación que se realiza en algunos microtúbulos, especialmente la de la α-tubulina N-acetiltransferasa (ATAT1) que está demostrando que juega un papel importante en muchas funciones biológicas y moleculares y, por tanto, también se asocia con muchas enfermedades humanas, especialmente enfermedades neurológicas .
Ver también
Referencias
enlaces externos
- Tubulina en los títulos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- EC 3.6.5.6
- Protocolos para experimentos con tubulina
- Infografía de tubulina de alta resolución


