Biomarcador de cáncer - Cancer biomarker
Un biomarcador de cáncer se refiere a una sustancia o proceso que indica la presencia de cáncer en el cuerpo. Un biomarcador puede ser una molécula secretada por un tumor o una respuesta específica del cuerpo a la presencia de cáncer. Los biomarcadores genéticos , epigenéticos , proteómicos , glicómicos y de imágenes se pueden utilizar para el diagnóstico, el pronóstico y la epidemiología del cáncer. Idealmente, dichos biomarcadores se pueden analizar en biofluidos recolectados de forma no invasiva como sangre o suero.
Si bien existen numerosos desafíos para trasladar la investigación de biomarcadores al espacio clínico; una serie de biomarcadores basados en genes y proteínas ya se han utilizado en algún momento en la atención al paciente; incluyendo, AFP ( cáncer de hígado ), BCR-ABL ( leucemia mieloide crónica ), BRCA1 / BRCA2 ( cáncer de mama / ovario ), BRAF V600E ( melanoma / cáncer colorrectal ), CA-125 (cáncer de ovario), CA19.9 ( cáncer de páncreas ), CEA (cáncer colorrectal), EGFR ( carcinoma de pulmón de células no pequeñas ), HER-2 (cáncer de mama), KIT ( tumor del estroma gastrointestinal ), PSA (antígeno prostático específico) ( cáncer de próstata ), S100 (melanoma), y muchos otros. Se ha informado que las propias proteínas mutantes detectadas mediante el monitoreo de reacciones seleccionadas (SRM) son los biomarcadores más específicos para los cánceres porque solo pueden provenir de un tumor existente. Aproximadamente el 40% de los cánceres se pueden curar si se detectan a tiempo mediante exámenes.
Definiciones de biomarcadores del cáncer
Las organizaciones y publicaciones varían en su definición de biomarcador . En muchas áreas de la medicina, los biomarcadores se limitan a proteínas identificables o medibles en la sangre u orina . Sin embargo, el término se usa a menudo para cubrir cualquier propiedad molecular, bioquímica, fisiológica o anatómica que pueda cuantificarse o medirse.
El Instituto Nacional del Cáncer (NCI), en particular, define el biomarcador como: “Una molécula biológica que se encuentra en la sangre, otros fluidos corporales o tejidos que es un signo de un proceso normal o anormal, o de una condición o enfermedad. Se puede usar un biomarcador para ver qué tan bien responde el cuerpo al tratamiento de una enfermedad o afección. También se llama marcador molecular y molécula de firma ".
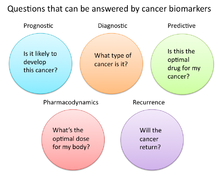
En la investigación y la medicina del cáncer, los biomarcadores se utilizan de tres formas principales:
- Para ayudar a diagnosticar afecciones, como en el caso de identificar cánceres en etapa temprana (diagnóstico)
- Para pronosticar qué tan agresiva es una condición, como en el caso de determinar la capacidad de un paciente para actuar en ausencia de tratamiento (pronóstico)
- Para predecir qué tan bien responderá un paciente al tratamiento (predictivo)
Papel de los biomarcadores en la investigación y la medicina del cáncer
Usos de biomarcadores en la medicina del cáncer
Evaluación de riesgos
Los biomarcadores del cáncer, en particular los asociados con mutaciones genéticas o alteraciones epigenéticas , a menudo ofrecen una forma cuantitativa de determinar cuándo los individuos están predispuestos a determinados tipos de cáncer. Ejemplos notables de biomarcadores de cáncer potencialmente predictivos incluyen mutaciones en los genes KRAS , p53 , EGFR , erbB2 para cáncer colorrectal , de esófago , hígado y páncreas ; mutaciones de los genes BRCA1 y BRCA2 para cáncer de mama y de ovario ; metilación anormal de los genes supresores de tumores p16 , CDKN2B y p14ARF para el cáncer de cerebro ; hipermetilación de MYOD1 , CDH1 y CDH13 para el cáncer de cuello uterino ; e hipermetilación de p16 , p14 y RB1 , para el cáncer oral .
Diagnóstico
Los biomarcadores del cáncer también pueden ser útiles para establecer un diagnóstico específico. Este es particularmente el caso cuando existe la necesidad de determinar si los tumores son de origen primario o metastásico . Para hacer esta distinción, los investigadores pueden analizar las alteraciones cromosómicas que se encuentran en las células ubicadas en el sitio del tumor primario frente a las que se encuentran en el sitio secundario. Si las alteraciones coinciden, el tumor secundario puede identificarse como metastásico; mientras que si las alteraciones difieren, el tumor secundario puede identificarse como un tumor primario distinto. Por ejemplo, las personas con tumores tienen altos niveles de ADN tumoral circulante (ADNct) debido a células tumorales que han pasado por apoptosis. Este marcador tumoral se puede detectar en la sangre, la saliva o la orina. Recientemente se ha cuestionado la posibilidad de identificar un biomarcador eficaz para el diagnóstico temprano del cáncer, a la luz de la alta heterogeneidad molecular de los tumores observada en los estudios de secuenciación de próxima generación.
Predicciones de pronóstico y tratamiento
Otro uso de los biomarcadores en la medicina del cáncer es para el pronóstico de la enfermedad , que tiene lugar después de que a una persona se le ha diagnosticado cáncer. Aquí, los biomarcadores pueden ser útiles para determinar la agresividad de un cáncer identificado, así como su probabilidad de responder a un tratamiento determinado. En parte, esto se debe a que los tumores que exhiben biomarcadores particulares pueden responder a tratamientos vinculados a la expresión o presencia de ese biomarcador. Ejemplos de tales biomarcadores de pronóstico incluyen niveles elevados de inhibidor de metalopeptidasa 1 (TIMP1) , un marcador asociado con formas más agresivas de mieloma múltiple , expresión elevada de receptor de estrógeno (RE) y / o receptor de progesterona (PR) , marcadores asociados con una mejor supervivencia general en pacientes con cáncer de mama; Amplificación del gen HER2 / neu , un marcador que indica que un cáncer de mama probablemente responderá al tratamiento con trastuzumab ; una mutación en el exón 11 del protooncogén c-KIT , un marcador que indica que un tumor del estroma gastrointestinal (GIST) probablemente responderá al tratamiento con imatinib ; y mutaciones en el dominio de tirosina quinasa de EGFR1 , un marcador que indica que el carcinoma de pulmón de células no pequeñas (CPCNP) de un paciente probablemente responderá al tratamiento con gefitinib o erlotinib .
Farmacodinámica y farmacocinética
Los biomarcadores del cáncer también se pueden utilizar para determinar el régimen de tratamiento más eficaz para el cáncer de una persona en particular. Debido a las diferencias en la composición genética de cada persona, algunas personas metabolizan o cambian la estructura química de los medicamentos de manera diferente. En algunos casos, la disminución del metabolismo de ciertos medicamentos puede crear condiciones peligrosas en las que se acumulan altos niveles del medicamento en el cuerpo. Como tal, las decisiones sobre la dosificación de fármacos, en particular los tratamientos contra el cáncer, pueden beneficiarse del cribado de dichos biomarcadores. Un ejemplo es el gen que codifica la enzima tiopurina metiltransferasa (TPMPT) . Las personas con mutaciones en el gen TPMT no pueden metabolizar grandes cantidades del fármaco contra la leucemia , mercaptopurina , que potencialmente causa una caída fatal en el recuento de glóbulos blancos en estos pacientes. Por lo tanto, se recomienda que los pacientes con mutaciones en TPMT reciban una dosis más baja de mercaptopurina por razones de seguridad.
Seguimiento de la respuesta al tratamiento
Los biomarcadores del cáncer también han demostrado su utilidad para controlar qué tan bien está funcionando un tratamiento a lo largo del tiempo. Se están realizando muchas investigaciones en esta área en particular, ya que los biomarcadores exitosos tienen el potencial de proporcionar una reducción significativa de los costos en la atención del paciente, ya que las pruebas actuales basadas en imágenes, como la tomografía computarizada y la resonancia magnética para monitorear el estado del tumor, son muy costosas.
Un biomarcador notable que atrae una atención significativa es el biomarcador proteico S100 -beta en el seguimiento de la respuesta del melanoma maligno . En tales melanomas, los melanocitos , las células que producen el pigmento en nuestra piel, producen la proteína S100-beta en altas concentraciones dependiendo de la cantidad de células cancerosas. Por tanto, la respuesta al tratamiento se asocia con niveles reducidos de S100-beta en la sangre de dichos individuos.
De manera similar, investigaciones de laboratorio adicionales han demostrado que las células tumorales que experimentan apoptosis pueden liberar componentes celulares como el citocromo c , nucleosomas , citoqueratina 18 escindida y E-cadherina . Los estudios han encontrado que estas macromoléculas y otras se pueden encontrar en circulación durante la terapia del cáncer, lo que proporciona una fuente potencial de métricas clínicas para monitorear el tratamiento.
Reaparición
Los biomarcadores del cáncer también pueden ofrecer valor para predecir o controlar la recurrencia del cáncer . El ensayo de cáncer de mama Oncotype DX® es una de esas pruebas que se utiliza para predecir la probabilidad de recurrencia del cáncer de mama. Esta prueba está destinada a mujeres con cáncer de mama invasivo con receptor de estrógeno positivo (ER +) , receptor de estrógeno negativo (ER +) en estadio temprano (estadio I o II), que serán tratadas con terapia hormonal . Oncotype DX analiza un panel de 21 genes en células extraídas durante la biopsia del tumor . Los resultados de la prueba se dan en forma de una puntuación de recurrencia que indica la probabilidad de recurrencia a los 10 años.
Usos de biomarcadores en la investigación del cáncer
Desarrollo de objetivos farmacológicos
Además de su uso en la medicina del cáncer, los biomarcadores se utilizan a menudo durante todo el proceso de descubrimiento de fármacos contra el cáncer. Por ejemplo, en la década de 1960, los investigadores descubrieron que la mayoría de los pacientes con leucemia mielógena crónica poseían una anomalía genética particular en los cromosomas 9 y 22 denominados cromosoma Filadelfia . Cuando estos dos cromosomas se combinan, crean un gen cancerígeno conocido como BCR-ABL . En tales pacientes, este gen actúa como el principal punto inicial en todas las manifestaciones fisiológicas de la leucemia. Durante muchos años, el BCR-ABL se utilizó simplemente como un biomarcador para estratificar un cierto subtipo de leucemia. Sin embargo, los desarrolladores de fármacos finalmente pudieron desarrollar imatinib , un fármaco poderoso que inhibió eficazmente esta proteína y disminuyó significativamente la producción de células que contienen el cromosoma Filadelfia.
Criterios de valoración sustitutos
Otra área prometedora de aplicación de biomarcadores se encuentra en el área de criterios de valoración sustitutos . En esta aplicación, los biomarcadores actúan como sustitutos de los efectos de un fármaco en la progresión y supervivencia del cáncer. Idealmente, el uso de biomarcadores validados evitaría que los pacientes tuvieran que someterse a biopsias de tumores y ensayos clínicos prolongados para determinar si un nuevo fármaco funciona. En el estándar de atención actual, la métrica para determinar la efectividad de un medicamento es verificar si ha disminuido la progresión del cáncer en humanos y, en última instancia, si prolonga la supervivencia. Sin embargo, los sustitutos de biomarcadores exitosos podrían ahorrar mucho tiempo, esfuerzo y dinero si los medicamentos que fallan pudieran eliminarse de la línea de desarrollo antes de llevarlos a los ensayos clínicos.
Algunas características ideales de los biomarcadores de criterio de valoración sustitutos incluyen:
- El biomarcador debe estar involucrado en el proceso que causa el cáncer.
- Los cambios en el biomarcador deben correlacionarse con los cambios en la enfermedad.
- Los niveles de biomarcadores deben ser lo suficientemente altos como para que puedan medirse de manera fácil y confiable.
- Los niveles o la presencia de biomarcadores deben distinguir fácilmente entre tejido normal, canceroso y precanceroso.
- El tratamiento eficaz del cáncer debería cambiar el nivel del biomarcador.
- El nivel del biomarcador no debe cambiar espontáneamente o en respuesta a otros factores no relacionados con el tratamiento exitoso del cáncer.
Dos áreas en particular que están recibiendo atención como marcadores sustitutos incluyen las células tumorales circulantes (CTC) y los miARN circulantes . Ambos marcadores están asociados con el número de células tumorales presentes en la sangre y, como tales, se espera que proporcionen un sustituto de la progresión del tumor y la metástasis . Sin embargo, las barreras importantes para su adopción incluyen la dificultad de enriquecer, identificar y medir los niveles de CTC y miARN en sangre. Es probable que se necesiten nuevas tecnologías e investigación para su traducción en atención clínica.
Tipos de biomarcadores del cáncer
Biomarcadores de cáncer molecular
| Tipo de tumor | Biomarcador |
|---|---|
| Seno | ER / PR (receptor de estrógeno / receptor de progesterona) |
| HER-2 / neu | |
| Colorrectal | EGFR |
| KRAS | |
| UGT1A1 | |
| Gástrico | HER-2 / neu |
| ESENCIA | c-KIT |
| Leucemia / linfoma | CD20 |
| CD30 | |
| FIP1L1 - PDGFRalpha | |
| PDGFR | |
| Cromosoma Filadelfia ( BCR / ABL ) | |
| PML / RAR-alfa | |
| TPMT | |
| UGT1A1 | |
| Pulmón | EML4 / ALK |
| EGFR | |
| KRAS | |
| Melanoma | BRAF |
| Páncreas | Niveles elevados de leucina , isoleucina y valina |
| Ovarios | CA-125 |
Otros ejemplos de biomarcadores:
- Supresores de tumores perdidos en el cáncer
- ARN
- Proteínas que se encuentran en los fluidos o tejidos corporales.
- Ejemplos: antígeno prostático específico y CA-125
- Anticuerpos contra los antígenos del cáncer
- Ejemplos: poliomavirus de células de Merkel
- ADN
- Ejemplos: ADN tumoral circulante ( ADNct )
Biomarcadores de cáncer sin especificidad
No todos los biomarcadores del cáncer tienen que ser específicos de los tipos de cáncer. Algunos biomarcadores que se encuentran en el sistema circulatorio pueden usarse para determinar un crecimiento anormal de las células presentes en el cuerpo. Todos estos tipos de biomarcadores se pueden identificar a través de análisis de sangre de diagnóstico, que es una de las principales razones para someterse a pruebas de salud con regularidad. Al hacerse pruebas con regularidad, muchos problemas de salud, como el cáncer, se pueden descubrir en una etapa temprana, evitando muchas muertes.
Se ha demostrado que la proporción de neutrófilos a linfocitos es un determinante no específico para muchos cánceres. Esta relación se centra en la actividad de dos componentes del sistema inmunológico que participan en la respuesta inflamatoria, que se muestra mayor en presencia de tumores malignos. Además, el factor de crecimiento de fibroblastos básico ( bFGF ) es una proteína que participa en la proliferación de células. Desafortunadamente, se ha demostrado que en presencia de tumores es muy activo, lo que ha llevado a la conclusión de que puede ayudar a que las células malignas se reproduzcan a un ritmo más rápido. La investigación ha demostrado que los anticuerpos anti-bFGF pueden usarse para ayudar a tratar tumores de muchos orígenes. Además, el factor de crecimiento similar a la insulina (IGF-R) participa en la proliferación y el crecimiento celular. Es posible que esté involucrado en la inhibición de la apoptosis, muerte celular programada por algún defecto. Debido a esto, los niveles de IGF-R pueden aumentar cuando hay cáncer como el de mama, próstata, pulmón y colorrecto.
| Biomarcador | Descripción | Biosensor utilizado |
|---|---|---|
| NLR (proporción de neutrófilos a linfocitos) | Se eleva con la inflamación causada por el cáncer. | No |
| Factor de crecimiento de fibroblastos básico (bFGF) | Este nivel aumenta cuando hay un tumor, ayuda con la reproducción rápida de las células tumorales. | Electroquímica |
| Factor de crecimiento similar a la insulina (IGF-R) | Alta actividad en las células cancerosas, ayuda a la reproducción. | Sensor de espectroscopia de impedancia electroquímica |