Isoleucina - Isoleucine
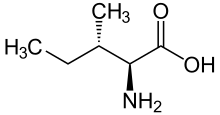
fórmula esquelética de L- isoleucina
|
|||
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC
Isoleucina
|
|||
| Otros nombres
Ácido (2 S , 3 S ) -2-amino-3-metilpentanoico
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| DrugBank | |||
| Tarjeta de información ECHA |
100.000.726 |
||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 6 H 13 N O 2 | |||
| Masa molar | 131,175 g · mol −1 | ||
| −84,9 · 10 −6 cm 3 / mol | |||
| Página de datos complementarios | |||
|
Índice de refracción ( n ), constante dieléctrica (ε r ), etc. |
|||
|
Datos termodinámicos |
Comportamiento de fase sólido-líquido-gas |
||
| UV , IR , RMN , MS | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
La isoleucina (símbolo Ile o I ) es un α-aminoácido que se utiliza en la biosíntesis de proteínas . Contiene un grupo α-amino (que se encuentra en el −NH protonado+
3formar en condiciones biológicas), un grupo α-carboxílico (que está en la -COO desprotonada - forma en condiciones biológicas), y un hidrocarburo de cadena lateral con una rama (un centro de carbono átomo enlazado a otros tres átomos de carbono). Se clasifica como un aminoácido alifático no polar, sin carga (a pH fisiológico), de cadena ramificada . Es esencial en los humanos, lo que significa que el cuerpo no puede sintetizarlo y debe ingerirse en nuestra dieta. La isoleucina se sintetiza a partir de piruvato empleando enzimas de biosíntesis de leucina en otros organismos como las bacterias. Está codificado por los codones AUU, AUC y AUA.
Metabolismo
Biosíntesis
Como nutriente esencial, no se sintetiza en el organismo, por lo que debe ser ingerido, generalmente como componente de proteínas. En plantas y microorganismos, se sintetiza a través de varios pasos, a partir de piruvato y alfa-cetobutirato . Las enzimas involucradas en esta biosíntesis incluyen:
- Acetolactato sintasa (también conocida como acetohidroxiácido sintasa)
- Isomerorreductasa de acetohidroxiácido
- Dihidroxiácido deshidratasa
- Valina aminotransferasa
Catabolismo
La isoleucina es un aminoácido glucogénico y cetogénico . Después de la transaminación con alfa-cetoglutarato, la estructura carbonada se oxida y se divide en propionil-CoA y acetil-CoA . La propionil-CoA se convierte en succinil-CoA , un intermedio del ciclo del TCA que se puede convertir en oxaloacetato para la gluconeogénesis (por lo tanto, glucogénico). En los mamíferos, la acetil-CoA no se puede convertir en carbohidratos, pero se puede alimentar al ciclo del TCA mediante la condensación con oxaloacetato para formar citrato o se puede utilizar en la síntesis de cuerpos cetónicos (por lo tanto, cetogénicos) o ácidos grasos .
Resistencia a la insulina
La isoleucina, al igual que otros aminoácidos de cadena ramificada , está asociada con la resistencia a la insulina: se observan niveles más altos de isoleucina en la sangre de ratones, ratas y humanos diabéticos. Los ratones alimentados con una dieta de privación de isoleucina durante un día han mejorado la sensibilidad a la insulina, y la alimentación con una dieta de privación de isoleucina durante una semana reduce significativamente los niveles de glucosa en sangre. En ratones obesos y resistentes a la insulina inducidos por la dieta, una dieta con niveles reducidos de isoleucina (con o sin los otros aminoácidos de cadena ramificada) da como resultado una adiposidad reducida y una sensibilidad a la insulina mejorada. Se requieren niveles dietéticos reducidos de isoleucina para los efectos metabólicos beneficiosos de una dieta baja en proteínas . En los seres humanos, una dieta restringida en proteínas reduce los niveles sanguíneos de isoleucina y disminuye los niveles de glucosa en sangre en ayunas. En los seres humanos, los niveles dietéticos más altos de isoleucina se asocian con un mayor índice de masa corporal .
Requisitos
La Junta de Alimentos y Nutrición (FNB) del Instituto de Medicina de EE. UU. Estableció las cantidades dietéticas recomendadas (RDA) de aminoácidos esenciales en 2002. Para isoleucina, para adultos de 19 años en adelante, 19 mg / kg de peso corporal / día.
Fuentes nutricionales
Aunque este aminoácido no se produce en animales, se almacena en grandes cantidades. Los alimentos que tienen altas cantidades de isoleucina incluyen huevos, proteína de soja, algas, pavo, pollo, cordero, queso y pescado.
Isómeros
| Formas de isoleucina | |||||||
|---|---|---|---|---|---|---|---|
| Nombre común : | isoleucina | d -isoleucina | l- isoleucina | dl- isoleucina | d- aloisoleucina | l- aloisoleucina | dl- aloisoleucina |
| Sinónimos : | ( R ) -isoleucina | L (+) - isoleucina | ( R *, R *) - isoleucina | aloisoleucina | |||
| PubChem : | CID 791 de PubChem | CID 94206 de PubChem | CID 6306 de PubChem | CID 76551 de PubChem | |||
| Número EINECS : | |||||||
| Número CAS : | 443-79-8 | 319-78-8 | 73-32-5 | 1509-35-9 | 1509-34-8 | 3107-04-8 | |
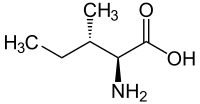  |
|
l -isoleucina (2 S , 3 S ) y d -isoleucina (2 R , 3 R ) |
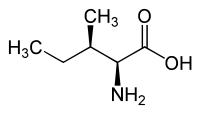  |
| l- aloisoleucina (2 S , 3 R ) y d- aloisoleucina (2 R , 3 S ) |
Síntesis
La isoleucina se puede sintetizar en un procedimiento de varios pasos a partir de 2-bromobutano y dietilmalonato . La isoleucina sintética fue reportada originalmente en 1905 por el químico francés Louis Bouveault .
El químico alemán Felix Ehrlich descubrió la isoleucina en la hemoglobina en 1903.


