Bioelectricidad - Bioelectricity
En biología , la bioelectricidad del desarrollo se refiere a la regulación de patrones y comportamiento a nivel de células , tejidos y órganos como resultado de la señalización endógena mediada eléctricamente. Las células y tejidos de todo tipo utilizan flujos de iones para comunicarse eléctricamente. El portador de carga en bioelectricidad es el ión (átomo cargado), y se genera una corriente y un campo eléctricos cada vez que se produce un flujo de iones neto. Las corrientes y campos eléctricos endógenos , los flujos de iones y las diferencias en el potencial de reposo entre los tejidos componen un sistema de comunicación y señalización antiguo y muy conservado. Funciona junto (en serie y en paralelo a) factores bioquímicos, redes transcripcionales y otras fuerzas físicas para regular el comportamiento celular y los patrones a gran escala durante la embriogénesis , la regeneración , el cáncer y muchos otros procesos.
Contextualización del campo
La bioelectricidad del desarrollo es una subdisciplina de la biología, relacionada pero distinta de la neurofisiología y la bioelectromagnetica . La bioelectricidad del desarrollo se refiere a los flujos de iones endógenos, los gradientes de voltaje transmembrana y transepitelial y las corrientes y campos eléctricos producidos y sostenidos en células y tejidos vivos. Esta actividad eléctrica se utiliza a menudo durante la embriogénesis, la regeneración y el cáncer; es una capa del complejo campo de señales que inciden en todas las células in vivo y regulan sus interacciones durante la formación y el mantenimiento de patrones (Figura 1). Esto es distinto de la bioelectricidad neuronal (denominada clásicamente electrofisiología), que se refiere al aumento rápido y transitorio en células excitables bien reconocidas como neuronas y miocitos ; y de los bioelectromagnéticos, que se refieren a los efectos de la radiación electromagnética aplicada, y los electromagnéticos endógenos como la emisión de biofotones y la magnetita.
Visión general del campo: terminología y definiciones básicas
La discontinuidad interior / exterior en la superficie celular habilitada por una membrana de bicapa lipídica (condensador) está en el núcleo de la bioelectricidad. La membrana plasmática fue una estructura indispensable para el origen y evolución de la vida misma. Proporcionó una compartimentación que permitió establecer un gradiente diferencial de voltaje / potencial (batería o fuente de voltaje) a través de la membrana , lo que probablemente permitió una bioenergética temprana y rudimentaria que alimentó los mecanismos celulares. Durante la evolución, la difusión inicialmente puramente pasiva de iones (portadores de carga), se vuelve gradualmente controlada por la adquisición de canales de iones , bombas , intercambiadores y transportadores. Estos translocadores energéticamente libres (resistencias o conductores, transporte pasivo) o costosos (fuentes de corriente, transporte activo) establecen y ajustan con precisión gradientes de voltaje (potenciales en reposo) que son ubicuos y esenciales para la fisiología de la vida, que van desde la bioenergética, el movimiento, la detección, el transporte de nutrientes. , eliminación de toxinas y señalización en condiciones homeostáticas y de enfermedad / lesión. Cuando los estímulos o la barrera se rompen (cortocircuito) de la membrana, los iones alimentados por el gradiente de voltaje (fuerza electromotriz) se difunden o se filtran, respectivamente, a través del citoplasma y los fluidos intersticiales (conductores), generando corrientes eléctricas medibles (flujos netos de iones) y los campos. Algunos iones (como el calcio ) y moléculas (como el peróxido de hidrógeno ) modulan los translocadores dirigidos para producir una corriente o para mejorar, mitigar o incluso revertir una corriente inicial, siendo conmutadores.
Las señales bioeléctricas endógenas se producen en las células por la acción acumulativa de los canales iónicos, las bombas y los transportadores. En las células no excitables, el potencial de reposo a través de la membrana plasmática (Vmem) de las células individuales se propaga a través de distancias a través de sinapsis eléctricas conocidas como uniones gap (conductores), que permiten que las células compartan su potencial de reposo con las vecinas. Las células alineadas y apiladas (como en los epitelios) generan potenciales transepiteliales (batería en serie) y campos eléctricos (Figuras 2 y 3), que también se propagan a través de los tejidos. Las uniones estrechas (resistencias) mitigan eficientemente la difusión y fuga de iones paracelulares, evitando el cortocircuito de voltaje. Juntos, estos voltajes y campos eléctricos forman patrones ricos y dinámicos (Figura 5) dentro de los cuerpos vivos que delimitan las características anatómicas , actuando así como planos para la expresión génica y la morfogénesis en algunos casos. Más que correlaciones, estas distribuciones bioeléctricas son dinámicas, evolucionan con el tiempo y con el microambiente e incluso las condiciones lejanas para servir como influencias instructivas sobre el comportamiento celular y los patrones a gran escala durante la embriogénesis, la regeneración y la supresión del cáncer. Los mecanismos de control bioeléctrico son un objetivo emergente importante para los avances en medicina regenerativa, defectos de nacimiento , cáncer y bioingeniería sintética .
Breve historia del campo: los pioneros en bioelectricidad
Las raíces modernas de la bioelectricidad del desarrollo se remontan a todo el siglo XVIII. Varios trabajos seminales que estimulan las contracciones musculares con frascos de Leyden culminaron con la publicación de estudios clásicos de Luigi Galvani en 1791 (De viribus electricitatis in motu musculari) y 1794. En estos, Galvani pensó que había descubierto la capacidad intrínseca de producir electricidad en los tejidos vivos o “ electricidad animal ”. Alessandro Volta demostró que los espasmos musculares de las patas de la rana se debían a un generador de electricidad estática y al contacto de metales diferentes . Galvani mostró, en un estudio de 1794, espasmos sin electricidad metálica al tocar el músculo de la pierna con un nervio ciático cortado desviado , mostrando definitivamente “electricidad animal”. Sin saberlo, Galvani con este y otros experimentos relacionados descubrió la corriente de la lesión (fuga de iones impulsada por el potencial de membrana / epitelio intacto) y el potencial de lesión (diferencia de potencial entre la membrana / epitelio lesionado e intacto). El potencial de lesión fue, de hecho, la fuente eléctrica detrás de la contracción de la pierna, como se dio cuenta en el siglo siguiente. El trabajo posterior finalmente extendió este campo más allá de los nervios y los músculos a todas las células, desde las bacterias hasta las células de mamíferos no excitables.
Sobre la base de estudios anteriores, se produjeron más destellos de bioelectricidad del desarrollo con el descubrimiento de corrientes y campos eléctricos relacionados con heridas en la década de 1840, cuando uno de los padres fundadores de la electrofisiología moderna , Emil du Bois-Reymond , informó actividades eléctricas de nivel macroscópico en ranas, peces y cuerpos humanos. Grabó corrientes eléctricas diminutas en tejidos y organismos vivos con un galvanómetro de última generación fabricado con bobinas de alambre de cobre aisladas. Desveló la electricidad que cambia rápidamente asociada con la contracción muscular y la excitación nerviosa: los potenciales de acción . Al mismo tiempo, du Bois-Reymond también informó en detalle de menos fluctuaciones de electricidad en las heridas (lesiones actuales y potenciales) que se hizo a sí mismo.

El trabajo en bioelectricidad comenzó en serio a principios del siglo XX. Desde entonces, varias oleadas de investigación produjeron importantes datos funcionales que muestran el papel que juega la bioelectricidad en el control del crecimiento y la forma. En las décadas de 1920 y 1930, EJ Lund y HS Burr fueron algunos de los autores más prolíficos en este campo. Lund midió corrientes en una gran cantidad de sistemas de modelos vivientes, correlacionándolos con cambios en los patrones. En contraste, Burr usó un voltímetro para medir gradientes de voltaje, examinando tejidos y tumores embrionarios en desarrollo, en una variedad de animales y plantas. Se demostró que los campos eléctricos aplicados alteraron la regeneración de planaria por Marsh y Beams en las décadas de 1940 y 1950, induciendo la formación de cabezas o colas en los sitios de corte, invirtiendo la polaridad principal del cuerpo. La introducción y el desarrollo de la sonda vibratoria, el primer dispositivo para la caracterización cuantitativa no invasiva de las corrientes de iones minúsculos extracelulares, por Lionel Jaffe y Richard Nuccittelli, revitalizó el campo en la década de 1970. Fueron seguidos por investigadores como Joseph Vanable, Richard Borgens , Ken Robinson y Colin McCaig, entre muchos otros, quienes mostraron roles de la señalización bioeléctrica endógena en el desarrollo y regeneración de las extremidades, la embriogénesis, la polaridad de los órganos y la cicatrización de heridas . CD Cone estudió el papel del potencial de reposo en la regulación de la diferenciación y proliferación celular y el trabajo posterior ha identificado regiones específicas del espectro de potencial de reposo que corresponden a distintos estados celulares como quiescente, madre, cáncer y diferenciado terminalmente (Figura 5).
Aunque este cuerpo de trabajo generó una cantidad significativa de datos fisiológicos de alta calidad, este enfoque biofísico a gran escala ha estado históricamente a la sombra del centro de atención de los gradientes bioquímicos y las redes genéticas en la educación, la financiación y la popularidad de la biología entre los biólogos. Un factor clave que contribuyó a que este campo se quedara atrás de la genética molecular y la bioquímica es que la bioelectricidad es inherentemente un fenómeno vivo: no se puede estudiar en muestras fijas. Trabajar con bioelectricidad es más complejo que los enfoques tradicionales de la biología del desarrollo, tanto metodológica como conceptualmente, ya que generalmente requiere un enfoque altamente interdisciplinario.
Metodología para el estudio de la señalización bioeléctrica: técnicas basadas en electrodos
Las técnicas estándar de oro para extraer cuantitativamente dimensiones eléctricas de especímenes vivos, que van desde los niveles de células a organismos, son el microelectrodo de vidrio (o micropipeta ), la sonda de voltaje vibrante (o autorreferencial) y el microelectrodo vibratorio selectivo de iones . El primero es intrínsecamente invasivo y los dos últimos no son invasivos, pero todos son sensores ultrasensibles y de respuesta rápida que se utilizan ampliamente en una gran cantidad de condiciones fisiológicas en modelos biológicos generalizados.
El microelectrodo de vidrio se desarrolló en la década de 1940 para estudiar el potencial de acción de las células excitables, derivado del trabajo seminal de Hodgkin y Huxley en el calamar axón gigante . Es simplemente un puente de sal líquida que conecta la muestra biológica con el electrodo, protegiendo los tejidos de las toxinas lixiviables y las reacciones redox del electrodo desnudo. Debido a su baja impedancia, bajo potencial de unión y polarización débil, los electrodos de plata son transductores estándar de la corriente iónica en eléctrica que ocurre a través de una reacción redox reversible en la superficie del electrodo.
La sonda vibratoria se introdujo en estudios biológicos en la década de 1970. La sonda sensible al voltaje está galvanizada con platino para formar una bola capacitiva de punta negra con una gran superficie. Cuando vibra en un gradiente de voltaje de CC natural o artificial, la bola capacitiva oscila en una salida de CA sinusoidal. La amplitud de la onda es proporcional a la diferencia de potencial de medición en la frecuencia de la vibración, filtrada de manera eficiente por un amplificador de bloqueo que aumenta la sensibilidad de la sonda.
El microelectrodo vibratorio selectivo de iones se utilizó por primera vez en 1990 para medir los flujos de calcio en varias células y tejidos. El microelectrodo selectivo de iones es una adaptación del microelectrodo de vidrio, donde un intercambiador de iones líquido específico de iones (ionóforo) se llena en la punta en un microelectrodo previamente silanizado (para evitar fugas). Además, el microelectrodo vibra a bajas frecuencias para operar en el modo de autorreferencia precisa. Solo el ión específico penetra en el ionóforo , por lo tanto, la lectura de voltaje es proporcional a la concentración de iones en las condiciones de medición. Luego, el flujo se calcula usando la primera ley de Fick .
Emergentes técnicas basadas en la óptica, por ejemplo, el pH Optrode (o optodo ), que se puede integrar en un sistema de referencia a sí misma pueden llegar a ser una técnica alternativa o adicional en los laboratorios de bioelectricidad. El optrodo no requiere referencia y es insensible al electromagnetismo, lo que simplifica la configuración del sistema y lo convierte en una opción adecuada para grabaciones en las que se aplica simultáneamente estimulación eléctrica.
Gran parte del trabajo para estudiar funcionalmente la señalización bioeléctrica ha hecho uso de corrientes y campos eléctricos aplicados (exógenos) a través de aparatos de suministro de voltaje de CC y CA integrados con puentes de sal de agarosa. Estos dispositivos pueden generar innumerables combinaciones de magnitud y dirección de voltaje, pulsos y frecuencias. Actualmente, la aplicación de campos eléctricos mediada por laboratorio en un chip está ganando terreno en el campo con la posibilidad de permitir ensayos de cribado de alto rendimiento de las grandes salidas combinatorias.
Metodología para el estudio de la señalización bioeléctrica: reactivos y enfoques de edad molecular
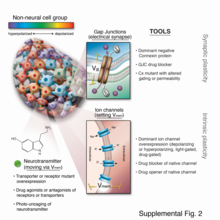
El notable progreso de la biología molecular durante las últimas seis décadas ha producido poderosas herramientas que facilitan la disección de señales bioquímicas y genéticas; sin embargo, tienden a no ser adecuados para estudios bioeléctricos in vivo. El trabajo anterior se basó en gran medida en la corriente aplicada directamente por electrodos, revitalizada por importantes avances recientes en la ciencia de los materiales y las mediciones de corriente extracelular, facilitados por sofisticados sistemas de electrodos de autorreferencia. Si bien las aplicaciones de electrodos para manipular procesos corporales controlados de forma neutral han atraído recientemente mucha atención, el sistema nervioso es solo la punta del iceberg cuando se trata de oportunidades para controlar procesos somáticos, ya que la mayoría de los tipos de células son eléctricamente activas y responden a señales iónicas de ellos mismos y sus vecinos (Figura 6).
En los últimos 15 años se han desarrollado una serie de nuevas técnicas moleculares que han permitido investigar las vías bioeléctricas con un alto grado de resolución mecanicista y vincularlas a cascadas moleculares canónicas. Estos incluyen (1) exámenes farmacológicos para identificar canales endógenos y bombas responsables de eventos de patrones específicos; (2) tintes informadores fluorescentes sensibles al voltaje e indicadores de voltaje fluorescentes codificados genéticamente para la caracterización del estado bioeléctrico in vivo; (3) paneles de canales iónicos dominantes bien caracterizados que pueden expresarse incorrectamente en células de interés para alterar el estado bioeléctrico de las formas deseadas; y (4) plataformas computacionales que están en línea para ayudar en la construcción de modelos predictivos de dinámica bioeléctrica en tejidos.
En comparación con las técnicas basadas en electrodos, las sondas moleculares proporcionan una resolución espacial más amplia y un análisis dinámico facilitado a lo largo del tiempo. Aunque la calibración o la titulación pueden ser posibles, las sondas moleculares suelen ser semicuantitativas, mientras que los electrodos proporcionan valores bioeléctricos absolutos. Otra ventaja de la fluorescencia y otras sondas es su naturaleza menos invasiva y su multiplexación espacial, lo que permite la monitorización simultánea de grandes áreas de tejidos embrionarios o de otro tipo in vivo durante los procesos de formación de patrones normales o patológicos.
Papel en el desarrollo temprano
El trabajo en sistemas modelo como Xenopus laevis y el pez cebra ha revelado el papel de la señalización bioeléctrica en el desarrollo del corazón, la cara, los ojos, el cerebro y otros órganos. Las pantallas han identificado roles para los canales iónicos en el control del tamaño de estructuras como la aleta del pez cebra, mientras que los estudios enfocados en la ganancia de función han demostrado, por ejemplo, que las partes del cuerpo se pueden volver a especificar a nivel de órganos, por ejemplo, creando ojos completos en el endodermo intestinal. . Al igual que en el cerebro, la bioeléctrica del desarrollo puede integrar información a una distancia significativa en el embrión, por ejemplo, como el control del tamaño del cerebro mediante los estados bioeléctricos del tejido ventral. y el control de la tumorigénesis en el sitio de expresión del oncogén mediante el estado bioeléctrico de células remotas.
Los trastornos humanos, así como numerosos mutantes de ratón, muestran que la señalización bioeléctrica es importante para el desarrollo humano (Tablas 1 y 2). Esos efectos están relacionados de forma generalizada con las canalopatías, que son trastornos humanos que resultan de mutaciones que alteran los canales iónicos.
Varias canalopatías dan lugar a anomalías morfológicas o defectos de nacimiento congénitos además de síntomas que afectan a los músculos o las neuronas. Por ejemplo, las mutaciones que interrumpen un canal de potasio Kir2.1 que se rectifica hacia adentro causan el síndrome de Andersen-Tawil (ATS) de herencia dominante . Los pacientes con ETA experimentan parálisis periódica , arritmias cardíacas y múltiples anomalías morfológicas que pueden incluir paladar hendido o arqueado alto, labio superior hendido o delgado, surco nasolabial aplanado , micrognatia , oligodoncia dental , hipoplasia del esmalte, retraso en la erupción de la dentición, maloclusión, frente ancha, implantación ancha ojos, orejas de implantación baja, sindactilia , clinodactilia , braquidactilia y riñones displásicos . Las mutaciones que interrumpen otro canal de K + rectificador interno Girk2 codificado por KCNJ6 causan el síndrome de Keppen-Lubinsky que incluye microcefalia , puente nasal estrecho, paladar arqueado alto y lipodistrofia generalizada severa (incapacidad para generar tejido adiposo). KCNJ6 se encuentra en la región crítica del síndrome de Down , de modo que las duplicaciones que incluyen esta región conducen a anomalías craneofaciales y de las extremidades, y las duplicaciones que no incluyen esta región no provocan síntomas morfológicos del síndrome de Down. Las mutaciones en KCNH1 , un canal de potasio dependiente de voltaje, conducen al síndrome de Temple-Baraitser (también conocido como Zimmermann-Laband ). Las características comunes del síndrome de Temple-Baraitser incluyen la ausencia o hipoplasia de las uñas y falanges de los dedos de las manos y los pies e inestabilidad articular. Los defectos craneofaciales asociados con mutaciones en KCNH1 incluyen paladar hendido o arqueado alto, hipertelorismo , orejas dismórficas, nariz dismórfica, hipertrofia gingival y número anormal de dientes.
Las mutaciones en CaV1.2 , un canal de Ca2 + dependiente de voltaje, conducen al síndrome de Timothy que causa arritmia cardíaca severa (QT largo) junto con sindactilia y defectos craneofaciales similares al síndrome de Andersen-Tawil que incluyen paladar hendido o arqueado alto, micrognatia, implantación baja oídos, sindactilia y braquidactilia. Si bien estas canalopatías son raras, muestran que los canales iónicos funcionales son importantes para el desarrollo. Además, la exposición en el útero a medicamentos antiepilépticos que se dirigen a algunos canales iónicos también causa una mayor incidencia de defectos congénitos, como hendiduras orales. Los efectos de la alteración tanto genética como exógena de los canales iónicos dan una idea de la importancia de la señalización bioeléctrica en el desarrollo.
Papel en la cicatrización de heridas y guía celular
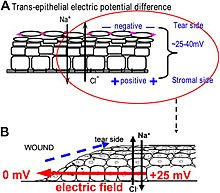
Una de las funciones mejor comprendidas de los gradientes bioeléctricos se encuentra en los campos eléctricos endógenos a nivel de tejido utilizados durante la cicatrización de heridas. Es un desafío estudiar los campos eléctricos asociados a heridas, porque estos campos son débiles, menos fluctuantes y no tienen respuestas biológicas inmediatas en comparación con los pulsos nerviosos y la contracción muscular. El desarrollo de los microelectrodos vibratorios y de vidrio demostró que las heridas producían y, lo que es más importante, sostenían corrientes y campos eléctricos medibles. Estas técnicas permiten una caracterización adicional de los campos / corrientes eléctricos de la herida en la córnea y las heridas de la piel, que muestran características espaciales y temporales activas, lo que sugiere una regulación activa de estos fenómenos eléctricos. Por ejemplo, las corrientes eléctricas de la herida son siempre las más fuertes en el borde de la herida, que aumentan gradualmente hasta alcanzar un pico aproximadamente 1 hora después de la lesión. En las heridas de los animales diabéticos , los campos eléctricos de la herida se ven significativamente comprometidos. Se espera que la comprensión de los mecanismos de generación y regulación de las corrientes / campos eléctricos de la herida revele nuevos enfoques para manipular el aspecto eléctrico para una mejor cicatrización de la herida.
¿Cómo se producen los campos eléctricos en una herida? Los epitelios bombean activamente y segregan iones de forma diferencial. En el epitelio de la córnea, por ejemplo, el Na + y el K + se transportan hacia el interior del líquido lagrimal al líquido extracelular, y el Cl− se transporta fuera del líquido extracelular al líquido lagrimal. Las células epiteliales están conectadas por uniones estrechas, que forman la principal barrera resistiva eléctrica y, por lo tanto, establecen un gradiente eléctrico a través del epitelio: el potencial transepitelial (TEP). Romper la barrera epitelial, como ocurre en cualquier herida, crea un agujero que rompe la alta resistencia eléctrica establecida por las uniones estrechas en la lámina epitelial, cortocircuitando el epitelio localmente. Por tanto, la TEP desciende a cero en la herida. Sin embargo, el transporte de iones normal continúa en las células epiteliales no heridas más allá del borde de la herida (por lo general <1 mm de distancia), lo que impulsa el flujo de carga positiva hacia afuera de la herida y establece un campo eléctrico (EF) de orientación lateral constante con el cátodo en la herida. La piel también genera un TEP, y cuando se hace una herida en la piel, surgen corrientes y campos eléctricos de la herida similares, hasta que la función de barrera epitelial se recupera para terminar el cortocircuito en la herida. Cuando los campos eléctricos de la herida se manipulan con agentes farmacológicos que estimulan o inhiben el transporte de iones, los campos eléctricos de la herida también aumentan o disminuyen, respectivamente. La cicatrización de heridas se puede acelerar o ralentizar en consecuencia en las heridas de la córnea.
¿Cómo afectan los campos eléctricos a la cicatrización de heridas? Para curar las heridas, las células que rodean la herida deben migrar y crecer direccionalmente hacia la herida para cubrir el defecto y restaurar la barrera. Las células importantes para curar heridas responden notablemente bien a los campos eléctricos aplicados de la misma fuerza que se miden en las heridas. Toda la gama de tipos de células y sus respuestas después de una lesión se ven afectados por campos eléctricos fisiológicos. Estos incluyen migración y división de células epiteliales, brotación y extensión de nervios y migración de leucocitos y células endoteliales. El comportamiento celular mejor estudiado es la migración direccional de células epiteliales en campos eléctricos: electrotaxis . Las células epiteliales migran direccionalmente al polo negativo (cátodo), que en una herida es la polaridad de campo de los campos eléctricos vectoriales endógenos en el epitelio, apuntando (de positivo a negativo) al centro de la herida. Las células epiteliales de la córnea, los queratinocitos de la piel y muchos otros tipos de células muestran una migración direccional con intensidades de campo eléctrico tan bajas como unos pocos mV mm − 1. Grandes láminas de células epiteliales monocapa y láminas de células epiteliales estratificadas multicapa también migran direccionalmente. Dicho movimiento colectivo se parece mucho a lo que ocurre durante la cicatrización de heridas in vivo, donde las láminas de células se mueven colectivamente hacia el lecho de la herida para cubrir la herida y restaurar la función de barrera de la piel o la córnea.
La forma en que las células perciben esos diminutos campos eléctricos extracelulares sigue siendo en gran medida difícil de alcanzar. Investigaciones recientes han comenzado a identificar algunos elementos genéticos, de señalización y estructurales subyacentes a cómo las células perciben y responden a pequeños campos eléctricos fisiológicos. Estos incluyen canales iónicos, vías de señalización intracelular, balsas de lípidos de membrana y electroforesis de componentes de la membrana celular.
Papel en la regeneración animal
A principios del siglo XX, Albert Mathews correlacionó de manera seminal la regeneración de un pólipo cnidario con la diferencia de potencial entre las superficies de los pólipos y los estolones , y afectó la regeneración mediante la imposición de contracorrientes. Amedeo Herlitzka, siguiendo los pasos de las corrientes eléctricas heridas de su mentor, du Bois-Raymond, teorizó sobre las corrientes eléctricas que juegan un papel temprano en la regeneración, quizás iniciando la proliferación celular. Usando campos eléctricos que prevalecen sobre los endógenos, Marsh y Beams generaron asombrosamente planarias de dos cabezas e incluso invirtieron la polaridad del cuerpo primario por completo, con colas creciendo donde antes existía una cabeza. Después de estos estudios de semillas, las variaciones de la idea de que la bioelectricidad podría detectar lesiones y desencadenar o al menos ser un actor importante en la regeneración se han impulsado a lo largo de las décadas hasta la actualidad. Una explicación potencial radica en los potenciales en reposo (principalmente Vmem y TEP), que pueden ser, al menos en parte, sensores inactivos (alarmas) listos para detectar y efectores (disparadores) listos para reaccionar ante el daño local.
Siguiendo el relativo éxito de la estimulación eléctrica en la regeneración no permisiva de patas de rana utilizando una varilla bimetálica implantada a finales de la década de 1960, el aspecto extracelular bioeléctrico de la regeneración de extremidades de anfibios se diseccionó ampliamente en las siguientes décadas. Los datos fisiológicos descriptivos y funcionales definitivos fueron posibles gracias al desarrollo de la sonda vibratoria ultrasensible y los dispositivos de aplicación mejorados. La amputación conduce invariablemente a una corriente hacia afuera impulsada por la piel y un campo eléctrico lateral consecuente que coloca el cátodo en el sitio de la herida. Aunque inicialmente se produce una fuga de iones pura, eventualmente se produce un componente activo y el bloqueo de los translocadores de iones típicamente altera la regeneración. Usando corrientes y campos eléctricos biomiméticos exógenos, se logró la regeneración parcial, que típicamente incluía crecimiento de tejido y aumento de tejido neuronal. Por el contrario, excluir o revertir la corriente y los campos eléctricos endógenos perjudica la regeneración. Estos estudios en regeneración de extremidades de anfibios y estudios relacionados en lampreas y mamíferos, combinados con los de curación de fracturas óseas y estudios in vitro , llevaron a la regla general de que las células migratorias (como queratinocitos, leucocitos y células endoteliales) y las células en crecimiento (como axones) que contribuyen a la regeneración sufren electrotaxis hacia el cátodo (sitio original de la lesión). De manera congruente, un ánodo está asociado con la resorción o degeneración de tejido, como ocurre en la regeneración deteriorada y la resorción osteoclástica en el hueso. A pesar de estos esfuerzos, la promesa de una regeneración epimórfica significativa en los mamíferos sigue siendo una frontera importante para los esfuerzos futuros, que incluyen el uso de biorreactores portátiles para proporcionar un entorno en el que se puedan impulsar estados bioeléctricos pro-regenerativos y esfuerzos continuos de estimulación eléctrica.
Un trabajo molecular reciente ha identificado el flujo de protones y sodio como importante para la regeneración de la cola en los renacuajos de Xenopus , y ha demostrado que la regeneración de toda la cola (con la médula espinal, el músculo, etc.) podría desencadenarse en una variedad de condiciones normalmente no regenerativas por ya sea por métodos genéticos moleculares, farmacológicos u optogenéticos. En planaria , el trabajo sobre el mecanismo bioeléctrico ha revelado el control del comportamiento de las células madre, el control del tamaño durante la remodelación, la polaridad anteroposterior y la forma de la cabeza. La alteración de la señalización fisiológica mediada por la unión gap produce gusanos de dos cabezas en Dugesia japonica; sorprendentemente, estos animales continúan regenerándose como de dos cabezas en rondas futuras de regeneración meses después de que el reactivo de bloqueo de la unión gap haya abandonado el tejido. Esta alteración estable a largo plazo del diseño anatómico al que se regeneran los animales, sin edición genómica, es un ejemplo de herencia epigenética del patrón corporal, y también es la única "cepa" disponible de especies planarias que exhiben un cambio anatómico heredado que es diferente. del tipo salvaje.

Papel en el cáncer
La defección de las células de la coordinación de actividad normalmente estrecha hacia una estructura anatómica produce cáncer; Por lo tanto, no es de extrañar que la bioelectricidad, un mecanismo clave para coordinar el crecimiento y el patrón celular, sea un objetivo a menudo implicado en el cáncer y la metástasis. De hecho, se sabe desde hace mucho tiempo que las uniones gap tienen un papel clave en la carcinogénesis y la progresión. Los canales pueden comportarse como oncogenes y, por tanto, son adecuados como nuevos objetivos farmacológicos. Un trabajo reciente en modelos de anfibios ha demostrado que la despolarización del potencial de reposo puede desencadenar un comportamiento metastásico en células normales, mientras que la hiperpolarización (inducida por misexpresión de canales iónicos, fármacos o luz) puede suprimir la tumorigénesis inducida por la expresión de oncogenes humanos. La despolarización del potencial de reposo parece ser una firma bioeléctrica mediante la cual los sitios de tumores incipientes pueden detectarse de forma no invasiva. El refinamiento de la firma bioeléctrica del cáncer en contextos biomédicos, como modalidad diagnóstica, es una de las posibles aplicaciones de este campo. Curiosamente, la ambivalencia de la polaridad - despolarización como marcador e hiperpolarización como tratamiento - hacen conceptualmente posible derivar enfoques teragnósticos (combinación de terapias con diagnósticos), diseñados para detectar y tratar simultáneamente tumores tempranos, en este caso basados en la normalización de la membrana. polarización.
Papel en la regulación de patrones
Experimentos recientes que utilizan fármacos abridores / bloqueadores de canales iónicos, así como la misexpresión del canal iónico dominante, en una variedad de especies modelo, han demostrado que la bioelectricidad, específicamente, los gradientes de voltaje instruyen no solo el comportamiento de las células madre sino también el patrón a gran escala. Las señales de patrones a menudo están mediadas por gradientes espaciales de potenciales celulares en reposo, o Vmem, que se pueden transducir en cascadas de segundos mensajeros y cambios transcripcionales mediante un puñado de mecanismos conocidos (Figura 7). Estos potenciales se establecen mediante la función de los canales de iones y las bombas, y se moldean mediante conexiones de unión gap que establecen compartimentos de desarrollo (campos de células isopotenciales). Debido a que tanto las uniones de separación como los canales iónicos son sensibles al voltaje, los grupos de células implementan circuitos eléctricos con una gran capacidad de retroalimentación (Figura 8). Los resultados de la dinámica bioeléctrica del desarrollo in vivo representan decisiones de patrones a gran escala, como el número de cabezas en planaria, la forma de la cara en el desarrollo de la rana y el tamaño de la cola en el pez cebra. La modulación experimental de prepatrones bioeléctricos endógenos ha permitido convertir regiones del cuerpo (como el intestino) en un ojo completo (Figura 9), induciendo la regeneración de apéndices como las colas de renacuajo en contextos no regenerativos y la conversión de formas y contenidos de cabezas de gusanos planos en patrones. apropiado para otras especies de gusanos planos, a pesar de tener un genoma normal. Trabajos recientes han demostrado el uso de entornos de modelado fisiológico para identificar intervenciones predictivas para apuntar a estados bioeléctricos para la reparación de defectos cerebrales embrionarios bajo una variedad de teratologías inducidas genéticamente y farmacológicamente.
Futuro del campo
La vida es, en última instancia, una empresa electroquímica; la investigación en este campo avanza a lo largo de varias fronteras. En primer lugar, está el programa reductor de comprensión de cómo se producen las señales bioeléctricas, cómo los cambios de voltaje en la membrana celular pueden regular el comportamiento celular y cuáles son los objetivos genéticos y epigenéticos posteriores de las señales bioeléctricas. Ya se conocen algunos mecanismos que transducen el cambio bioeléctrico en alteraciones de la expresión génica, incluido el control bioeléctrico del movimiento de pequeñas moléculas de segundo mensajero a través de las células, que incluyen serotonina y butirato, fosfatasas sensibles al voltaje, entre otros. También se conocen numerosos objetivos de genes de señalización de voltaje, como Notch , BMP , FGF y HIF-1α . Por lo tanto, los mecanismos proximales de la señalización bioeléctrica dentro de las células individuales se están entendiendo bien, y los avances en optogenética y magnetogenética continúan facilitando este programa de investigación. Sin embargo, más desafiante es el programa integrador de comprender cómo patrones específicos de dinámica bioeléctrica ayudan a controlar los algoritmos que logran la regulación de patrones a gran escala (regeneración y desarrollo de anatomía compleja). La incorporación de bioeléctricos con señalización química en el campo emergente de la percepción sensorial celular y la toma de decisiones de sondeo es una frontera importante para el trabajo futuro.
La modulación bioeléctrica ha demostrado control sobre la morfogénesis y remodelación complejas, no simplemente estableciendo la identidad celular individual. Además, varios de los resultados clave en este campo han demostrado que los circuitos bioeléctricos no son locales: las regiones del cuerpo toman decisiones basadas en eventos bioeléctricos a una distancia considerable. Tales eventos no autónomos de células sugieren modelos de redes distribuidas de control bioeléctrico; Es posible que sea necesario desarrollar nuevos paradigmas computacionales y conceptuales para comprender el procesamiento de información espacial en tejidos bioeléctricamente activos. Se ha sugerido que los resultados de los campos de la cognición primitiva y la computación no convencional son relevantes para el programa de descifrar el código bioeléctrico. Finalmente, los esfuerzos en biomedicina y bioingeniería están desarrollando aplicaciones tales como biorreactores portátiles para entregar reactivos modificadores de voltaje a los sitios de las heridas, y fármacos modificadores de canales iónicos (una especie de electroceutico) para la reparación de defectos congénitos y reparación regenerativa. Los biólogos sintéticos también están comenzando a incorporar circuitos bioeléctricos en construcciones híbridas.
Tabla 1: Bombas y canales de iones implicados en la creación de patrones
| Proteína | Función morfogenética o fenotipo LOF (pérdida de función) | Especies | Referencia |
|---|---|---|---|
| TRH1 K + transportador | Patrón de pelo de raíz | Arabidopsis | |
| Canal de potasio Kir2.1 | Patrones de alas | Drosophila | |
| Kir7.1 K + canal | Patrones craneofaciales, desarrollo pulmonar | Mus musculus | |
| NHE2 Na + / H + intercambiador | Patrones epiteliales | Drosophila | |
| Bomba de protones V-ATPase | Modelado del cabello en las alas, pigmentación y modelado del cerebro, modelado craneofacial | Drosophila, Oryzias latipes, Homo sapiens | |
| HCN1, Kv3.1 K + canales | Patrón del prosencéfalo | Mus musculus | |
| KCNC1 K + canal | Déficits de crecimiento | Mus musculus | |
| Canal TWIK-1 K + (KCNK1) | Tamaño cardíaco (auricular) | Mus musculus | |
| KCNJ6 K + canal | Síndrome de Keppen-Lubinsky: craneofacial y cerebral | Homo sapiens | |
| Bomba de protones de canal KCNH1 (hEAG1) K + y ATP6V1B2 V-ATPasa | Síndrome de Zimmermman-Laband y Temple-Baraitser: defectos craneofaciales y cerebrales, displasia / aplasia de las uñas del pulgar y del dedo gordo del pie. | Homo sapiens | |
| Canal de cloruro GLRa4 | Anomalías craneofaciales | Homo sapiens | |
| KCNJ8 K + | Síndrome de Cantu: defectos en la cara, el corazón, el esqueleto y el cerebro | Homo sapiens | |
| NALCN ( canal de fuga de Na + ) | Síndrome de Freeman-Sheldon: extremidades, cara, cerebro | Homo sapiens | |
| Canal de cloruro CFTR | Ausencia bilateral de conductos deferentes | Homo sapiens | |
| KCNC1 | Dismorfias de cabeza / cara | Homo sapiens | |
| KCNK9, Task3 K + canales | Síndrome de dismorfismo de Birk-Barel: defectos craneofaciales, defectos cerebrales (patrón cortical) | Homo sapiens | |
| Kir6.2 K + canal | Defectos craneofaciales | Homo sapiens | |
| Canal KCNQ1 K + (mediante regulación epigenética) | Hipertrofia de lengua, hígado, bazo, páncreas, riñones, glándulas suprarrenales, genitales - síndrome de Beckwith-Wiedemann; defectos craneofaciales y de las extremidades, desarrollo temprano | Homo sapiens, Mus musculus, Drosophila | |
| Canal KCNQ1 K + | Síndrome de Jervell y Lange-Nielsen: oído interno y extremidad | Homo sapiens, Mus musculus | |
| Canal Kir2.1 K + (KNCJ2) | Síndrome de Andersen-Tawil: craneofacial, extremidad, costillas | Homo sapiens, Mus musculus | |
| Receptor GABA-A (canal de cloruro) | Síndrome de Angelman: patrón craneofacial (p. Ej., Paladar hendido) y mano | Homo sapiens, Mus musculus | |
| Canal de cloruro TMEM16A | Morfogénesis traqueal | Mus musculus | |
| GIRK2 K + canal | Defectos del desarrollo cerebeloso | Mus musculus | |
| Canal KCNH2 K + | Defectos del patrón cardíaco, craneofacial | Mus musculus | |
| Canal KCNQ1 K + | Anormalidades del recto, páncreas y estómago. | Mus musculus | |
| NaV1.2 | Defectos de reparación de músculos y nervios | Xenopus | |
| Kir6.1 K + canal | Defectos en el patrón de ojos | Xenopus | |
| Bomba de iones V-ATPase | Defectos de asimetría izquierda-derecha, reparación de músculos y nervios | Xenopus, Gallus gallus domesticus, Danio rerio | |
| Bomba de iones H, K-ATPasa | Defectos de asimetría izquierda-derecha | Xenopus, Echinoidea | |
| Kir7.1 K + canal | Defectos del desarrollo del melanosoma | Danio rerio | |
| Canales kv | Regulación del tamaño de la aleta, regulación del tamaño del corazón | Danio rerio, Mus musculus | |
| NaV 1,5, Na + / K + -ATPasa | Morfogénesis cardiaca | Danio rerio | |
| KCNC3 | Las mutaciones dominantes causan displasia cerebelosa en humanos y defectos en la nervadura de las alas y en los ojos en Drosophila. | Homo sapiens, Drosophila |
Tabla 2: Uniones de huecos implicadas en la creación de patrones
| Proteína Gap Junction | Papel morfogenético o fenotipo LOF | Especies | Referencias |
|---|---|---|---|
| Innexinas | Morfogénesis de gónadas y línea germinal | C. Elegans | |
| Innexina1,2 | Patrón de cutícula (epitelial), desarrollo del intestino anterior | Drosophila | |
| Innexina 2 | Tamaño de los ojos | Drosophila | |
| Cx43 | Displasia oculodentodigital (ODDD), defectos cardíacos (tracto de salida y conotruncal), aleatorización de asimetría izquierda-derecha, problemas de diferenciación de osteoblastos, defectos craneofaciales, miogénesis | Homo sapiens, Mus musculus, Gallus gallus domesticus | |
| Cx37 | Patrones del sistema linfático | Mus musculus | |
| Cx45 | Defectos cardíacos (patrón de cojín) | Mus musculus | |
| Cx50, Cx46 | Defectos oculares (problemas de diferenciación y proliferación, especialmente cristalino), | Mus musculus | |
| Cx26 | Defectos del desarrollo coclear | Mus musculus | |
| Cx41.8 | Defectos del patrón de pigmentación | Danio rerio | |
| Cx43 | Regulación del patrón y el tamaño de la aleta Síndrome craneofrontonasal |
Danio rerio, Mus musculus | |
| Inx4, Inx2 | Diferenciación de la línea germinal y espermatogénesis | Drosophila | |
| Pannexin3 | Desarrollo esquelético | Mus musculus |
Tabla 3: Oncogenes de canales de iones
| Proteína | Especies | Referencias | Papel del cáncer |
|---|---|---|---|
| Canal NaV 1.5 | Homo sapiens | Oncogén | |
| Canales de potasio ERG | Homo sapiens | Oncogén | |
| 9 canal de potasio | Mus musculus | Oncogén | |
| Ductina (componente de protón V-ATPasa) | Mus musculus | Oncogén | |
| Transportador de sodio / butirato SLC5A8 | Homo sapiens | Oncogén | |
| Canal de potasio KCNE2 | Mus musculus | Oncogén | |
| Canal de potasio KCNQ1 | Homo sapiens , ratón | Oncogén | |
| Canal de sodio controlado por voltaje SCN5A | Homo sapiens | Oncogén | |
| Receptor de glutamato metabotrópico | Mus musculus , humano | Oncogén | |
| Canal de cloruro CFTR | Homo sapiens | Supresor de tumor | |
| Connexin43 | Homo sapiens | Supresor de tumor | |
| BKCa | Homo sapiens | Oncogén | |
| Receptor muscarínico de acetilcolina | Homo sapiens, Mus musculus | Supresor de tumor | |
| KCNJ3 (Girk) | Homo sapiens | Oncogén |