Carcinogénesis - Carcinogenesis

La carcinogénesis, también llamada oncogénesis o tumorigénesis, es la formación de un cáncer , mediante el cual las células normales se transforman en células cancerosas . El proceso se caracteriza por cambios a nivel celular, genético y epigenético y una división celular anormal . La división celular es un proceso fisiológico que ocurre en casi todos los tejidos y bajo una variedad de circunstancias. Normalmente, el equilibrio entre la proliferación y la muerte celular programada, en forma de apoptosis , se mantiene para asegurar la integridad de tejidos y órganos . Según la teoría prevaleciente aceptada de la carcinogénesis, la teoría de la mutación somática, las mutaciones en el ADN y las epimutaciones que conducen al cáncer interrumpen estos procesos ordenados al interferir con la programación que regula los procesos, alterando el equilibrio normal entre la proliferación y la muerte celular. Esto da como resultado una división celular descontrolada y la evolución de esas células por selección natural en el cuerpo. Solo ciertas mutaciones conducen al cáncer, mientras que la mayoría de las mutaciones no.
Las variantes de genes heredados pueden predisponer a las personas al cáncer. Además, los factores ambientales como los carcinógenos y la radiación provocan mutaciones que pueden contribuir al desarrollo del cáncer. Finalmente, los errores aleatorios en la replicación normal del ADN pueden resultar en mutaciones que causan cáncer. Por lo general, se requiere una serie de varias mutaciones en ciertas clases de genes antes de que una célula normal se transforme en una célula cancerosa . En promedio, por ejemplo, se encuentran 15 "mutaciones conductoras" y 60 mutaciones "pasajeras" en los cánceres de colon. Las mutaciones en los genes que regulan la división celular, la apoptosis (muerte celular) y la reparación del ADN pueden provocar una proliferación celular descontrolada y cáncer.
El cáncer es fundamentalmente una enfermedad de regulación del crecimiento de los tejidos. Para que una célula normal se transforme en una célula cancerosa, se deben alterar los genes que regulan el crecimiento y la diferenciación celular. Los cambios genéticos y epigenéticos pueden ocurrir en muchos niveles, desde la ganancia o pérdida de cromosomas completos, hasta una mutación que afecte a un solo nucleótido de ADN , o hasta silenciar o activar un microARN que controla la expresión de 100 a 500 genes. Hay dos amplias categorías de genes que se ven afectados por estos cambios. Los oncogenes pueden ser genes normales que se expresan en niveles inapropiadamente altos o genes alterados que tienen propiedades novedosas. En cualquier caso, la expresión de estos genes promueve el fenotipo maligno de las células cancerosas. Los genes supresores de tumores son genes que inhiben la división celular, la supervivencia u otras propiedades de las células cancerosas. Los genes supresores de tumores a menudo quedan inhabilitados por cambios genéticos que promueven el cáncer. Finalmente , los oncovirinae , virus que contienen un oncogén , se clasifican como oncogénicos porque desencadenan el crecimiento de tejidos tumorales en el huésped . Este proceso también se conoce como transformación viral .
Causas
Genético y epigenético
Existe un esquema de clasificación diverso para los diversos cambios genómicos que pueden contribuir a la generación de células cancerosas . Muchos de estos cambios son mutaciones o cambios en la secuencia de nucleótidos del ADN genómico. También hay muchos cambios epigenéticos que alteran si los genes se expresan o no. La aneuploidía , la presencia de un número anormal de cromosomas, es un cambio genómico que no es una mutación y puede implicar la ganancia o pérdida de uno o más cromosomas a través de errores en la mitosis . Las mutaciones a gran escala implican la deleción o la duplicación de una parte de un cromosoma. La amplificación genómica ocurre cuando una célula obtiene muchas copias (a menudo 20 o más) de una pequeña región cromosómica, que generalmente contiene uno o más oncogenes y material genético adyacente. La translocación ocurre cuando dos regiones cromosómicas separadas se fusionan de manera anormal, a menudo en una ubicación característica. Un ejemplo bien conocido de esto es el cromosoma Filadelfia , o translocación de los cromosomas 9 y 22, que ocurre en la leucemia mielógena crónica y da como resultado la producción de la proteína de fusión BCR - abl , una tirosina quinasa oncogénica . Las mutaciones a pequeña escala incluyen mutaciones puntuales , deleciones e inserciones , que pueden ocurrir en el promotor de un gen y afectar su expresión , o pueden ocurrir en la secuencia codificante del gen y alterar la función o estabilidad de su producto proteico . La alteración de un solo gen también puede resultar de la integración de material genómico de un virus de ADN o retrovirus , y tal evento también puede resultar en la expresión de oncogenes virales en la célula afectada y sus descendientes.
Daño en el ADN
Se considera que el daño al ADN es la principal causa de cáncer. Más de 60.000 casos nuevos de daños en el ADN que ocurren naturalmente surgen, en promedio, por célula humana, por día, debido a procesos celulares endógenos (consulte el artículo Daño al ADN (que ocurre naturalmente) ).
El daño adicional al ADN puede surgir de la exposición a agentes exógenos . Como un ejemplo de un agente carcinógeno exógeno , el humo del tabaco causa un mayor daño al ADN, y este daño al ADN probablemente cause un aumento del cáncer de pulmón debido al tabaquismo. En otros ejemplos, la luz ultravioleta de la radiación solar causa daño al ADN que es importante en el melanoma , la infección por Helicobacter pylori produce altos niveles de especies reactivas de oxígeno que dañan el ADN y contribuyen al cáncer gástrico , y la aflatoxina, metabolito de Aspergillus flavus, es un agente que daña el ADN que es causante del cáncer de hígado.
El daño al ADN también puede ser causado por sustancias producidas en el cuerpo . Los macrófagos y neutrófilos en un epitelio colónico inflamado son la fuente de especies reactivas de oxígeno que causan el daño del ADN que inicia la tumorigénesis del colon , y los ácidos biliares, en niveles altos en el colon de humanos que consumen una dieta alta en grasas, también causan daño al ADN y contribuyen a cáncer de colon.
Estas fuentes exógenas y endógenas de daño al ADN se indican en los recuadros de la parte superior de la figura de esta sección. El papel central del daño del ADN en la progresión al cáncer se indica en el segundo nivel de la figura. Los elementos centrales del daño del ADN, las alteraciones epigenéticas y la reparación deficiente del ADN en la progresión al cáncer se muestran en rojo.
Una deficiencia en la reparación del ADN haría que se acumulara más daño en el ADN y aumentaría el riesgo de cáncer. Por ejemplo, las personas con un deterioro hereditario en cualquiera de los 34 genes de reparación del ADN (ver artículo Trastorno por deficiencia de reparación del ADN ) tienen un mayor riesgo de cáncer, y algunos defectos causan hasta un 100% de posibilidades de cáncer de por vida (p. Ej., Mutaciones de p53 ). Estas mutaciones de la línea germinal se muestran en un recuadro a la izquierda de la figura, con una indicación de su contribución a la deficiencia de reparación del ADN. Sin embargo, tales mutaciones de la línea germinal (que causan síndromes de cáncer de alta penetración ) son la causa de solo alrededor del uno por ciento de los cánceres.
La mayoría de los cánceres se denominan no hereditarios o "cánceres esporádicos". Aproximadamente el 30% de los cánceres esporádicos tienen algún componente hereditario que actualmente no está definido, mientras que la mayoría, o el 70% de los cánceres esporádicos, no tienen ningún componente hereditario.
En los cánceres esporádicos, una deficiencia en la reparación del ADN se debe ocasionalmente a una mutación en un gen de reparación del ADN; con mucha más frecuencia, la expresión reducida o ausente de los genes de reparación del ADN se debe a alteraciones epigenéticas que reducen o silencian la expresión génica . Esto se indica en la figura del 3er nivel desde arriba. Por ejemplo, para 113 cánceres colorrectales examinados en secuencia, solo cuatro tenían una mutación sin sentido en el gen MGMT de reparación del ADN , mientras que la mayoría tenía expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética).
Cuando se reduce la expresión de los genes de reparación del ADN, se produce una deficiencia en la reparación del ADN. Esto se muestra en la figura del cuarto nivel desde arriba. Con una deficiencia de reparación del ADN, el daño del ADN persiste en las células a un nivel más alto que el típico (quinto nivel desde la parte superior en la figura); este daño excesivo provoca un aumento de la frecuencia de mutación y / o epimutación (6º nivel desde la parte superior de la figura). Experimentalmente, las tasas de mutación aumentan sustancialmente en células defectuosas en la reparación de desajustes de ADN o en la reparación recombinacional homóloga (HRR). Los reordenamientos cromosómicos y la aneuploidía también aumentan en las células con HRR defectuosa. Durante la reparación de roturas de doble hebra del ADN, o la reparación de otros daños en el ADN, los sitios de reparación que no se aclaran por completo pueden causar silenciamiento génico epigenético.
Las mutaciones somáticas y alteraciones epigenéticas causadas por el daño del ADN y las deficiencias en la reparación del ADN se acumulan en defectos de campo . Los defectos de campo son tejidos de apariencia normal con múltiples alteraciones (que se analizan en la sección siguiente) y son precursores comunes del desarrollo del clon de tejido desordenado y con proliferación excesiva en un cáncer. Tales defectos de campo (segundo nivel desde la parte inferior de la figura) pueden tener numerosas mutaciones y alteraciones epigenéticas.
Es imposible determinar la causa inicial de la mayoría de los cánceres específicos. En unos pocos casos, solo existe una causa: por ejemplo, el virus HHV-8 causa todos los sarcomas de Kaposi . Sin embargo, con la ayuda de técnicas e información de epidemiología del cáncer , es posible producir una estimación de una causa probable en muchas más situaciones. Por ejemplo, el cáncer de pulmón tiene varias causas, incluido el consumo de tabaco y el gas radón . Los hombres que actualmente fuman tabaco desarrollan cáncer de pulmón a una tasa 14 veces mayor que la de los hombres que nunca han fumado tabaco: la probabilidad de que el cáncer de pulmón en un fumador actual sea causado por fumar es aproximadamente del 93%; Existe un 7% de probabilidad de que el cáncer de pulmón del fumador haya sido causado por gas radón o alguna otra causa no relacionada con el tabaco. Estas correlaciones estadísticas han hecho posible que los investigadores infieran que ciertas sustancias o comportamientos son cancerígenos. El humo del tabaco causa un mayor daño al ADN exógeno , y este daño al ADN es la causa probable de cáncer de pulmón debido al tabaquismo. Entre los más de 5.000 compuestos presentes en el humo del tabaco, los agentes genotóxicos que dañan el ADN que se producen en las concentraciones más altas y que tienen los efectos mutagénicos más fuertes son la acroleína , el formaldehído , el acrilonitrilo , el 1,3-butadieno , el acetaldehído , el óxido de etileno y el isopreno. .
Usando biológicos moleculares técnicas, es posible caracterizar las mutaciones, epimutaciones o aberraciones cromosómicas dentro de un tumor, y se está haciendo un rápido progreso en el campo de la predicción de ciertos pacientes de cáncer pronóstico basado en el espectro de mutaciones. Por ejemplo, hasta la mitad de todos los tumores tienen un gen p53 defectuoso. Esta mutación se asocia con un mal pronóstico, ya que es menos probable que esas células tumorales entren en apoptosis o muerte celular programada cuando se dañan por la terapia. Las mutaciones de la telomerasa eliminan barreras adicionales, extendiendo el número de veces que una célula puede dividirse. Otras mutaciones permiten que el tumor desarrolle nuevos vasos sanguíneos para proporcionar más nutrientes, o hacer metástasis , extendiéndose a otras partes del cuerpo. Sin embargo, una vez que se forma un cáncer, continúa evolucionando y produciendo subclones. En 2012 se informó que una sola muestra de cáncer renal, muestreada en nueve áreas diferentes, tenía 40 mutaciones "ubicuas", encontradas en las nueve áreas, 59 mutaciones compartidas por algunas, pero no las nueve áreas, y 29 mutaciones "privadas" solamente. presente en un área.
Los linajes de células en los que se acumulan todas estas alteraciones del ADN son difíciles de rastrear, pero dos líneas recientes de evidencia sugieren que las células madre normales pueden ser las células de origen en los cánceres. Primero, existe una correlación altamente positiva (rho de Spearman = 0,81; P <3,5 × 10−8) entre el riesgo de desarrollar cáncer en un tejido y el número de divisiones normales de células madre que tienen lugar en ese mismo tejido. La correlación se aplicó a 31 tipos de cáncer y se extendió a cinco órdenes de magnitud . Esta correlación significa que si las células madre normales de un tejido se dividen una vez, el riesgo de cáncer en ese tejido es aproximadamente 1X. Si se dividen 1,000 veces, el riesgo de cáncer es 1,000X. Y si las células madre normales de un tejido se dividen 100.000 veces, el riesgo de cáncer en ese tejido es aproximadamente 100.000 veces. Esto sugiere fuertemente que el factor principal en la iniciación del cáncer es el hecho de que las células madre "normales" se dividen, lo que implica que el cáncer se origina en células madre normales y sanas.
En segundo lugar, las estadísticas muestran que la mayoría de los cánceres humanos se diagnostican en personas mayores. Una posible explicación es que los cánceres ocurren porque las células acumulan daño a lo largo del tiempo. El ADN es el único componente celular que puede acumular daños durante todo el curso de una vida, y las células madre son las únicas células que pueden transmitir ADN desde el cigoto a las células tardías de la vida. Otras células, derivadas de células madre, no conservan el ADN desde el comienzo de la vida hasta que se produce un posible cáncer. Esto implica que la mayoría de los cánceres surgen de células madre normales.
Contribución de los defectos de campo

El término " cancerización de campo " se utilizó por primera vez en 1953 para describir un área o "campo" de epitelio que ha sido preacondicionado (en ese momento) por procesos en gran parte desconocidos para predisponerlo al desarrollo de cáncer. Desde entonces, los términos "cancerización de campo" y "defecto de campo" se han utilizado para describir el tejido premaligno en el que es probable que surjan nuevos cánceres.
Se han identificado defectos de campo en asociación con cánceres y son importantes en la progresión al cáncer. Sin embargo, Rubin señaló que "la gran mayoría de los estudios de investigación sobre el cáncer se han realizado en tumores bien definidos in vivo o en focos neoplásicos discretos in vitro. Sin embargo, hay pruebas de que más del 80% de las mutaciones somáticas encontrados en tumores colorrectales humanos de fenotipo mutante ocurren antes del inicio de la expansión clonal terminal… "Más de la mitad de las mutaciones somáticas identificadas en tumores ocurrieron en una fase preneoplásica (en un defecto de campo), durante el crecimiento de células aparentemente normales. También sería de esperar que muchas de las alteraciones epigenéticas presentes en los tumores pudieran haber ocurrido en defectos de campo preneoplásicos.
En el colon, un defecto de campo probablemente surge por selección natural de una célula mutante o alterada epigenéticamente entre las células madre en la base de una de las criptas intestinales en la superficie interna del colon. Una célula madre mutante o alterada epigenéticamente puede reemplazar a las otras células madre cercanas por selección natural. Esto puede hacer que surja un parche de tejido anormal. La figura de esta sección incluye una foto de un segmento del colon recién resecado y abierto longitudinalmente que muestra un cáncer de colon y cuatro pólipos. Debajo de la foto hay un diagrama esquemático de cómo se puede haber formado un gran parche de células mutantes o alteradas epigenéticamente, mostrado por el área grande en amarillo en el diagrama. Dentro de este primer parche grande en el diagrama (un gran clon de células), puede ocurrir una segunda mutación o alteración epigenética, de modo que una célula madre determinada adquiere una ventaja en comparación con sus vecinas, y esta célula madre alterada puede expandirse clonalmente, formando un parche secundario, o subclon, dentro del parche original. Esto se indica en el diagrama mediante cuatro parches más pequeños de diferentes colores dentro del área original amarilla grande. Dentro de estos nuevos parches (subclones), el proceso puede repetirse varias veces, indicado por los parches aún más pequeños dentro de los cuatro parches secundarios (con colores aún diferentes en el diagrama) que se expanden clonalmente, hasta que surgen células madre que generan pequeñas pólipos o bien una neoplasia maligna (cáncer). En la foto, un aparente defecto de campo en este segmento de un colon ha generado cuatro pólipos (etiquetados con el tamaño de los pólipos, 6 mm, 5 mm y dos de 3 mm, y un cáncer de unos 3 cm de ancho en su dimensión más larga). Estas neoplasias también están indicadas (en el diagrama debajo de la foto) por 4 círculos pequeños de color canela (pólipos) y un área roja más grande (cáncer). El cáncer en la foto ocurrió en el área cecal del colon, donde el colon se une al intestino delgado (etiquetado) y donde se encuentra el apéndice (etiquetado). La grasa de la foto es externa a la pared externa del colon. En el segmento de colon que se muestra aquí, el colon se abrió longitudinalmente para exponer su superficie interna y mostrar el cáncer y los pólipos que se encuentran dentro del revestimiento epitelial interno del colon.
Si el proceso general por el cual surgen los cánceres de colon esporádicos es la formación de un clon preneoplásico que se propaga por selección natural, seguido de la formación de subclones internos dentro del clon inicial y sub-subclones dentro de ellos, entonces cánceres de colon por lo general, debe estar asociado con campos de anormalidad creciente y estar precedido por ellos, lo que refleja la sucesión de eventos premalignos. La región más extensa de anomalía (el área irregular amarilla más externa en el diagrama) reflejaría el evento más temprano en la formación de una neoplasia maligna.
En la evaluación experimental de deficiencias de reparación de ADN específicas en cánceres, también se demostró que ocurren muchas deficiencias de reparación de ADN específicas en los defectos de campo que rodean esos cánceres. La siguiente tabla da ejemplos para los cuales se demostró que la deficiencia de reparación del ADN en un cáncer fue causada por una alteración epigenética, y las frecuencias algo más bajas con las que se encontró la misma deficiencia de reparación del ADN causada epigenéticamente en el defecto de campo circundante.
| Cáncer | Gene | Frecuencia en cáncer | Frecuencia en el defecto de campo | Referencia |
|---|---|---|---|---|
| Colorrectal | MGMT | 46% | 34% | |
| Colorrectal | MGMT | 47% | 11% | |
| Colorrectal | MGMT | 70% | 60% | |
| Colorrectal | MSH2 | 13% | 5% | |
| Colorrectal | ERCC1 | 100% | 40% | |
| Colorrectal | PMS2 | 88% | 50% | |
| Colorrectal | XPF | 55% | 40% | |
| Cabeza y cuello | MGMT | 54% | 38% | |
| Cabeza y cuello | MLH1 | 33% | 25% | |
| Cabeza y cuello | MLH1 | 31% | 20% | |
| Estómago | MGMT | 88% | 78% | |
| Estómago | MLH1 | 73% | 20% | |
| Esófago | MLH1 | 77% –100% | 23% -79% |
Algunos de los pólipos pequeños en el defecto de campo que se muestra en la foto del segmento de colon abierto pueden ser neoplasias relativamente benignas. En un estudio de 1996 de pólipos de menos de 10 mm de tamaño encontrados durante la colonoscopia y seguidos con colonoscopias repetidas durante 3 años, el 25% permaneció sin cambios de tamaño, el 35% retrocedió o se redujo de tamaño y el 40% creció de tamaño.
Inestabilidad del genoma
Se sabe que los cánceres exhiben inestabilidad del genoma o un "fenotipo mutador". El ADN que codifica proteínas dentro del núcleo es aproximadamente el 1,5% del ADN genómico total. Dentro de este ADN que codifica proteínas (llamado exoma ), un cáncer promedio de mama o colon puede tener alrededor de 60 a 70 mutaciones que alteran las proteínas, de las cuales alrededor de 3 o 4 pueden ser mutaciones "impulsoras" y las restantes pueden ser " pasajero "mutaciones. Sin embargo, el número medio de mutaciones de la secuencia de ADN en todo el genoma (incluidas las regiones que no codifican proteínas ) dentro de una muestra de tejido de cáncer de mama es de unas 20.000. En una muestra promedio de tejido de melanoma (los melanomas tienen una mayor frecuencia de mutación en el exoma ), el número total de mutaciones en la secuencia de ADN es de aproximadamente 80.000. Estas altas frecuencias de mutaciones en las secuencias de nucleótidos totales dentro de los cánceres sugieren que a menudo una alteración temprana en el defecto de campo que da lugar a un cáncer (por ejemplo, área amarilla en el diagrama de la sección anterior) es una deficiencia en la reparación del ADN. Los grandes defectos de campo que rodean a los cánceres de colon (que se extienden hasta unos 10 cm a cada lado de un cáncer) suelen tener defectos epigenéticos en dos o tres proteínas de reparación del ADN ( ERCC1 , ERCC4 (XPF) y / o PMS2 ) en toda el área de el defecto de campo. Cuando se reduce la expresión de los genes de reparación del ADN, el daño del ADN se acumula en las células a un ritmo superior al normal y este daño excesivo provoca una mayor frecuencia de mutación y / o epimutación. Las tasas de mutación aumentan considerablemente en las células defectuosas en la reparación del desajuste del ADN o en la reparación recombinacional homóloga (HRR). Una deficiencia en la reparación del ADN, en sí misma, puede permitir que se acumule el daño del ADN, y la síntesis de translesión propensa a errores de algunas de las áreas dañadas puede dar lugar a mutaciones. Además, la reparación defectuosa de este daño acumulado del ADN puede dar lugar a epimutaciones. Estas nuevas mutaciones y / o epimutaciones pueden proporcionar una ventaja proliferativa, generando un defecto de campo. Aunque las mutaciones / epimutaciones en los genes de reparación del ADN no confieren por sí mismas una ventaja selectiva, pueden ser transportadas como pasajeros en las células cuando la célula adquiere una mutación / epimutación adicional que sí proporciona una ventaja proliferativa.
Teorías no convencionales
Hay una serie de teorías sobre la carcinogénesis y el tratamiento del cáncer que quedan fuera de la corriente principal de la opinión científica, debido a la falta de fundamento, lógica o evidencia científica. Estas teorías pueden usarse para justificar varios tratamientos alternativos contra el cáncer. Deben distinguirse de las teorías de la carcinogénesis que tienen una base lógica dentro de la biología del cáncer convencional y a partir de las cuales se pueden formular hipótesis comprobables de manera convencional.
Sin embargo, varias teorías alternativas de la carcinogénesis se basan en pruebas científicas y se reconocen cada vez más. Algunos investigadores creen que el cáncer puede ser causado por aneuploidía (anomalías numéricas y estructurales en los cromosomas) más que por mutaciones o epimutaciones. El cáncer también se ha considerado como una enfermedad metabólica, en la que el metabolismo celular del oxígeno se desvía de la vía que genera energía ( fosforilación oxidativa ) a la vía que genera especies reactivas de oxígeno . Esto provoca un cambio de energía de la fosforilación oxidativa a la glucólisis aeróbica ( hipótesis de Warburg ) y la acumulación de especies reactivas de oxígeno que conducen al estrés oxidativo ("teoría del cáncer por estrés oxidativo"). Otro concepto del desarrollo del cáncer se basa en la exposición a campos magnéticos y electromagnéticos débiles y sus efectos sobre el estrés oxidativo , conocido como magnetocarcinogénesis.
Varios autores han cuestionado la suposición de que los cánceres resultan de mutaciones aleatorias secuenciales como demasiado simplista, sugiriendo en cambio que el cáncer es el resultado de una falla del cuerpo para inhibir una tendencia proliferativa innata y programada. Una teoría relacionada sugiere que el cáncer es un atavismo , un retroceso evolutivo a una forma anterior de vida multicelular . Los genes responsables del crecimiento celular descontrolado y la cooperación entre las células cancerosas son muy similares a los que permitieron que las primeras formas de vida multicelulares se agruparan y florecieran. Estos genes todavía existen dentro de los genomas de metazoos más complejos , como los humanos, aunque los genes de evolución más reciente los mantienen bajo control. Cuando los genes controladores más nuevos fallan por cualquier motivo, la célula puede volver a su programación más primitiva y reproducirse sin control. La teoría es una alternativa a la noción de que los cánceres comienzan con células rebeldes que evolucionan dentro del cuerpo. En cambio, poseen un número fijo de genes primitivos que se activan progresivamente, lo que les da una variabilidad finita. Otra teoría evolutiva sitúa las raíces del cáncer en el origen de la célula eucariota (nucleada) mediante una transferencia horizontal masiva de genes , cuando los genomas de los virus infectantes fueron escindidos (y por lo tanto atenuados) por el huésped, pero sus fragmentos se integraron en el genoma del huésped. como protección inmunológica. Por tanto, el cáncer se origina cuando una rara mutación somática recombina tales fragmentos en un impulsor funcional de la proliferación celular.
Biología de las células cancerosas
A menudo, los múltiples cambios genéticos que resultan en cáncer pueden tardar muchos años en acumularse. Durante este tiempo, el comportamiento biológico de las células premalignas cambia lentamente de las propiedades de las células normales a las propiedades cancerosas. El tejido premaligno puede tener un aspecto distintivo bajo el microscopio . Entre los rasgos distintivos de una lesión pre-maligna se encuentran un mayor número de células en división , variación en el tamaño y forma del núcleo , variación en el tamaño y forma de las células , pérdida de características celulares especializadas y pérdida de la organización normal del tejido. La displasia es un tipo anormal de proliferación celular excesiva que se caracteriza por la pérdida de la disposición normal del tejido y la estructura celular en las células premalignas. Estos cambios neoplásicos tempranos deben distinguirse de la hiperplasia , un aumento reversible de la división celular causado por un estímulo externo, como un desequilibrio hormonal o una irritación crónica.
Los casos más graves de displasia se conocen como carcinoma in situ . En latín, el término in situ significa "en el lugar"; El carcinoma in situ se refiere a un crecimiento descontrolado de células displásicas que permanece en su ubicación original y no ha mostrado invasión a otros tejidos. El carcinoma in situ puede convertirse en una neoplasia maligna invasiva y, por lo general, se extirpa quirúrgicamente cuando se detecta.
Evolución clonal
Así como una población de animales experimenta una evolución , una población de células sin control también puede experimentar una "evolución". Este proceso indeseable se llama evolución somática , y es como surge el cáncer y se vuelve más maligno con el tiempo.
La mayoría de los cambios en el metabolismo celular que permiten que las células crezcan de manera desordenada conducen a la muerte celular. Sin embargo, una vez que comienza el cáncer, las células cancerosas se someten a un proceso de selección natural : las pocas células con nuevos cambios genéticos que mejoran su supervivencia o reproducción se multiplican más rápido y pronto llegan a dominar el tumor en crecimiento a medida que las células con cambios genéticos menos favorables son superadas. . Este es el mismo mecanismo por el cual especies patógenas como MRSA pueden volverse resistentes a los antibióticos y por el cual el VIH puede volverse resistente a los medicamentos , y por el cual las enfermedades de las plantas y los insectos pueden volverse resistentes a los pesticidas . Esta evolución explica por qué una recaída del cáncer a menudo involucra células que han adquirido resistencia a los medicamentos contra el cáncer o resistencia a la radioterapia ).
Propiedades biológicas de las células cancerosas.
En un artículo de 2000 de Hanahan y Weinberg , las propiedades biológicas de las células tumorales malignas se resumieron de la siguiente manera:
- Adquisición de la autosuficiencia en las señales de crecimiento , lo que conduce a un crecimiento descontrolado.
- Pérdida de sensibilidad a las señales anti-crecimiento, lo que también conduce a un crecimiento descontrolado.
- Pérdida de la capacidad de apoptosis , permitiendo el crecimiento a pesar de errores genéticos y señales externas anti-crecimiento.
- Pérdida de la capacidad de senescencia , que conduce a un potencial replicativo ilimitado (inmortalidad)
- Adquisición de angiogénesis sostenida , lo que permite que el tumor crezca más allá de las limitaciones de la difusión pasiva de nutrientes.
- Adquisición de la capacidad de invadir tejidos vecinos , propiedad definitoria del carcinoma invasivo.
- Adquisición de la capacidad de sembrar metástasis en sitios distantes, una propiedad de aparición tardía de algunos tumores malignos (carcinomas u otros).
La finalización de estos múltiples pasos sería un evento muy raro sin:
- Pérdida de capacidad para reparar errores genéticos, lo que lleva a un aumento de la tasa de mutación (inestabilidad genómica), acelerando así todos los demás cambios.
Estos cambios biológicos son clásicos en los carcinomas ; Es posible que otros tumores malignos no necesiten alcanzarlos todos. Por ejemplo, dado que la invasión de tejidos y el desplazamiento a sitios distantes son propiedades normales de los leucocitos , estos pasos no son necesarios en el desarrollo de la leucemia . Los diferentes pasos tampoco representan necesariamente mutaciones individuales. Por ejemplo, la inactivación de un solo gen, que codifica la proteína p53 , provocará inestabilidad genómica, evasión de la apoptosis y aumento de la angiogénesis. Además, no todas las células cancerosas se están dividiendo. Más bien, un subconjunto de las células de un tumor, llamadas células madre cancerosas , se replican a medida que generan células diferenciadas.
El cáncer como defecto en las interacciones celulares
Normalmente, una vez que un tejido se lesiona o infecta, las células dañadas provocan inflamación al estimular patrones específicos de actividad enzimática y expresión génica de citocinas en las células circundantes. Se secretan grupos discretos ("grupos de citocinas") de moléculas, que actúan como mediadores, induciendo la actividad de cascadas posteriores de cambios bioquímicos. Cada citocina se une a receptores específicos en varios tipos de células, y cada tipo de célula responde a su vez alterando la actividad de las vías de transducción de señales intracelulares, dependiendo de los receptores que la célula expresa y las moléculas de señalización presentes dentro de la célula. En conjunto, este proceso de reprogramación induce un cambio gradual en los fenotipos celulares, que en última instancia conducirá a la restauración de la función del tejido y a la recuperación de la integridad estructural esencial. De este modo, un tejido puede sanar, dependiendo de la comunicación productiva entre las células presentes en el lugar del daño y el sistema inmunológico. Un factor clave en la curación es la regulación de la expresión del gen de las citocinas, que permite que los grupos complementarios de células respondan a los mediadores inflamatorios de una manera que produce gradualmente cambios esenciales en la fisiología de los tejidos. Las células cancerosas tienen cambios permanentes (genéticos) o reversibles (epigenéticos) en su genoma, que inhiben parcialmente su comunicación con las células circundantes y con el sistema inmunológico. Las células cancerosas no se comunican con su microambiente tisular de una manera que proteja la integridad del tejido; en cambio, el movimiento y la supervivencia de las células cancerosas se vuelven posibles en lugares donde pueden afectar la función de los tejidos. Las células cancerosas sobreviven "reconectando" las vías de señales que normalmente protegen el tejido del sistema inmunológico.
Un ejemplo de recableado de la función tisular en el cáncer es la actividad del factor de transcripción NF-κB . NF-κB activa la expresión de numerosos genes implicados en la transición entre la inflamación y la regeneración, que codifican citoquinas, factores de adhesión y otras moléculas que pueden cambiar el destino celular. Esta reprogramación de fenotipos celulares normalmente permite el desarrollo de un tejido intacto completamente funcional. La actividad de NF-κB está estrechamente controlada por múltiples proteínas, que colectivamente aseguran que solo grupos discretos de genes sean inducidos por NF-κB en una célula dada y en un momento dado. Esta estricta regulación del intercambio de señales entre las células protege al tejido de una inflamación excesiva y asegura que los diferentes tipos de células adquieran gradualmente funciones complementarias y posiciones específicas. El fracaso de esta regulación mutua entre la reprogramación genética y las interacciones celulares permite que las células cancerosas den lugar a metástasis. Las células cancerosas responden de manera aberrante a las citocinas y activan cascadas de señales que pueden protegerlas del sistema inmunológico.
En pescado
El papel del yodo en los peces marinos (ricos en yodo) y los peces de agua dulce (deficientes en yodo) no se comprende completamente, pero se ha informado que los peces de agua dulce son más susceptibles a enfermedades infecciosas y, en particular, neoplásicas y ateroscleróticas, que las marinas. pez. Los peces marinos elasmobranquios, como los tiburones, las mantarrayas, etc., se ven mucho menos afectados por el cáncer que los peces de agua dulce y, por lo tanto, han estimulado la investigación médica para comprender mejor la carcinogénesis.
Mecanismos
Para que las células comiencen a dividirse sin control, los genes que regulan el crecimiento celular deben estar desregulados. Los protooncogenes son genes que promueven el crecimiento celular y la mitosis , mientras que los genes supresores de tumores desalientan el crecimiento celular o detienen temporalmente la división celular para llevar a cabo la reparación del ADN . Por lo general, se requiere una serie de varias mutaciones en estos genes antes de que una célula normal se transforme en una célula cancerosa . Este concepto a veces se denomina "oncoevolución". Las mutaciones en estos genes proporcionan las señales para que las células tumorales comiencen a dividirse sin control. Pero la división celular descontrolada que caracteriza al cáncer también requiere que la célula en división duplique todos sus componentes celulares para crear dos células hijas. La activación de la glucólisis anaeróbica ( efecto Warburg ), que no es necesariamente inducida por mutaciones en protooncogenes y genes supresores de tumores, proporciona la mayoría de los componentes básicos necesarios para duplicar los componentes celulares de una célula en división y, por lo tanto, también es esencial. para la carcinogénesis.
Oncogenes
Los oncogenes promueven el crecimiento celular de diversas formas. Muchos pueden producir hormonas , un "mensajero químico" entre las células que fomenta la mitosis , cuyo efecto depende de la transducción de señales del tejido o las células receptoras. En otras palabras, cuando se estimula un receptor de hormonas en una célula receptora, la señal se conduce desde la superficie de la célula al núcleo de la célula para afectar algún cambio en la regulación de la transcripción de genes a nivel nuclear. Algunos oncogenes son parte del propio sistema de transducción de señales, o de los receptores de señales en las células y tejidos mismos, controlando así la sensibilidad a tales hormonas. Los oncogenes a menudo producen mitógenos , o están involucrados en la transcripción del ADN en la síntesis de proteínas , que crea las proteínas y enzimas responsables de producir los productos y los productos bioquímicos con los que las células usan e interactúan.
Las mutaciones en protooncogenes, que son las contrapartes normalmente inactivas de los oncogenes , pueden modificar su expresión y función, aumentando la cantidad o actividad de la proteína producto. Cuando esto sucede, los protooncogenes se convierten en oncogenes y esta transición altera el equilibrio normal de la regulación del ciclo celular en la célula, lo que hace posible el crecimiento descontrolado. La posibilidad de cáncer no se puede reducir eliminando protooncogenes del genoma , incluso si esto fuera posible, ya que son fundamentales para el crecimiento, la reparación y la homeostasis del organismo. Solo cuando se transforman, las señales de crecimiento se vuelven excesivas.
Uno de los primeros oncogenes que se definió en la investigación del cáncer es el oncogén ras . Las mutaciones en la familia Ras de protooncogenes (que comprende H-Ras, N-Ras y K-Ras) son muy comunes y se encuentran en el 20% al 30% de todos los tumores humanos. Ras se identificó originalmente en el genoma del virus del sarcoma de Harvey y los investigadores se sorprendieron de que este gen no solo esté presente en el genoma humano, sino que también, cuando se liga a un elemento de control estimulante, podría inducir cánceres en cultivos de líneas celulares.
Protooncogenes
Los protooncogenes promueven el crecimiento celular de diversas formas. Muchos pueden producir hormonas , "mensajeros químicos" entre las células que fomentan la mitosis, cuyo efecto depende de la transducción de señales del tejido o las células receptoras. Algunos son responsables del sistema de transducción de señales y de los receptores de señales en las células y tejidos mismos, controlando así la sensibilidad a dichas hormonas. A menudo producen mitógenos o están involucrados en la transcripción del ADN en la síntesis de proteínas , que crean las proteínas y enzimas responsables de producir los productos y bioquímicos que usan e interactúan las células.
Las mutaciones en protooncogenes pueden modificar su expresión y función, aumentando la cantidad o actividad de la proteína producto. Cuando esto sucede, se convierten en oncogenes y, por lo tanto, las células tienen una mayor probabilidad de dividirse de manera excesiva e incontrolable. La posibilidad de cáncer no se puede reducir eliminando los protooncogenes del genoma , ya que son fundamentales para el crecimiento, la reparación y la homeostasis del cuerpo. Solo cuando se transforman, las señales de crecimiento se vuelven excesivas. Es importante señalar que un gen que posee una función promotora del crecimiento puede aumentar el potencial carcinogénico de una célula, con la condición de que se activen todos los mecanismos celulares necesarios que permiten el crecimiento. Esta condición también incluye la inactivación de genes supresores de tumores específicos (ver más abajo). Si no se cumple la condición, la célula puede dejar de crecer y puede proceder a morir. Esto hace que la identificación de la etapa y el tipo de célula cancerosa que crece bajo el control de un oncogén determinado sea crucial para el desarrollo de estrategias de tratamiento.
Genes supresores de tumores

Los genes supresores de tumores codifican señales y proteínas antiproliferación que suprimen la mitosis y el crecimiento celular. Generalmente, los supresores de tumores son factores de transcripción que se activan por estrés celular o daño del ADN. A menudo, el daño del ADN provocará la presencia de material genético flotante, así como otros signos, y desencadenará enzimas y vías que conducen a la activación de genes supresores de tumores . La función de estos genes es detener la progresión del ciclo celular para llevar a cabo la reparación del ADN, evitando que las mutaciones se transmitan a las células hijas. La proteína p53 , uno de los genes supresores de tumores estudiados más importantes, es un factor de transcripción activado por muchos factores estresantes celulares, incluida la hipoxia y el daño por radiación ultravioleta .
A pesar de que casi la mitad de todos los cánceres posiblemente involucran alteraciones en p53, su función supresora de tumores es poco conocida. La p53 tiene claramente dos funciones: una, una función nuclear como factor de transcripción y la otra, una función citoplasmática en la regulación del ciclo celular, la división celular y la apoptosis.
La hipótesis de Warburg es el uso preferencial de la glucólisis como energía para sostener el crecimiento del cáncer. Se ha demostrado que p53 regula el cambio de la vía respiratoria a la vía glucolítica.
Sin embargo, una mutación puede dañar el propio gen supresor de tumores, o la vía de señal que lo activa, "apagándolo". La consecuencia invariable de esto es que la reparación del ADN se ve obstaculizada o inhibida: el daño del ADN se acumula sin reparación, lo que conduce inevitablemente al cáncer.
Las mutaciones de los genes supresores de tumores que ocurren en las células de la línea germinal se transmiten a la descendencia y aumentan la probabilidad de diagnóstico de cáncer en las generaciones posteriores. Los miembros de estas familias tienen una mayor incidencia y una menor latencia de múltiples tumores. Los tipos de tumores son típicos para cada tipo de mutación del gen supresor de tumores; algunas mutaciones causan cánceres particulares y otras mutaciones causan otros. El modo de herencia de los supresores de tumores mutantes es que un miembro afectado hereda una copia defectuosa de uno de los padres y una copia normal del otro. Por ejemplo, los individuos que heredan un alelo p53 mutante (y por lo tanto son heterocigotos para p53 mutado ) pueden desarrollar melanomas y cáncer de páncreas , conocido como síndrome de Li-Fraumeni . Otros síndromes hereditarios de genes supresores de tumores incluyen mutaciones Rb , vinculadas al retinoblastoma , y mutaciones del gen APC , vinculadas al cáncer de colon por adenopoliposis . El cáncer de colon por adenopoliposis se asocia con miles de pólipos en el colon cuando es joven, lo que lleva al cáncer de colon a una edad relativamente temprana. Finalmente, las mutaciones heredadas en BRCA1 y BRCA2 conducen a la aparición temprana del cáncer de mama .
En 1971 se propuso que el desarrollo del cáncer dependiera de al menos dos eventos mutacionales. En lo que se conoció como la hipótesis de los dos golpes de Knudson , una mutación hereditaria de la línea germinal en un gen supresor de tumores causaría cáncer solo si ocurriera otro evento de mutación más adelante en la vida del organismo, inactivando el otro alelo de ese gen supresor de tumores .
Por lo general, los oncogenes son dominantes , ya que contienen mutaciones con ganancia de función , mientras que los supresores de tumores mutados son recesivos , ya que contienen mutaciones con pérdida de función . Cada célula tiene dos copias del mismo gen, una de cada padre y, en la mayoría de los casos, la ganancia de mutaciones funcionales en una sola copia de un protooncogén particular es suficiente para convertir ese gen en un verdadero oncogén. Por otro lado, las mutaciones de pérdida de función deben ocurrir en ambas copias de un gen supresor de tumores para hacer que ese gen sea completamente no funcional. Sin embargo, existen casos en los que una copia mutada de un gen supresor de tumores puede hacer que la otra copia de tipo salvaje no sea funcional. Este fenómeno se denomina efecto negativo dominante y se observa en muchas mutaciones de p53.
El modelo de dos hits de Knudson ha sido cuestionado recientemente por varios investigadores. La inactivación de un alelo de algunos genes supresores de tumores es suficiente para producir tumores. Este fenómeno se denomina haploinsuficiencia y se ha demostrado mediante varios enfoques experimentales. Los tumores causados por la haploinsuficiencia suelen tener una edad de aparición más tardía en comparación con los de un proceso de dos aciertos.
Varias mutaciones
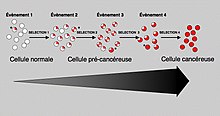
En general, se requieren mutaciones en ambos tipos de genes para que ocurra el cáncer. Por ejemplo, una mutación limitada a un oncogén sería suprimida por los genes supresores de tumores y de control de la mitosis normales, inicialmente planteados por la hipótesis de Knudson . Una mutación en un solo gen supresor de tumores tampoco causaría cáncer, debido a la presencia de muchos genes "de respaldo " que duplican sus funciones. Solo cuando suficientes protooncogenes han mutado en oncogenes y suficientes genes supresores de tumores desactivados o dañados, las señales para el crecimiento celular superan las señales para regularlo, que el crecimiento celular rápidamente se sale de control. A menudo, debido a que estos genes regulan los procesos que previenen la mayor parte del daño a los genes mismos, la tasa de mutaciones aumenta a medida que uno envejece, porque el daño del ADN forma un circuito de retroalimentación .
La mutación de los genes supresores de tumores que se transmiten a la siguiente generación, no solo a las células, sino a su descendencia , puede aumentar las probabilidades de que los cánceres se hereden. Los miembros de estas familias tienen una mayor incidencia y una menor latencia de múltiples tumores. El modo de herencia de los supresores de tumores mutantes es que el miembro afectado hereda una copia defectuosa de uno de los padres y una copia normal de otro. Debido a que las mutaciones en los supresores de tumores actúan de manera recesiva (tenga en cuenta, sin embargo, que hay excepciones), la pérdida de la copia normal crea el fenotipo del cáncer . Por ejemplo, los individuos que son heterocigotos para las mutaciones de p53 a menudo son víctimas del síndrome de Li-Fraumeni y que son heterocigotos para las mutaciones de Rb desarrollan retinoblastoma . De manera similar, las mutaciones en el gen de la poliposis coli adenomatosa están relacionadas con el cáncer de colon por adenopoliposis , con miles de pólipos en el colon cuando son jóvenes, mientras que las mutaciones en BRCA1 y BRCA2 conducen a la aparición temprana del cáncer de mama .
Una nueva idea anunciada en 2011 es una versión extrema de múltiples mutaciones, llamada cromotripsis por sus defensores. Esta idea, que afecta sólo al 2-3% de los casos de cáncer, aunque hasta al 25% de los cánceres de huesos, implica la destrucción catastrófica de un cromosoma en decenas o cientos de piezas y luego volver a unirlas de forma incorrecta. Esta ruptura probablemente tiene lugar cuando los cromosomas se compactan durante la división celular normal , pero se desconoce el desencadenante de la ruptura. Según este modelo, el cáncer surge como resultado de un evento único y aislado, en lugar de la lenta acumulación de múltiples mutaciones.
Carcinógenos no mutagénicos
Muchos mutágenos también son carcinógenos , pero algunos carcinógenos no son mutágenos. Ejemplos de carcinógenos que no son mutágenos incluyen el alcohol y el estrógeno . Se cree que estos promueven el cáncer a través de su efecto estimulante sobre la tasa de mitosis celular . Las tasas más rápidas de mitosis dejan cada vez menos oportunidades para que las enzimas de reparación repare el ADN dañado durante la replicación del ADN , lo que aumenta la probabilidad de un error genético. Un error cometido durante la mitosis puede hacer que las células hijas reciban un número incorrecto de cromosomas , lo que provoca aneuploidía y puede provocar cáncer.
Papel de las infecciones
Bacteriano
Helicobacter pylori puede causar cáncer gástrico . Aunque los datos varían entre los diferentes países, en general alrededor del 1% al 3% de las personas infectadas con Helicobacter pylori desarrollan cáncer gástrico en su vida en comparación con el 0,13% de las personas que no han tenido unainfección por H. pylori . La infección por H. pylori es muy frecuente. Según se evaluó en 2002, está presente en los tejidos gástricos del 74% de los adultos de mediana edad en los países en desarrollo y del 58% en los países desarrollados. Dado que es probable que entre el 1% y el 3% de las personas infectadas desarrollen cáncer gástrico,el cáncer gástrico inducido por H. pylori es la tercera causa más alta de mortalidad por cáncer en todo el mundo a partir de 2018.
La infección por H. pylori no causa síntomas en aproximadamente el 80% de los infectados. Aproximadamente el 75% de las personas infectadas con H. pylori desarrollan gastritis . Por tanto, la consecuencia habitual de la infección por H. pylori es la gastritis crónica asintomática. Debido a la ausencia habitual de síntomas, cuando finalmente se diagnostica el cáncer de estómago, a menudo está bastante avanzado. Más de la mitad de los pacientes con cáncer gástrico tienen metástasis en los ganglios linfáticos cuando se les diagnostica inicialmente.
La gastritis causada por H. pylori se acompaña de inflamación , caracterizada por la infiltración de neutrófilos y macrófagos al epitelio gástrico, lo que favorece la acumulación de citocinas proinflamatorias y especies reactivas de oxígeno / especies reactivas de nitrógeno (ROS / RNS). La presencia sustancial de ROS / RNS provoca daños en el ADN, incluida la 8-oxo-2'-desoxiguanosina (8-OHdG). Si el H. pylori infectante porta el gen cagA citotóxico (presente en aproximadamente el 60% de los aislamientos occidentales y un porcentaje más alto de aislamientos asiáticos), pueden aumentar el nivel de 8-OHdG en las células gástricas en 8 veces, mientras que si el H .pylori no portan el gen cagA, el aumento de 8-OHdG es aproximadamente 4 veces. Además del daño oxidativo del ADN 8-OHdG, la infección por H. pylori causa otros daños característicos del ADN, incluidas las roturas de la doble cadena del ADN.
H. pylori también causa muchas alteraciones epigenéticas relacionadas con el desarrollo del cáncer. Estas alteraciones epigenéticas se deben a la metilación de sitios CpG inducida por H. pylori en los promotores de genes y la expresión alterada de múltiples microARN inducida por H. pylori .
Según lo revisado por Santos y Ribeiro, la infección por H. pylori se asocia con una eficiencia epigenética reducida de la maquinaria de reparación del ADN, lo que favorece la acumulación de mutaciones e inestabilidad genómica, así como la carcinogénesis gástrica. En particular, Raza et al. demostraron que la expresión de dos proteínas reparadoras del ADN, ERCC1 y PMS2 , se redujo drásticamente una vez que la infección por H. pylori había progresado hasta causar dispepsia . La dispepsia ocurre en aproximadamente el 20% de las personas infectadas. Además, según lo revisado por Raza et al., La infección gástrica humana con H. pylori causa una expresión proteica reducida epigenéticamente de las proteínas de reparación del ADN MLH1 , MGMT y MRE11 . La reparación reducida del ADN en presencia de un mayor daño del ADN aumenta las mutaciones carcinogénicas y es probablemente una causa importante de carcinogénesis por H. pylori .
Viral
Además, muchos cánceres se originan a partir de una infección viral ; esto es especialmente cierto en animales como las aves , pero menos en los seres humanos . El 12% de los cánceres humanos se pueden atribuir a una infección viral. El modo de los tumores inducidos por virus se puede dividir en dos, de transformación aguda o de transformación lenta . En los virus de transformación aguda, las partículas virales portan un gen que codifica un oncogén hiperactivo llamado oncogén viral (v-onc), y la célula infectada se transforma tan pronto como se expresa v-onc. Por el contrario, en los virus de transformación lenta, el genoma del virus se inserta, especialmente porque la inserción del genoma viral es parte obligatoria de los retrovirus , cerca de un protooncogén en el genoma del huésped. El promotor viral u otros elementos de regulación de la transcripción, a su vez, provocan la sobreexpresión de ese protooncogén, que, a su vez, induce una proliferación celular descontrolada. Debido a que la inserción del genoma viral no es específica de los protooncogenes y la posibilidad de inserción cerca de ese protooncogén es baja, los virus de transformación lenta tienen una latencia tumoral muy larga en comparación con los virus de transformación aguda, que ya portan el oncogén viral.
Los virus que se sabe que causan cáncer, como el VPH ( cáncer de cuello uterino ), la hepatitis B ( cáncer de hígado ) y el VEB (un tipo de linfoma ), son todos virus de ADN. Se cree que cuando el virus infecta una célula, inserta una parte de su propio ADN cerca de los genes de crecimiento celular, provocando la división celular. El grupo de células modificadas que se forman a partir de la primera división celular tienen el mismo ADN viral cerca de los genes de crecimiento celular. El grupo de células modificadas ahora es especial porque se ha perdido uno de los controles normales del crecimiento.
Dependiendo de su ubicación, las células pueden resultar dañadas por la radiación, las sustancias químicas del humo del cigarrillo y la inflamación de una infección bacteriana u otros virus. Cada celda tiene posibilidades de sufrir daños. Las células a menudo mueren si se dañan, debido a la falla de un proceso vital o del sistema inmunológico; sin embargo, a veces el daño destruye un solo gen del cáncer. En una persona mayor, hay miles, decenas de miles o cientos de miles de células eliminadas. La probabilidad de que alguien desarrolle un cáncer es muy baja.
Cuando el daño ocurre en cualquier área de células modificadas, ocurre algo diferente. Cada una de las células tiene potencial de crecimiento. Las células modificadas se dividirán más rápido cuando el área sea dañada por agentes físicos, químicos o virales. Se ha creado un círculo vicioso : dañar el área hará que las células modificadas se dividan, lo que aumentará la probabilidad de que sufran knock-out.
Este modelo de carcinogénesis es popular porque explica por qué crecen los cánceres. Se esperaría que las células dañadas por la radiación murieran o al menos estuvieran peor porque tienen menos genes funcionando; los virus aumentan el número de genes que funcionan.
Un pensamiento es que podemos terminar con miles de vacunas para prevenir todos los virus que pueden cambiar nuestras células. Los virus pueden tener diferentes efectos en diferentes partes del cuerpo. Puede ser posible prevenir varios cánceres diferentes inmunizando contra un agente viral. Es probable que el VPH, por ejemplo, intervenga en los cánceres de las membranas mucosas de la boca.
Helmintiasis
Se sabe que ciertos gusanos parásitos son cancerígenos. Éstos incluyen:
- Clonorchis sinensis (el organismo que causa la clonorquiasis ) y Opisthorchis viverrini (que causa la opistorquiasis ) están asociados con el colangiocarcinoma .
- Las especies de Schistosoma (los organismos que causan la esquistosomiasis ) están asociadas con el cáncer de vejiga .
Epigenética
La epigenética es el estudio de la regulación de la expresión génica a través de cambios químicos no mutacionales en la estructura del ADN. La teoría de la epigenética en la patogénesis del cáncer es que los cambios no mutacionales en el ADN pueden conducir a alteraciones en la expresión génica. Normalmente, los oncogenes son silenciosos, por ejemplo, debido a la metilación del ADN . La pérdida de esa metilación puede inducir la expresión aberrante de oncogenes , lo que conduce a la patogénesis del cáncer. Los mecanismos conocidos de cambio epigenético incluyen la metilación del ADN y la metilación o acetilación de las proteínas histonas unidas al ADN cromosómico en ubicaciones específicas. Las clases de medicamentos, conocidos como inhibidores de HDAC e inhibidores de la metiltransferasa de ADN , pueden volver a regular la señalización epigenética en la célula cancerosa .
Las epimutaciones incluyen metilaciones o desmetilaciones de las islas CpG de las regiones promotoras de genes, que dan como resultado la represión o des-represión, respectivamente, de la expresión génica. Las epimutaciones también pueden ocurrir por acetilación, metilación, fosforilación u otras alteraciones de las histonas, creando un código de histonas que reprime o activa la expresión génica, y tales epimutaciones de histonas pueden ser factores epigenéticos importantes en el cáncer. Además, la epimutación carcinogénica puede ocurrir a través de alteraciones de la arquitectura cromosómica causadas por proteínas como HMGA2 . Otra fuente de epimutación se debe al aumento o disminución de la expresión de microARN (miARN). Por ejemplo, la expresión adicional de miR-137 puede causar una regulación negativa de la expresión de 491 genes, y miR-137 se silencia epigenéticamente en el 32% de los cánceres colorrectales>
Células madre cancerosas
Una nueva forma de ver la carcinogénesis proviene de la integración de las ideas de la biología del desarrollo en la oncología . La hipótesis de las células madre cancerosas propone que los diferentes tipos de células en un tumor heterogéneo surgen de una sola célula, denominada Célula Madre Cáncer. Las células madre cancerosas pueden surgir de la transformación de células madre adultas o células diferenciadas dentro de un cuerpo. Estas células persisten como un subcomponente del tumor y conservan las propiedades clave de las células madre. Dan lugar a una variedad de células, son capaces de autorrenovación y control homeostático . Además, la recaída del cáncer y la aparición de metástasis también se atribuyen a estas células. La hipótesis de las células madre cancerosas no contradice los conceptos anteriores de carcinogénesis. La hipótesis de las células madre cancerosas ha sido un mecanismo propuesto que contribuye a la heterogeneidad tumoral .
Evolución clonal
Si bien las alteraciones genéticas y epigenéticas en los genes supresores de tumores y los oncogenes cambian el comportamiento de las células, esas alteraciones, al final, resultan en cáncer a través de sus efectos sobre la población de células neoplásicas y su microambiente. Las células mutantes en las neoplasias compiten por espacio y recursos. Por tanto, un clon con una mutación en un gen supresor de tumores u oncogén se expandirá sólo en un neoplasma si esa mutación le da al clon una ventaja competitiva sobre los otros clones y células normales en su microambiente. Así, el proceso de carcinogénesis es formalmente un proceso de evolución darwiniana , conocido como evolución somática o clonal . Además, a la luz de los mecanismos darwinistas de la carcinogénesis, se ha teorizado que las diversas formas de cáncer pueden clasificarse en puberales y gerontológicas. Actualmente se están llevando a cabo investigaciones antropológicas sobre el cáncer como un proceso evolutivo natural a través del cual la selección natural destruye fenotipos ambientalmente inferiores mientras apoya a otros. Según esta teoría, el cáncer se presenta en dos tipos separados: desde el nacimiento hasta el final de la pubertad (aproximadamente a los 20 años) con inclinación teleológica hacia las dinámicas de grupo de apoyo, y desde la mediana edad hasta la muerte (aproximadamente a los 40 años o más) con inclinación teleológica a alejarse del grupo superpoblado. dinámica.
Ver también
Referencias
Otras lecturas
- Tokar EJ, Benbrahim-Tallaa L, Waalkes MP (2011). "Capítulo 14. Iones metálicos en el desarrollo del cáncer humano". En Astrid Sigel, Helmut Sigel y Roland KO Sigel (ed.). Iones metálicos en toxicología: efectos, interacciones, interdependencias . Iones metálicos en ciencias de la vida. 8 . Publicaciones RSC. págs. 375–401. doi : 10.1039 / 9781849732116-00375 . ISBN 978-1-84973-091-4.
- Dixon K, Kopras E (diciembre de 2004). "Alteraciones genéticas y reparación del ADN en la carcinogénesis humana". Seminarios de Biología del Cáncer . 14 (6): 441–8. doi : 10.1016 / j.semcancer.2004.06.007 . PMID 15489137 .
- Kleinsmith LJ (2006). Principios de la biología del cáncer . San Francisco: Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- Sarasin A (noviembre de 2003). "Una descripción general de los mecanismos de mutagénesis y carcinogénesis". Investigación de mutaciones . 544 (2-3): 99-106. doi : 10.1016 / j.mrrev.2003.06.024 . PMID 14644312 .
- Schottenfeld D, Beebe-Dimmer JL (2005). "Avances en la epidemiología del cáncer: comprensión de los mecanismos causales y la evidencia para implementar intervenciones" . Revisión anual de salud pública . 26 : 37–60. doi : 10.1146 / annurev.publhealth.26.021304.144402 . PMID 15760280 .
- Tannock I, Hill R, Bristow R, Harrington L (2005). La ciencia básica de la oncología (4ª ed.). Nueva York: McGraw-Hill. ISBN 978-0-07-138774-3.
- Wicha MS, Liu S, Dontu G (febrero de 2006). "Células madre cancerosas: una vieja idea - un cambio de paradigma" . Investigación del cáncer . 66 (4): 1883–90, discusión 1895–6. doi : 10.1158 / 0008-5472.CAN-05-3153 . PMID 16488983 .


