Ecuación de Van der Waals - Van der Waals equation
En química y termodinámica , la ecuación de Van der Waals (o ecuación de estado de Van der Waals ; lleva el nombre del físico holandés Johannes Diderik van der Waals ) es una ecuación de estado que generaliza la ley de los gases ideales basándose en razones plausibles por las que los gases reales no actúan. idealmente . La ley de los gases ideales trata a las moléculas de gas como partículas puntuales que interactúan con sus contenedores pero no entre sí, lo que significa que no ocupan espacio ni cambian la energía cinética durante las colisiones (es decir, todas las colisiones son perfectamente elásticas ). La ley de los gases ideales establece que el volumen ( V ) ocupado por n moles de cualquier gas tiene una presión ( P ) a temperatura ( T ) en kelvin dada por la siguiente relación, donde R es la constante del gas :
Para tener en cuenta el volumen que ocupa una molécula de gas real, la ecuación de Van der Waals reemplaza V en la ley de los gases ideales por , donde V m es el volumen molar del gas y b es el volumen que ocupa un mol de la moléculas. Esto lleva a:
La segunda modificación realizada a la ley de los gases ideales explica el hecho de que las moléculas de gas interactúan entre sí (suelen experimentar atracción a bajas presiones y repulsión a altas presiones) y que los gases reales muestran, por tanto, una compresibilidad diferente a la de los gases ideales. Van der Waals proporcionó la interacción intermolecular agregando a la presión observada P en la ecuación de estado un término , donde a es una constante cuyo valor depende del gas. Por tanto, la ecuación de Van der Waals se escribe como:
y, para n moles de gas, también se puede escribir como la siguiente ecuación:
donde V m es el volumen molar del gas, R es la constante universal del gas, T es la temperatura, P es la presión y V es el volumen. Cuando el volumen molar V m es grande, b se vuelve insignificante en comparación con V m , a / V m 2 se vuelve insignificante con respecto a P , y la ecuación de Van der Waals se reduce a la ley de los gases ideales, PV m = RT .
Está disponible mediante su derivación tradicional (una ecuación de estado mecánica), o mediante una derivación basada en termodinámica estadística , la última de las cuales proporciona la función de partición del sistema y permite especificar funciones termodinámicas. Se aproxima con éxito al comportamiento de los fluidos reales por encima de sus temperaturas críticas y es cualitativamente razonable para sus estados líquido y gaseoso de baja presión a bajas temperaturas. Sin embargo, cerca de las transiciones de fase entre gas y líquido, en el rango de p , V y T donde la fase líquida y la fase gaseosa están en equilibrio , la ecuación de Van der Waals no logra modelar con precisión el comportamiento experimental observado, en particular que p es una función constante de V a temperaturas dadas. Como tal, el modelo de Van der Waals no es útil solo para cálculos destinados a predecir el comportamiento real en regiones cercanas al punto crítico . Desde entonces, se han realizado correcciones para abordar estas deficiencias predictivas, como la regla de áreas iguales o el principio de los estados correspondientes .
Resumen e historia
La ecuación de Van der Waals es una ecuación termodinámica de estado basada en la teoría de que los fluidos están compuestos de partículas con volúmenes distintos de cero y sujetos a una fuerza de atracción entre partículas (no necesariamente por pares) . Se basó en un trabajo de química física teórica realizado a finales del siglo XIX por Johannes Diderik van der Waals , quien realizó un trabajo relacionado sobre la fuerza atractiva que también lleva su nombre. Se sabe que la ecuación se basa en un conjunto tradicional de derivaciones derivadas de los esfuerzos de Van der Waals y otros relacionados, así como en un conjunto de derivaciones basadas en termodinámica estadística , ver más abajo.
Los primeros intereses de Van der Waals estaban principalmente en el campo de la termodinámica , donde una primera influencia fue el trabajo publicado por Rudolf Clausius sobre el calor en 1857; otras influencias significativas fueron los escritos de James Clerk Maxwell , Ludwig Boltzmann y Willard Gibbs . Después de la búsqueda inicial de credenciales de enseñanza, los cursos de pregrado de Van der Waals en matemáticas y física en la Universidad de Leiden en los Países Bajos lo llevaron (con importantes obstáculos) a su aceptación para estudios de doctorado en Leiden con Pieter Rijke . Si bien su disertación ayuda a explicar la observación experimental realizada en 1869 por el profesor irlandés de química Thomas Andrews ( Queen's University Belfast ) de la existencia de un punto crítico en los fluidos, el historiador de la ciencia Martin J. Klein afirma que no está claro si Van der Waals fue consciente de los resultados de Andrews cuando comenzó su trabajo de doctorado. La investigación doctoral de Van der Waals culminó en una disertación de 1873 que proporcionó una teoría semicuantitativa que describe el cambio de estado gas-líquido y el origen de una temperatura crítica, Over de Continuïteit van den Gas-en Vloeistof [-] toestand (holandés; en inglés, Sobre la continuidad del estado gaseoso y líquido ); Fue en esta disertación donde aparecieron las primeras derivaciones de lo que ahora llamamos la ecuación de Van der Waals . James Clerk Maxwell revisó y elogió su contenido publicado en la revista científica británica Nature , y Van der Waals comenzó un trabajo independiente que resultaría en la recepción del Premio Nobel en 1910, que enfatizó la contribución de su formulación de esta "ecuación de estado para gases y líquidos ".
Ecuación

La ecuación relaciona cuatro variables de estado: la presión del fluido p , el volumen total del contenedor del líquido V , el número de partículas N , y la temperatura absoluta del sistema T .
La forma microscópica intensiva de la ecuación es:
dónde
es el volumen del contenedor ocupado por cada partícula (no la velocidad de una partícula), y k B es la constante de Boltzmann . Introduce dos nuevos parámetros: a ′, una medida de la atracción promedio entre partículas, y b ′, el volumen excluido de v por una partícula.
La ecuación también se puede escribir en forma extensa y molar:
dónde
es una medida de la atracción media entre partículas,
es el volumen excluido por un mol de partículas,
es el número de lunares,
es la constante universal de los gases , k B es la constante de Boltzmann y N A es la constante de Avogadro .
Debe trazarse una cuidadosa distinción entre el volumen disponible para una partícula y el volumen de una partícula. En la ecuación intensiva, v es igual al espacio total disponible para cada partícula, mientras que el parámetro b ′ es proporcional al volumen adecuado de una sola partícula, el volumen limitado por el radio atómico . Esto se resta de v debido al espacio ocupado por una partícula. En la derivación original de Van der Waals, dada a continuación, b ' es cuatro veces el volumen adecuado de la partícula. Observe además que la presión p llega al infinito cuando el recipiente está completamente lleno de partículas, de modo que no queda espacio vacío para que las partículas se muevan; esto ocurre cuando V = nb .
Mezcla de gas
Si se está considerando una mezcla de gases, y cada gas tiene sus propios valores (atracción entre moléculas) y (volumen ocupado por moléculas), entonces y para la mezcla se puede calcular como
- = número total de moles de gas presentes,
- para cada , = número de moles de gas presentes, y
y la regla de sumar presiones parciales se vuelve inválida si el resultado numérico de la ecuación es significativamente diferente de la ecuación del gas ideal .
Forma reducida
La ecuación de Van der Waals también se puede expresar en términos de propiedades reducidas :
Esto produce un factor de compresibilidad crítico de 3/8. Razones para modificar la ecuación del gas ideal: El estado de la ecuación para el gas ideal es PV = RT. En la derivación de las leyes de los gases ideales sobre la base de la teoría cinética de los gases se han hecho algunas suposiciones.
Validez
La ecuación de Van der Waals es matemáticamente simple, pero sin embargo predice la transición observada experimentalmente entre vapor y líquido y predice el comportamiento crítico . También predice y explica adecuadamente el efecto Joule-Thomson (cambio de temperatura durante la expansión adiabática), que no es posible en un gas ideal.
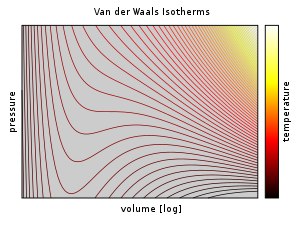
Por encima de la temperatura crítica , T C , la ecuación de Van der Waals es una mejora con respecto a la ley de los gases ideales, y para temperaturas más bajas, es decir, T < T C , la ecuación también es cualitativamente razonable para los estados líquido y gaseoso de baja presión; Sin embargo, con respecto a la transición de fase de primer orden, es decir, el rango de ( p, V, T ) donde una fase líquida y una fase gaseosa estarían en equilibrio, la ecuación parece no predecir el comportamiento experimental observado, en el sentido que típicamente se observa que p es constante en función de V para una temperatura dada en la región de dos fases. Esta aparente discrepancia se resuelve en el contexto del equilibrio vapor-líquido: a una temperatura particular, existen dos puntos en la isoterma de Van der Waals que tienen el mismo potencial químico y, por lo tanto, un sistema en equilibrio termodinámico parecerá atravesar una línea recta. en el diagrama p - V a medida que cambia la relación de vapor a líquido. Sin embargo, en tal sistema, en realidad solo hay dos puntos presentes (el líquido y el vapor) en lugar de una serie de estados conectados por una línea, por lo que conectar el lugar geométrico de los puntos es incorrecto: no es una ecuación de estados múltiples, sino una ecuación de (un solo) estado. De hecho, es posible comprimir un gas más allá del punto en el que normalmente se condensaría, dadas las condiciones adecuadas, y también es posible expandir un líquido más allá del punto en el que normalmente herviría. Estos estados se denominan estados "metaestables". Tal comportamiento se predice cualitativamente (aunque quizás no cuantitativamente) por la ecuación de estado de Van der Waals.
Sin embargo, los valores de las cantidades físicas como se predice con la ecuación de estado de Van der Waals "no concuerdan muy bien con el experimento", por lo que la utilidad del modelo se limita a propósitos cualitativos más que cuantitativos. Las correcciones de base empírica se pueden insertar fácilmente en el modelo de Van der Waals (ver la corrección de Maxwell , más adelante), pero al hacerlo, la expresión modificada ya no es un modelo analítico tan simple; en este sentido, otros modelos, como los basados en el principio de estados correspondientes , logran un mejor ajuste con aproximadamente el mismo trabajo. Incluso con sus deficiencias reconocidas, el uso generalizado de la ecuación de Van der Waals en los libros de texto universitarios estándar de química física deja en claro su importancia como herramienta pedagógica para ayudar a comprender las ideas fundamentales de la química física involucradas en el desarrollo de teorías de comportamiento vapor-líquido y ecuaciones de estado. Además, otros (más precisa) ecuaciones de estado tales como el Redlich-Kwong y Peng-Robinson ecuación de estado son esencialmente modificaciones de la Van der Waals ecuación de estado.
Derivación
Los libros de texto de química física generalmente dan dos derivaciones de la ecuación del título. Uno es la derivación convencional que se remonta a Van der Waals, una ecuación de estado mecánica que no puede usarse para especificar todas las funciones termodinámicas; la otra es una derivación de la mecánica estadística que hace explícito el potencial intermolecular desatendido en la primera derivación. Una ventaja particular de la derivación mecánica estadística es que produce la función de partición del sistema y permite especificar todas las funciones termodinámicas (incluida la ecuación de estado mecánica).
Derivación convencional
Considere un mol de gas compuesto de partículas puntuales que no interactúan y que satisfacen la ley de los gases ideales: (ver cualquier texto estándar de Química Física, op. Cit.)
A continuación, suponga que todas las partículas son esferas duras del mismo radio finito r (el radio de Van der Waals ). El efecto del volumen finito de las partículas es disminuir el espacio vacío disponible en el que las partículas pueden moverse libremente. Debemos reemplazar V por V - b , donde b se llama volumen excluido (por mol) o "co-volumen". La ecuación corregida se convierte en
El volumen excluido no solo es igual al volumen ocupado por las partículas sólidas de tamaño finito, sino que en realidad es cuatro veces el volumen molecular total para un mol de gas de Van der waals. Para ver esto, debemos darnos cuenta de que una partícula está rodeada por una esfera de radio 2 r (dos veces el radio original) que está prohibida para los centros de las otras partículas. Si la distancia entre dos centros de partículas fuera menor que 2 r , significaría que las dos partículas se penetran entre sí, lo que, por definición, las esferas duras no pueden hacer.
El volumen excluido para las dos partículas (de diámetro medio do radio r ) es
- ,
que, dividido por dos (el número de partículas en colisión), da el volumen excluido por partícula:
- ,
Entonces b ′ es cuatro veces el volumen apropiado de la partícula. A Van der Waals le preocupaba que el factor cuatro arrojara un límite superior; Los valores empíricos de b ′ suelen ser más bajos. Por supuesto, las moléculas no son infinitamente duras, como pensaba Van der Waals, y a menudo son bastante blandas. Para obtener el volumen excluido por mol solo necesitamos multiplicar por el número de moléculas en un mol, es decir, por el número de avogadro:
- .
A continuación, introducimos una fuerza de atracción (no necesariamente por pares) entre las partículas. Van der Waals asumió que, a pesar de la existencia de esta fuerza, la densidad del fluido es homogénea; además, supuso que el rango de la fuerza de atracción es tan pequeño que la gran mayoría de las partículas no sienten que el recipiente sea de tamaño finito. Dada la homogeneidad del fluido, la mayor parte de las partículas no experimentan una fuerza neta que las empuje hacia la derecha o hacia la izquierda. Esto es diferente para las partículas en las capas superficiales directamente adyacentes a las paredes. Sienten una fuerza neta de las partículas a granel que las empujan hacia el contenedor, porque esta fuerza no es compensada por partículas en el lado donde está la pared (otra suposición aquí es que no hay interacción entre las paredes y las partículas, lo cual no es cierto, como se puede ver en el fenómeno de la formación de gotas; la mayoría de los tipos de líquidos muestran adherencia). Esta fuerza neta disminuye la fuerza ejercida sobre la pared por las partículas en la capa superficial. La fuerza neta sobre una partícula de la superficie, que la empuja hacia el contenedor, es proporcional a la densidad numérica. Al considerar un mol de gas, el número de partículas será N A
- .
El número de partículas en las capas superficiales es, nuevamente asumiendo homogeneidad, también proporcional a la densidad. En total, la fuerza sobre las paredes se reduce en un factor proporcional al cuadrado de la densidad, y la presión (fuerza por unidad de superficie) se reduce en
- ,
así que eso
Al escribir n para el número de moles y nV m = V , la ecuación obtiene la segunda forma dada anteriormente,
Es de cierto interés histórico señalar que Van der Waals, en su conferencia del premio Nobel, dio crédito a Laplace por el argumento de que la presión se reduce proporcionalmente al cuadrado de la densidad.
Derivación de termodinámica estadística
La función de partición canónica Z de un gas ideal que consta de N = nN A partículas idénticas (que no interactúan ), es:
donde es la térmica de longitud de onda de Broglie ,
con las definiciones habituales: h es la constante de Planck , m la masa de una partícula, k la constante de Boltzmann y T la temperatura absoluta. En un gas ideal z es la función de partición de una sola partícula en un recipiente de volumen V . Para derivar la ecuación de Van der Waals asumimos ahora que cada partícula se mueve independientemente en un campo potencial promedio ofrecido por las otras partículas. El promedio de las partículas es fácil porque asumiremos que la densidad de partículas del fluido de Van der Waals es homogénea. La interacción entre un par de partículas, que son esferas duras, se toma como
r es la distancia entre los centros de las esferas yd es la distancia donde las esferas duras se tocan entre sí (el doble del radio de Van der Waals). La profundidad del pozo Van der Waals es .
Debido a que las partículas no están acopladas bajo el campo medio hamiltoniano, la aproximación del campo medio de la función de partición total todavía se factoriza,
- ,
pero el potencial intermolecular necesita dos modificaciones a z . Primero, debido al tamaño finito de las partículas, no todo V está disponible, sino solo V - Nb ' , donde (al igual que en la derivación convencional anterior)
- .
En segundo lugar, insertamos un factor de Boltzmann exp [ - ϕ / 2kT ] para cuidar el potencial intermolecular promedio. Dividimos aquí el potencial por dos porque esta energía de interacción se comparte entre dos partículas. Por lo tanto
La atracción total que siente una sola partícula es
donde asumimos que en una capa de espesor d r hay N / V 4 π r 2 dr partículas. Ésta es una aproximación de campo medio; se promedia la posición de las partículas. En realidad, la densidad cerca de la partícula es diferente a la lejana, como puede describirse mediante una función de correlación de pares. Además, se descuida que el fluido esté encerrado entre las paredes. Realizando la integral obtenemos
Por lo tanto, obtenemos,
De la termodinámica estadística sabemos que
- ,
de modo que solo tenemos que diferenciar los términos que contienen V. Obtenemos
Regla de área igual de Maxwell

Por debajo de la temperatura crítica, la ecuación de Van der Waals parece predecir relaciones cualitativamente incorrectas. A diferencia de los gases ideales, las isotermas pV oscilan con un mínimo relativo ( d ) y un máximo relativo ( e ). Cualquier presión entre p d y p e parece tener 3 volúmenes estables, lo que contradice la observación experimental de que dos variables de estado determinan completamente el estado de un sistema de un componente. Por otra parte, la isotérmica compresibilidad es negativa entre d y e (equivalente ), que no se puede describir un sistema en equilibrio.
Para hacer frente a estos problemas, James Clerk Maxwell sustituye la isoterma de entre los puntos de una y c con una línea horizontal colocado de manera que las áreas de las dos regiones sombreadas serían iguales (en sustitución de la una - d - ser - c curva con una línea recta de a a c ); esta porción de la isoterma corresponde al equilibrio líquido-vapor. Las regiones de la isoterma de a - d y de c - e se interpretan como estados metaestables de líquido sobrecalentado y vapor sobreenfriado, respectivamente. La regla de igual área se puede expresar como:
donde p V es la presión de vapor (parte plana de la curva), V L es el volumen de la fase líquida pura a punto una en el diagrama, y V G es el volumen de la fase de gas puro en el punto c en el diagrama. Una mezcla de dos fases en p V ocupará un volumen total entre V L y V G , según lo determinado por la regla de palanca de Maxwell .
Maxwell justificó la regla basándose en el hecho de que el área en un diagrama pV corresponde al trabajo mecánico, diciendo que el trabajo realizado en el sistema al pasar de c a b debe ser igual al trabajo liberado al pasar de a a b . Esto se debe a que el cambio en la energía libre A ( T , V ) es igual al trabajo realizado durante un proceso reversible y, como variable de estado , la energía libre debe ser independiente de la trayectoria. En particular, el valor de A en el punto b debe ser el mismo independientemente de si el camino tomado es de izquierda o derecha a través de la isobara horizontal, o sigue la isoterma original de Van der Waals.
Esta derivación no es del todo rigurosa, ya que requiere una trayectoria reversible a través de una región de inestabilidad termodinámica, mientras que b es inestable. Sin embargo, las derivaciones modernas del potencial químico llegan a la misma conclusión, y sigue siendo una modificación necesaria de Van der Waals y de cualquier otra ecuación analítica de estado.
Del potencial químico
La regla de áreas iguales de Maxwell también se puede derivar de la suposición de un potencial químico igual μ de las fases líquida y de vapor coexistentes. En la isoterma se muestra en el gráfico de arriba, señala un y c son el único par de puntos que cumplen la condición de equilibrio de tener la misma presión, la temperatura y el potencial químico. De ello se deduce que los sistemas con volúmenes intermedios entre estos dos puntos consistirán en una mezcla de gas líquido y puro con volúmenes específico igual a las fases líquida y de gas puro en los puntos de una y c .
La ecuación de Van der Waals se puede resolver para V G y V L como funciones de la temperatura y la presión de vapor p V . Desde:
donde A es la energía libre de Helmholtz, se deduce que la regla de áreas iguales se puede expresar como:
- es
Dado que los volúmenes de gas y líquido son funciones de p V y T solamente, esta ecuación se resuelve numéricamente para obtener p V en función de la temperatura (y el número de partículas N ), que luego se puede usar para determinar los volúmenes de gas y líquido. .
En la figura adjunta se muestra un gráfico pseudo-3D del lugar de los volúmenes de líquido y vapor frente a la temperatura y la presión. Se ve que los dos locii se encuentran en el punto crítico (1,1,1) sin problemas. También se muestra una isoterma del fluido de Van der Waals tomada en T r = 0.90 donde las intersecciones de la isoterma con los loci ilustran el requisito de la construcción de que las dos áreas (roja y azul, mostradas) sean iguales.
Otros parámetros, formas y aplicaciones
Otros parámetros termodinámicos
Reiteramos que el volumen extenso V está relacionado con el volumen por partícula v = V / N donde N = nN A es el número de partículas en el sistema. La ecuación de estado no nos da todos los parámetros termodinámicos del sistema. Podemos tomar la ecuación para la energía de Helmholtz A
De la ecuación derivada arriba para ln Q , encontramos
Donde Φ es una constante indeterminada, que se puede tomar de la ecuación de Sackur-Tetrode para que un gas ideal sea:
Esta ecuación expresa A en términos de sus variables naturales V y T , y por lo tanto nos da toda la información termodinámica sobre el sistema. La ecuación mecánica de estado ya se derivó anteriormente.
La ecuación de estado de entropía produce la entropía ( S )
a partir del cual podemos calcular la energía interna
Se pueden escribir ecuaciones similares para el otro potencial termodinámico y el potencial químico, pero expresar cualquier potencial en función de la presión p requerirá la solución de un polinomio de tercer orden, lo que produce una expresión complicada. Por tanto, será complicado expresar la entalpía y la energía de Gibbs como funciones de sus variables naturales.
Forma reducida
Aunque la constante del material una y b en la forma habitual de las de Van der Waals difiere ecuación para cada fluido individual considerado, la ecuación se puede refundirse en una forma invariante aplicable a todos los fluidos.
Definiendo las siguientes variables reducidas ( f R , f C son las versiones de variable reducida y crítica de f , respectivamente),
- ,
dónde
como lo muestra Salzman.
La primera forma de la ecuación de estado de Van der Waals dada anteriormente puede reformularse en la siguiente forma reducida:
- )
Esta ecuación es invariante para todos los fluidos; es decir, la misma forma de ecuación reducida de estado se aplica, no importa lo que una y b pueden ser para el fluido particular.
Esta invariancia también puede entenderse en términos del principio de estados correspondientes. Si dos fluidos tienen la misma presión reducida, volumen reducido y temperatura reducida, decimos que sus estados son correspondientes. Los estados de dos fluidos pueden corresponder incluso si su presión, volumen y temperatura medidos son muy diferentes. Si los estados de los dos fluidos son correspondientes, existen en el mismo régimen de la ecuación de estado de forma reducida. Por lo tanto, responderán a los cambios aproximadamente de la misma manera, aunque sus características físicas mensurables puedan diferir significativamente.
Ecuación cúbica
La ecuación de Van der Waals es una ecuación de estado cúbica ; en la formulación reducida la ecuación cúbica es:
A la temperatura crítica, donde obtenemos como se esperaba
Para T R <1, hay 3 valores para v R . Para T R > 1, existe un valor real para 1 v R .
La solución de esta ecuación para el caso donde hay tres raíces separadas se puede encontrar en la construcción de Maxwell.
Aplicación a fluidos compresibles
La ecuación también se puede utilizar como una ecuación PVT para fluidos compresibles (por ejemplo, polímeros ). En este caso, los cambios de volumen específicos son pequeños y se pueden escribir de forma simplificada:
donde p es la presión , V es el volumen específico , T es la temperatura y A, B, C son los parámetros.
Ver también
- Leyes de los gases
- Gas ideal
- Temperatura de inversión
- Iteración
- Construcción Maxwell
- Gas real
- Teorema de los estados correspondientes
- Constantes de Van der Waals (página de datos)
- Ecuación de estado de Redlich-Kwong
Referencias
Otras lecturas
- Chandler, David (1987). Introducción a la mecánica estadística moderna . Oxford: Prensa de la Universidad de Oxford. págs. 287–295. ISBN 0195042778 .
- Cross, Michael (2004), "Conferencia 3: Transiciones de fase de primer orden" (PDF) , Física 127: Física estadística, segundo período , Pasadena, California: División de Física, Matemáticas y Astronomía, Instituto de Tecnología de California .
- Dalgarno, A .; Davison, WD (1966). "El cálculo de las interacciones de Van Der Waals". Avances en Física Atómica y Molecular . 2 : 1–32. doi : 10.1016 / S0065-2199 (08) 60216-X . ISBN 9780120038022 .
- Kittel, Charles; Kroemer, Herbert (1980). Física Térmica (Ed. Revisada). Nueva York: Macmillan. págs. 287–295. ISBN 0716710889 .























































![A (T, V, N) = - NkT \ left [1+ \ ln \ left ({\ frac {(V-Nb ') T ^ {3/2}} {N \ Phi}} \ right) \ right ] - {\ frac {a'N ^ {2}} {V}}.](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee0772e1591ec074c94d8ec125ac5fc2b927d375)


![{\ Displaystyle S = - \ izquierda ({\ frac {\ parcial A} {\ parcial T}} \ derecha) _ {N, V} = Nk \ izquierda [\ ln \ izquierda ({\ frac {(V-Nb ') T ^ {3/2}} {N \ Phi}} \ right) + {\ frac {5} {2}} \ right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d26d016c00d464ed8d30641b9c650e5a61cbc404)







