Transglutaminasa tisular - Tissue transglutaminase
| Proteína-glutamina gamma-glutamiltransferasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| CE no. | 2.3.2.13 | ||||||||
| No CAS. | 80146-85-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontología de genes | AmiGO / QuickGO | ||||||||
| |||||||||
La transglutaminasa tisular (abreviada como tTG o TG2 ) es una enzima dependiente de calcio de 78 kDa ( EC 2.3.2.13 ) de la familia de las proteínas-glutamina γ-glutamiltransferasas (o simplemente de la familia de las transglutaminasas ). Como otras transglutaminasas, reticula proteínas entre un grupo ε- amino de un residuo de lisina y un grupo γ- carboxamida de residuo de glutamina , creando un enlace inter o intramolecular que es altamente resistente a la proteólisis (degradación de proteínas). Aparte de su función de reticulación, tTG cataliza otros tipos de reacciones que incluyen actividades de desamidación , unión / hidrolización de GTP e isopeptidasa. A diferencia de otros miembros de la familia de las transglutaminasas, la tTG se puede encontrar tanto en el espacio intracelular como en el extracelular de varios tipos de tejidos y se encuentra en muchos órganos diferentes, incluidos el corazón, el hígado y el intestino delgado. La tTG intracelular es abundante en el citosol, pero también se pueden encontrar cantidades más pequeñas en el núcleo y las mitocondrias . Se cree que la tTG intracelular juega un papel importante en la apoptosis . En el espacio extracelular, la tTG se une a las proteínas de la matriz extracelular (MEC) y se une de manera particularmente estrecha a la fibronectina . La tTG extracelular se ha relacionado con la adhesión celular, la estabilización de la ECM, la cicatrización de heridas, la señalización del receptor, la proliferación celular y la motilidad celular.
El tTG es el autoantígeno en la enfermedad celíaca , una enfermedad de por vida en la que el consumo de gluten en la dieta provoca una respuesta inmunitaria patológica que provoca la inflamación del intestino delgado y la posterior atrofia de las vellosidades. También se ha implicado en la fisiopatología de muchas otras enfermedades, que incluyen muchos cánceres diferentes y enfermedades neurogenerativas.
Estructura
Gene
El gen tTG humano se encuentra en el cromosoma 20 (20q11.2-q12).
Proteína
TG2 es una enzima multifuncional que pertenece a las transglutaminasas que catalizan la reticulación de proteínas mediante enlaces isopéptidos epsilon- (gamma-glutamil) lisina. De manera similar a otras transglutaminasas, tTG consta de un sitio de unión de GTP / GDP, un dominio catalítico , dos barriles beta y un sándwich beta . Las estructuras cristalinas de TG2 con GDP , GTP o ATP unido han demostrado que estas formas de TG2 adoptan una conformación "cerrada", mientras que TG2 con el sitio activo ocupado por un péptido inhibidor del gluten mimético u otros inhibidores similares adopta una conformación "abierta". En la conformación abierta, los cuatro dominios de TG2 están dispuestos en una configuración extendida, lo que permite la actividad catalítica, mientras que en la conformación cerrada los dos dominios C-terminales se pliegan en el dominio del núcleo catalítico que incluye el residuo Cys-277. El dominio N-terminal solo muestra cambios estructurales menores entre las dos conformaciones diferentes.
Mecanismo
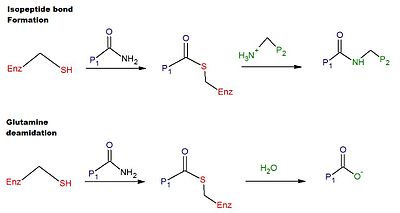
El mecanismo catalítico para la reticulación en tTG humana involucra al grupo tiol de un residuo Cys en el sitio activo de tTG. El grupo tiol ataca la carboxamida de un residuo de glutamina en la superficie de una proteína o sustrato peptídico, liberando amoníaco y produciendo un tioéster intermedio. A continuación, el tioéster intermedio puede ser atacado por la amina superficial de un segundo sustrato (típicamente de un residuo de lisina ). El producto final de la reacción es un enlace isopéptido estable entre los dos sustratos (es decir, reticulación). Alternativamente, el intermedio de tioéster puede hidrolizarse, dando como resultado la conversión neta del residuo de glutamina en ácido glutámico (es decir, desamidación). Se cree que la desamidación de los residuos de glutamina catalizada por tTG está relacionada con la respuesta inmunitaria patológica al gluten en la enfermedad celíaca. En la Figura 1 se proporciona un esquema de las reacciones de reticulación y desamidación.
Regulación
La expresión de tTG está regulada a nivel transcripcional dependiendo de cascadas de señales complejas . Una vez sintetizada, la mayor parte de la proteína se encuentra en el citoplasma, membrana plasmática y MEC, pero una pequeña fracción se transloca al núcleo , donde participa en el control de su propia expresión a través de la regulación de factores de transcripción .
La actividad de reticulación por tTG requiere la unión de iones Ca 2+ . Múltiples Ca 2+ pueden unirse a una sola molécula de tTG. Específicamente, tTG une hasta 6 iones de calcio en 5 sitios de unión diferentes. Las mutaciones en estos sitios de unión que causan una menor afinidad por el calcio, disminuyen la actividad transglutaminasa de la enzima. Por el contrario, la unión de una molécula de GTP o GDP inhibe la actividad de reticulación de la enzima. Por lo tanto, la tTG intracelular es mayoritariamente inactiva debido a la concentración relativamente alta de GTP / GDP y los bajos niveles de calcio dentro de la célula. Aunque se espera que la tTG extracelular sea activa debido a la baja concentración de nucleótidos de guanina y los altos niveles de calcio en el espacio extracelular, la evidencia ha demostrado que la tTG extracelular es mayoritariamente inactiva. Estudios recientes sugieren que la tTG extracelular se mantiene inactiva mediante la formación de un enlace disulfuro entre dos residuos de cisteína vecinales , a saber, Cys 370 y Cys 371. Cuando se forma este enlace disulfuro, la enzima permanece en una confirmación abierta pero se vuelve catalíticamente inactiva. La oxidación / reducción del enlace disulfuro sirve como un tercer mecanismo regulador alostérico (junto con GTP / GDP y Ca 2+ ) para la activación de tTG. Se ha demostrado que la tioredoxina -1 activa la tTG extracelular al reducir el enlace disulfuro. En tTG se puede formar otro enlace disupluro, entre los residuos Cys-230 y Cys-370. Si bien este enlace no existe en el estado nativo de la enzima, aparece cuando la enzima se inactiva por oxidación. La presencia de calcio protege contra la formación de ambos enlaces disulfuro, lo que hace que la enzima sea más resistente a la oxidación.
Estudios recientes han sugerido que el interferón-γ puede servir como activador de tTG extracelular en el intestino delgado; estos estudios tienen una implicación directa en la patogenia de la enfermedad celíaca. Se ha demostrado que la activación de tTG va acompañada de grandes cambios conformacionales, pasando de una conformación compacta (inactiva) a una extendida (activa). (ver figura 3)
En la matriz extracelular , TG2 se "apaga", debido principalmente a la actividad oxidante de la proteína 57 del retículo endoplásmico (ERp57). Por lo tanto, tTG está regulado alostéricamente por dos proteínas separadas, Erp57 y TRX-1. (Ver figura 4).
Función
La tTG se expresa de forma ubicua y está presente en varios compartimentos celulares, como el citosol, el núcleo y la membrana plasmática. Requiere calcio como cofactor para la actividad de transamidación. El ácido retinoico aumenta la transcripción . Entre sus muchas supuestas funciones, parece desempeñar un papel en la cicatrización de heridas , la apoptosis y el desarrollo de la matriz extracelular , así como en la diferenciación y adhesión celular . Se ha observado que la tTG puede tener una actividad muy diferente en diferentes tipos de células. Por ejemplo, en las neuronas , la tTG apoya la supervivencia de las células sometidas a lesión, mientras que en los astrocitos, la desactivación de la expresión génica de la tTG es beneficiosa para la supervivencia celular.
Se cree que la tTG participa en la regulación del citoesqueleto mediante la reticulación de varias proteínas del citoesqueleto, incluidas la miosina, la actina y la espectrina . La evidencia muestra que la tTG intracelular se reticula con la miosina. También se cree que la tTG puede estabilizar la estructura de las células moribundas durante la apoptosis al polimerizar los componentes del citoesqueleto, evitando así la fuga del contenido celular al espacio extracelular.
tTG también tiene actividad GTPasa : en presencia de GTP, sugirió funcionar como una proteína G que participa en los procesos de señalización. Además de su actividad transglutaminasa, se propone que tTG también actúe como quinasa y como proteína disulfuro isomerasa y desamidasa. Esta última actividad es importante en la desamidación de péptidos de gliadina, por lo que juega un papel importante en la patología de la enfermedad celíaca .
tTG también presenta actividad PDI (proteína disulfuro isomerasa). Basado en su actividad PDI, tTG juega un papel importante en la regulación de la proteostasis , al catalizar la trimerización de HSF1 (Factor de Choque de Calor 1) y por lo tanto la respuesta del cuerpo al choque de calor. En ausencia de tTG, la respuesta al choque térmico se ve afectada ya que no se forma el trímero necesario.
Significación clínica
La tTG es la transglutaminasa más estudiada y se ha asociado con muchas enfermedades. Sin embargo, ninguna de estas enfermedades está relacionada con una deficiencia enzimática. De hecho, hasta ahora no se ha atribuido ninguna enfermedad a la falta de actividad de tTG y esto se ha atestiguado mediante el estudio de ratones knockout para tTG.
Enfermedad celíaca
La tTG es mejor conocida por su vínculo con la enfermedad celíaca . Se asoció por primera vez con la enfermedad celíaca en 1997 cuando se descubrió que la enzima era el antígeno reconocido por los anticuerpos específicos contra la enfermedad celíaca. Los anticuerpos anti-transglutaminasa dan como resultado una forma de sensibilidad al gluten en la que una respuesta celular a los glúteos de Triticeae que se entrecruzan con tTG pueden estimular las respuestas de células B específicas de transglutaminasa que eventualmente resultan en la producción de anticuerpos anti-transglutaminasa IgA e IgG. La tTG desamida específicamente los residuos de glutamina creando epítopos que aumentan la afinidad de unión del péptido del gluten a las células T presentadoras de antígeno , iniciando una respuesta inmune adaptativa.
Cáncer
Estudios recientes sugieren que la tTG también juega un papel en la inflamación y la biología tumoral. La expresión de tTG está elevada en múltiples tipos de células cancerosas y está implicada en la resistencia a los fármacos y la metástasis debido a su capacidad para promover la transición mesenquimatosa y propiedades similares a las de las células madre. En su forma unida a GTP, tTG contribuye a la supervivencia de las células cancerosas y parece ser un impulsor del cáncer. La tTG está regulada al alza en las células y tejidos cancerosos en muchos tipos de cáncer, como leucemia , cáncer de mama , cáncer de próstata , cáncer de páncreas y cáncer de cuello uterino . Una expresión más alta de tTG también se correlaciona con casos más altos de metástasis , resistencia a la quimioterapia , tasas de supervivencia más bajas y un pronóstico generalmente desfavorable. Las células cancerosas pueden destruirse aumentando los niveles de calcio mediante la activación de la actividad de transamidación de tTG. Los ensayos preclínicos han demostrado ser prometedores en el uso de inhibidores de tTG como agentes terapéuticos contra el cáncer. Sin embargo, otros estudios han señalado que la actividad de transamidación de tTG podría estar relacionada con la inhibición de la invasividad de las células tumorales.
Otras enfermedades
Se cree que la tTG contribuye a varios trastornos neurodegenerativos que incluyen las enfermedades de Alzheimer , Parkinson y Huntington al afectar la transcripción, diferenciación y migración y adhesión. Estas enfermedades neurológicas se caracterizan en parte por la agregación anormal de proteínas debido al aumento de la actividad de entrecruzamiento de proteínas en el cerebro afectado. Además, se ha descubierto que las proteínas específicas asociadas con estos trastornos son sustratos in vivo e in vitro de tTG. Aunque la tTG está regulada al alza en las áreas del cerebro afectadas por la enfermedad de Huntington, un estudio reciente mostró que los niveles crecientes de tTG no afectan la aparición y / o progresión de la enfermedad en ratones. Estudios recientes muestran que la tTG puede no estar involucrada en la EA, ya que los estudios muestran que está asociada con la lisis de eritrocitos y es una consecuencia de la enfermedad más que una causa.
La tTG también se ha relacionado con la patogenia de la fibrosis en varios órganos, incluidos los pulmones y los riñones . Específicamente, en la fibrosis renal, tTG contribuye a la estabilización y acumulación de la ECM que afecta la actividad de TGF beta .
Diagnóstico
Serología para anti-tTG anticuerpos ha superado las pruebas serológicas mayores (anti-endomisio, anti-gliadina y anti-reticulina) y tiene una fuerte sensibilidad (99%) y especificidad (> 90%) para la identificación de la enfermedad celíaca. Los ensayos anti-tTG modernos se basan en una proteína recombinante humana como antígeno.
Terapéutico
Todavía es experimental usar tTG como una forma de pegamento quirúrgico. También se está estudiando como atenuador de metástasis en determinados tumores. shows tTG prometen como una diana terapéutica potencial para el tratamiento de fibrosis cardiaca , a través de la actividad de un tTG altamente selectivo inhibidor . También se ha demostrado que los inhibidores de tTG inhiben la formación de inclusiones tóxicas relacionadas con enfermedades neurodegenerativas . Esto indica que los inhibidores de tTG también podrían servir como una herramienta para mitigar la progresión de enfermedades relacionadas con el cerebro de tTG.
Interacciones
TG2 participa en interacciones enzimáticas y no enzimáticas . Se forman interacciones enzimáticas entre TG2 y sus proteínas de sustrato que contienen los grupos donante de glutamina y donante de lisina en presencia de calcio . Se sabe que los sustratos de TG2 afectan la actividad de TG2, lo que le permite ejecutar posteriormente diversas funciones biológicas en la célula. Sin embargo, aún no se ha revelado la importancia de las interacciones no enzimáticas en la regulación de las actividades de TG2. Estudios recientes indican que las interacciones no enzimáticas desempeñan funciones fisiológicas y permiten diversas funciones de TG2 de una manera específica del contexto.
| Alelos mutantes de ratón para Tgm2 | |
|---|---|
| Símbolo de marcador para el gen del ratón. Este símbolo es asignado al locus genómico por el MGI. | Tgm2 |
| Clones de células madre embrionarias de ratón mutante. Estas son las mutaciones dirigidas conocidas para este gen en un ratón. | Tgm2 tm1a (KOMP) Wtsi |
| Ejemplo de estructura de alelo mutante condicional dirigido para este gen | |
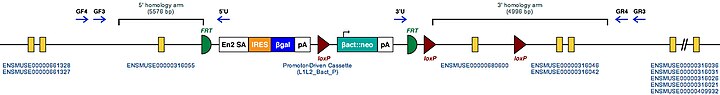
|
|
| Estas células ES mutantes pueden estudiarse directamente o usarse para generar ratones con este gen desactivado. El estudio de estos ratones puede arrojar luz sobre la función de Tgm2: ver Knockout mouse | |
Referencias
enlaces externos
- Anticuerpos endomisiales
- Se puede acceder a una colección de sustratos y socios de interacción de TG2 en TRANSDAB , una base de datos interactiva de sustratos de transglutaminasa.