Thujone - Thujone
|
|||
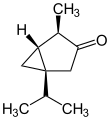
Modelo de bola y palo de (-) - α-tuyona
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombres IUPAC
α: (1 S , 4 R , 5 R ) -4-Metil-1- (propan-2-il) biciclo [3.1.0] hexan-3-ona
β: (1 S , 4 S , 5 R ) - 4-metil-1-propan-2-ilbiciclo [3.1.0] hexan-3-ona |
|||
| Otros nombres
Biciclo [3.1.0] hexan-3-ona, 4-metil-1- (1-metiletil) -, [1S- (1α, 4α, 5α)] -
α-Thujone β-Thujone Thujone, cis 3-Thujanone, (1S, 4R, 5R) - (-) - Thujon 3-Thujanone, (-) - l-Thujone; 4-metil-1- (1-metiletil) biciclo [3.1.0] hexan-3-ona-, (1S, 4R, 5R) -3-tuyona; cis-Thujone (Z) -Thujone (-) - Thujone; Biciclo (3.1.0) hexan-3-ona, 4-metil-1- (1-metiletil) -, (1S, 4R, 5R) - NSC 93742 1-isopropil-4-metilbiciclo [3.1.0] hexan-3 -uno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| 4660369 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.013.096 |
||
| Número CE | |||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 10 H 16 O | |||
| Masa molar | 152,237 g · mol −1 | ||
| Densidad | 0,92 g / cm ^ { 3} (\ beta - tuyona); 0,9116 g / cm 3 (α-tuyona) | ||
| Punto de fusion | <25 ° C | ||
| Punto de ebullición | 203 ° C (397 ° F; 476 K) (alfa, beta-tuyona) | ||
| 407 mg / L | |||
| Riesgos | |||
| Pictogramas GHS |

|
||
| Palabra de señal GHS | Advertencia | ||
| H302 | |||
| P264 , P270 , P301 + 312 , P330 , P501 | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
Thujone ( / θ U dʒ oʊ n / ( escuchar )![]() ) es una cetona y un monoterpeno que se produce predominantemente en dos diastereomérica ( epimérica ) formas: (-) - α-tuyona y (+) - β-tuyona .
) es una cetona y un monoterpeno que se produce predominantemente en dos diastereomérica ( epimérica ) formas: (-) - α-tuyona y (+) - β-tuyona .
Aunque es más conocido como un compuesto químico en la absenta , es poco probable que sea responsable de los supuestos efectos estimulantes y psicoactivos de la absenta debido a las pequeñas cantidades presentes. Thujone actúa sobre GABA como antagonista (opuesto a los efectos del alcohol). Como antagonista competitivo de GABA, la tuyona sola se considera convulsiva , aunque al interferir con el transmisor inhibidor GABA, puede transmitir efectos estimulantes que mejoran el estado de ánimo en dosis bajas. También se utiliza en perfumería como componente de varios aceites esenciales.
Además de la (-) - α-tuyona y (+) - β-tuyona de origen natural, son posibles otras dos formas: (+) - α-tuyona y (-) - β-tuyona . En 2016, también se encontraron en la naturaleza, en Salvia officinalis .
Fuentes
La tuyona se encuentra en varias plantas, como arborvitae (género Thuja , de ahí la derivación del nombre), ciprés Nootka , algunos enebros , artemisa , orégano , salvia común , tanaceto y ajenjo , sobre todo ajenjo grande ( Artemisia absinthium ) , generalmente como una mezcla de isómeros en una proporción de 1: 2. También se encuentra en varias especies de mentha (menta).
Biosíntesis
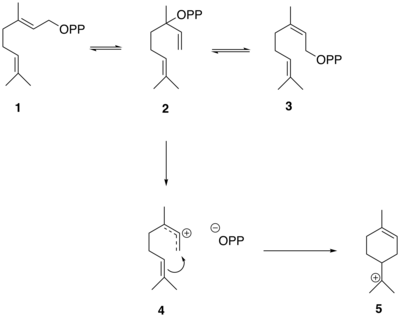
La biosíntesis de tuyona es similar a la síntesis de otros monoterpenos y comienza con la formación de difosfato de geranilo ( GPP ) a partir de pirofosfato de dimetilalilo ( DMAPP ) y difosfato de isopentenilo ( IPP ), catalizado por la enzima geranil difosfato sintasa. El análisis espectroscópico cuantitativo de 13 CNMR ha demostrado que las unidades de isopreno utilizadas para formar tuyona en plantas se derivan de la vía del metileritritol fosfato ( MEP ).
Las reacciones que generan el esqueleto de thujane en sabineno a partir de GPP están mediadas por la enzima sabineno sintasa que tiene GPP como sustrato. GPP ( 1 ) primero se isomeriza a linalil difosfato (LPP) ( 2 ) y neril difosfato (NPP) ( 3 ). LPP forma preferentemente un catión difosfato alílico deslocalizado ( 4 ). El intermedio de par iónico luego se cicla en una adición electrofílica para producir el catión terciario α-terpinilo ( 5 ).
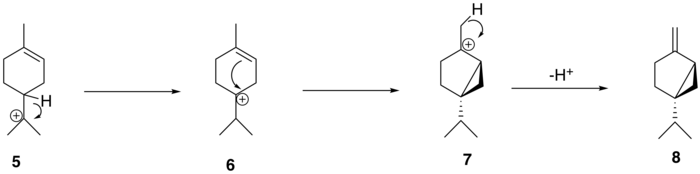
El catión α-terpinilo ( 5 ) luego sufre un cambio de hidruro 1,2 a través de un reordenamiento de Wagner-Meerwein , lo que lleva a la formación del catión terpinen-4-ilo ( 6 ). Este catión sufre una segunda ciclación para formar el catión tuyilo intermedio ( 7 ) antes de la pérdida de un protón para formar el precursor de tujona, (+) - sabineno ( 8 ).
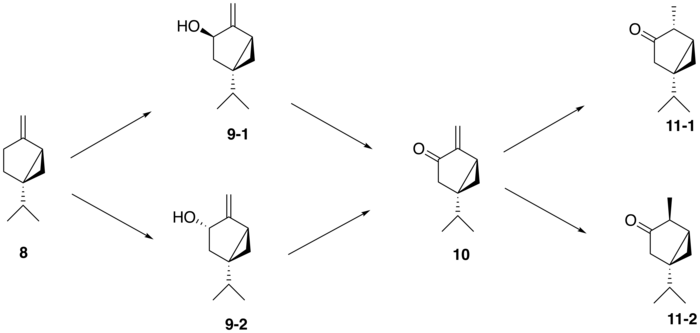
A partir de (+) - sabineno ( 8 ), la ruta biosintética propuesta para generar tuyona sigue una ruta de tres pasos: (+) - el sabineno se oxida primero a un isómero de (+) - sabinol ( 9-1,2 ) por un enzima citocromo P450 , seguida de conversión a (+) - sabinona ( 10 ) a través de una deshidrogenasa . Finalmente, una reductasa media la conversión a α-tuyona ( 11-1 ) y β-tuyona ( 11-2 ). La isomería del (+) - sabinol intermedio varía entre las plantas productoras de tuyona; por ejemplo, en el cedro rojo occidental ( Thuja plicata ), la tuyona se deriva exclusivamente del (+) - trans -sabinol intermedio ( 9-1 ) mientras que en la salvia común del jardín ( Salvia officinalis ), la tuyona se forma a partir del (+) - intermedio cis -sabinol ( 9-2 ).
Farmacología
Con base en estudios que solo observaron la forma molecular, durante muchos años se pensó que la tuyona actuaba de manera similar al THC en los receptores de cannabinoides ; sin embargo, desde entonces se ha demostrado que esto es falso. Thujone es una GABA A antagonista del receptor y, más específicamente, un GABA A receptor antagonista competitivo . Al inhibir la activación del receptor GABA, las neuronas pueden dispararse más fácilmente, lo que puede causar espasmos musculares y convulsiones. Esta interacción con el receptor GABA A es específica de la alfa-tuyona. La tuyona también es un antagonista de 5-HT 3 .
La dosis letal mediana , o LD 50 , de alfa-tuyona, el más activo de los dos isómeros, en ratones, es de alrededor de 45 mg / kg, con una tasa de mortalidad del 0% a 30 mg / kg y del 100% a 60 mg / kg. . Los ratones expuestos a la dosis más alta tienen convulsiones que conducen a la muerte en 1 minuto. De 30 a 45 mg / kg, los ratones experimentan espasmos musculares en las piernas, que progresan a convulsiones generales hasta la muerte o la recuperación. Estos efectos están en consonancia con otros antagonistas de GABA. Además, la alfa-tuyona se metaboliza rápidamente en el hígado de los ratones. El pretratamiento con moduladores alostéricos positivos para GABA como diazepam , fenobarbital o 1 g / kg de etanol protege contra una dosis letal de 100 mg / kg.
El rendimiento de la atención se ha probado con dosis bajas y altas de tuyona en alcohol. La dosis alta tuvo un efecto negativo a corto plazo sobre el rendimiento de la atención. La dosis más baja no mostró ningún efecto notable.
Se informa que la tuyona es tóxica para las células del cerebro, los riñones y el hígado y podría causar convulsiones si se usa en una dosis demasiado alta. Otras plantas que contienen tuyona, como la arborvitae ( Thuja occidentalis ), se utilizan en la medicina herbal, principalmente por sus efectos estimulantes del sistema inmunológico. Los efectos secundarios del aceite esencial de esta planta incluyen ansiedad, insomnio y convulsiones, lo que confirma los efectos de la tuyona en el sistema nervioso central.
En absenta
Thujone es más famoso por ser un compuesto en el espíritu de la absenta . En el pasado, se pensaba que la absenta contenía hasta 260-350 mg / l de tuyona, pero las pruebas modernas han demostrado que esta estimación es demasiado alta. Un estudio de 2008 de 13 botellas anteriores a la prohibición (1895-1910) mediante cromatografía de gases y espectrometría de masas ( GC-MS ) encontró que las botellas tenían entre 0,5 y 48,3 mg / ly un promedio de 25,4 mg / l. Un estudio de 2005 recreó tres 1899 de alto de ajenjo y probado con GC-MS, y se encontró que el más alto contenía 4,3 mg / l de tuyona. Las pruebas de GC-MS son importantes en esta capacidad, porque la cromatografía de gases por sí sola puede registrar una lectura alta inexacta de tuyona, ya que otros compuestos pueden interferir con la cantidad medida aparente y aumentarla.
Historia
El compuesto fue descubierto después de que la absenta se hiciera popular a mediados del siglo XIX. El Dr. Valentin Magnan , que estudió el alcoholismo, probó aceite de ajenjo puro en animales y descubrió que causaba convulsiones independientemente de los efectos del alcohol. En base a esto, se supuso que la absenta, que contiene una pequeña cantidad de aceite de ajenjo, era más peligrosa que el alcohol común. Finalmente, se aisló la tuyona como la causa de estas reacciones. Magnan pasó a estudiar a 250 abusadores de alcohol y notó que los que bebían absenta tenían convulsiones y alucinaciones . Las convulsiones son causadas por la (+) - α-tuyona que interactúa con los receptores GABA, provocando actividad epiléptica. A la luz de la evidencia moderna, estas conclusiones son cuestionables, ya que se basan en una comprensión deficiente de otros compuestos y enfermedades, y están empañadas por la creencia de Magnan de que el alcohol y la absenta estaban degenerando la raza francesa.
Después de que se prohibió la absenta, la investigación se interrumpió hasta la década de 1970, cuando la revista científica británica Nature publicó un artículo comparando la forma molecular de la tuyona con el tetrahidrocannabinol (THC), la principal sustancia psicoactiva que se encuentra en el cannabis , y planteó la hipótesis de que actuaría de la misma manera en el cerebro, provocando el mito de que la tuyona era un cannabinoide .
Más recientemente, siguiendo la Directiva del Consejo Europeo No. 88/388 / EEC (1988) que permite ciertos niveles de tuyona en los alimentos en la UE, los estudios descritos anteriormente se llevaron a cabo y encontraron solo niveles mínimos de tuyona en la absenta.
Normativas
unión Europea
Los niveles máximos de tuyona en la UE son:
- 0,5 mg / kg en alimentos preparados con especies de Artemisia , excluidos los preparados con salvia y bebidas no alcohólicas
- 10 mg / kg en bebidas alcohólicas no preparadas con especies de Artemisia
- 25 mg / kg en alimentos preparados con salvia
- 35 mg / kg en bebidas alcohólicas preparadas con especies de Artemisia
Estados Unidos
En los Estados Unidos, no se permite la adición de tuyona pura a los alimentos. Los alimentos o bebidas que contienen especies de Artemisia , cedro blanco , musgo de roble , tanaceto o milenrama , deben estar libres de tuyona, lo que en la práctica significa que contienen menos de 10 mg / l de tuyona. Otras hierbas que contienen tuyona no tienen restricciones. Por ejemplo, la salvia y el aceite de salvia (que puede contener hasta un 50% de tuyona) están en la lista de sustancias generalmente reconocidas como seguras (GRAS) de la Administración de Drogas y Alimentos .
La absenta que se ofrece a la venta en los Estados Unidos debe estar libre de tuyona según el mismo estándar que se aplica a otras bebidas que contienen Artemisia, por lo que la absenta con pequeñas cantidades de tuyona puede ser importada legalmente.
Canadá
En Canadá, las leyes sobre bebidas alcohólicas son dominio de los gobiernos provinciales. Alberta, Ontario y Nueva Escocia permiten 10 mg / kg de tuyona; Quebec permite 15 mg por kg; Manitoba permite 6-8 mg de tuyona por litro; Columbia Británica se adhiere a los mismos niveles que Ontario. Sin embargo, en Saskatchewan y Quebec, se puede comprar cualquier licor disponible en el mundo con la compra de un máximo de una caja, generalmente 12 botellas de 750 ml o 9 L. Las tablas de licor individuales deben aprobar cada producto antes de que pueda venderse en estantería.
Espectros químicos de α-tuyona
1 H RMN (500 MHz, CDCl 3 )
δ [ppm] = 2.54 (ddd, J = 18.8, 2.3, 1.1 Hz, 1H, H-2), 2.21 (q, J = 7.2 Hz, 1H, H-4), 2.07 (d, J = 18.8 Hz, 1H, H-2 '), 1,36 (hept, J = 6,8 Hz, 1H, H-7), 1,15 (d, J = 7,5 Hz, 3H, H-9), 1,08 (dd, J = 8,1, 4,0 Hz , 1H, H-5), 1,00 (d, J = 6,8 Hz, 3H, H-8), 0,95 (d, J = 6,8 Hz, 3H, H-8 ') 0,76 (ddd, J = 8,1, 5,6, 2,5 Hz, 1H, H-6), 0,12 (dd, J = 5,6, 4,1 Hz, 1H, H-6 ').
13 C RMN (91 MHz, CDCl 3 )
δ [ppm] = 221,7 (C = O, C-3), 47,5 (CH, C-4), 39,9 (CH2, C-2), 33,1 (CH, C-7), 29,8 (C, C-1 ), 25,7 (CH, C-5), 20,1 (CH3, C-8), 19,9 (CH3, C-8 ') 18,9 (CH3, C-9), 18,4 (CH2, C-6).
Espectrometría de masas
m / z: 81 (100), 110 (96,58), 109 (59,88), 95 (58,97), 67 (57,37). El sitio web www.webbook.nist.gov enumera las relaciones m / z para Thujone como: 110 (100), 81 (~ 89), 95 (~ 71); 67 (~ 69), 109 (~ 44).
IR
cm −1 : 3020, 2961, 1733, 1602, 1455, 1219, 1096, 1014.
Ver también
- Piołunówka : preparación alcohólica polaca con un contenido de tuyona superior al de la absenta
Referencias
Otras lecturas
- Lachenmeier DW, Nathan-Maister D, Breaux TA, Sohnius EM, Schoeberl K, Kuballa T (mayo de 2008). "Composición química de la absenta preban vintage con especial referencia a concentraciones de tujona, fenchone, pinocamphone, metanol, cobre y antimonio" . J. Agric. Food Chem . 56 (9): 3073–81. doi : 10.1021 / jf703568f . PMID 18419128 .
enlaces externos
- Absinthe absolved , Cern Courier , 8 de julio de 2008
- Thujone.Info - Banco de datos de artículos revisados por pares sobre tujona, absenta, absenta y calificaciones independientes de tujona de algunas marcas comerciales.
- The Shaky History of Thujone - Artículo de Wormwood Society sobre tujona y su historia.