Entonces hombre - Soman

|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
Metilfosfonofluoridato de 3,3-dimetilbutan-2-il |
|
| Otros nombres
GD; Ácido fosfonofluorídico, metil-, 1, 2, 2-trimetilpropil éster; 2- (fluorometilfosforil) oxi-3,3-dimetilbutano; Metilfosfonofluoridato de pinacolilo; Metilfosfonofluoridato de 1,2,2-trimetilpropilo; Óxido de metilpinacoliloxifluorofosfina; Fluoruro de pinacoliloximetilfosfonilo; Metanofluorofosfonato de pinacolilo; Metilfluoropinacolilfosfonato; Óxido de fluorometilpinacoliloxifosfina; Fluoruro de metilpinacoliloxifosfonilo; Metilfluorofosfonato de pinacolilo; Óxido de 1,2,2-trimetilpropoxifluorometilfosfina
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 7 H 16 F O 2 P | |
| Masa molar | 182,175 g · mol −1 |
| Apariencia | Cuando es puro, líquido incoloro con olor parecido a fruta podrida. Con impurezas, ámbar o marrón oscuro, con olor a aceite de alcanfor. |
| Densidad | 1.022 g / cm³ |
| Punto de fusion | -42 ° C (-44 ° F; 231 K) |
| Punto de ebullición | 198 ° C (388 ° F; 471 K) |
| Moderar | |
| Presión de vapor | 0,40 mmHg (53 Pa) |
| Peligros | |
| Principales peligros | Altamente toxico |
| NFPA 704 (diamante de fuego) | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
Soman (o GD , EA 1210 , Zoman , PFMP , nombre sistemático: metilfosfonofluoridato de O -pinacolilo) es una sustancia química extremadamente tóxica. Es un agente nervioso que interfiere con el funcionamiento normal del sistema nervioso de los mamíferos al inhibir la enzima colinesterasa . Es un inhibidor tanto de la acetilcolinesterasa como de la butirilcolinesterasa . Como arma química , está clasificada como arma de destrucción masiva por las Naciones Unidas de acuerdo con la Resolución 687 de la ONU . Su producción está estrictamente controlada y su almacenamiento está prohibido por la Convención de Armas Químicas de 1993, donde está clasificada como sustancia de la Lista 1 . Soman fue el tercero de los llamados agentes nerviosos de la serie G que se descubrió junto con GA (tabun), GB (sarín) y GF (ciclosarina).
Cuando está puro, es un líquido volátil, corrosivo e incoloro con un leve olor como el de bolas de naftalina o fruta podrida. Más comúnmente, es de color amarillo a marrón y tiene un olor fuerte descrito como similar al alcanfor . La LCt 50 para el somán es de 70 mg · min / m 3 en humanos.
GD se puede espesar para su uso como un aerosol químico usando un copolímero acriloide. También se puede utilizar como arma química binaria ; sus precursores químicos son el difluoruro de metilfosfonilo y una mezcla de alcohol pinacolílico y una amina .
Historia
Después de la Primera Guerra Mundial, durante la cual se utilizaron gas mostaza y fosgeno como agentes de guerra química, se firmó el Protocolo de Ginebra de 1925 en un intento de prohibir la guerra química. Sin embargo, prosiguieron las investigaciones sobre los agentes de guerra química y su uso. En 1936 se descubrió un agente químico nuevo y más peligroso cuando Gerhard Schrader de IG Farben en Alemania aisló el tabun (llamado GA por el agente alemán A por los Estados Unidos), el primer agente nervioso, mientras desarrollaba nuevos insecticidas . Este descubrimiento fue seguido por el aislamiento de sarín (designado GB por los Estados Unidos) en 1938, también descubierto por Schrader.
Durante la Segunda Guerra Mundial, la investigación de los agentes nerviosos continuó en los Estados Unidos y Alemania. En el verano de 1944, los alemanes desarrollaron el somán, un líquido incoloro con olor a alcanfor (designado GD por los Estados Unidos). El somán resultó ser incluso más tóxico que el tabun y el sarín. El premio Nobel Richard Kuhn, junto con Konrad Henkel, descubrieron el soman durante una investigación sobre la farmacología del tabun y el sarín en el Instituto Kaiser Wilhelm de Investigación Médica de Heidelberg . Esta investigación fue encargada por el ejército alemán. Soman se produjo en pequeñas cantidades en una planta piloto en la fábrica IG Farben en Ludwigshafen . Nunca se usó en la Segunda Guerra Mundial.
La Convención de Armas Químicas de 1993 prohibió producir o almacenar somán . Cuando la convención entró en vigor, las partes declararon reservas mundiales de 9.057 toneladas de somán. A diciembre de 2015, el 84% de las existencias habían sido destruidas.
La estructura cristalina del somán complejado con acetilcolinesterasa fue determinada por Millard et al. en 1999 por cristalografía de rayos X: 1som . Otras estructuras de acetilcolinesterasa resueltas con somán unido a ellas incluyen 2wfz , 2wg0 y 2wg1 .
Estructura y reactividad
Soman (C (±) P (±) -soman) tiene cuatro estereoisómeros , cada uno con una toxicidad diferente, aunque muy similar. Los estereoisómeros son C (+) P (+) - somán, C (+) P (-) - somán C (-) P (-) - somán y C (-) P (+) - somán.
El somán tiene un grupo fosfonilo con un fluoruro y un hidrocarburo (grande) unido covalentemente a él. Por lo tanto, la estructura es similar a la del sarín, que solo tiene un grupo hidrocarbonado más pequeño unido (isopropilo). Debido a la similitud entre las estructuras químicas, la reactividad de los dos compuestos es casi la misma. Tanto el somán como el sarín reaccionarán utilizando el grupo fosfo-oxígeno, que puede unirse a aminoácidos como la serina.
Síntesis
La fabricación de somán es muy similar a la fabricación de sarín. La diferencia es que el isopropanol de los procesos del sarín se reemplaza con alcohol pinacolílico :
El somán se sintetiza haciendo reaccionar alcohol pinacolílico con difluoruro de metilfosfonilo . El resultado de esta reacción es la formación de somán, que se describe como "líquido incoloro con un olor algo afrutado". La baja presión de vapor del somán también producirá la forma de gas volátil del somán. Además, el fluoruro de hidrógeno ácido se formará debido a la eliminación de fluoruro y un protón. Este ácido es indirectamente peligroso para los humanos. El contacto de la piel con el fluoruro de hidrógeno provocará una reacción inmediata con el agua que produce ácido fluorhídrico .
Mecanismos de accion
El somán es un agente nervioso organofosforado con un mecanismo de acción similar al tabún. Los agentes nerviosos inhiben la acetilcolina esterasa (AChE) formando un aducto con la enzima a través de un residuo de serina en esa enzima. Estos aductos pueden descomponerse hidrolíticamente o, por ejemplo, por la acción de algunas oximas y así regenerar la enzima. Un segundo tipo de reacción, uno en el que el complejo enzima-organofosfato (OP) sufre una reacción posterior, generalmente se describe como "envejecimiento". Una vez que el complejo enzima-OP ha envejecido, los reactivadores comunes de oxima ya no lo regeneran. La velocidad de este proceso depende del OP. Soman es un OP que estimula la tasa de envejecimiento más rápidamente disminuyendo la vida media a solo unos minutos.
La AChE es una enzima implicada en la neurotransmisión. Debido a la severa disminución de la vida media de esta enzima, la neurotransmisión se elimina en cuestión de minutos.
Metabolismo
Una vez absorbido en el cuerpo humano, el somán no solo inhibe la AChE, sino que también es un sustrato para otras esterasas. La reacción del somán con estas esterasas permite la desintoxicación del compuesto. No se conocen reacciones de intoxicación metabólica para el somán.
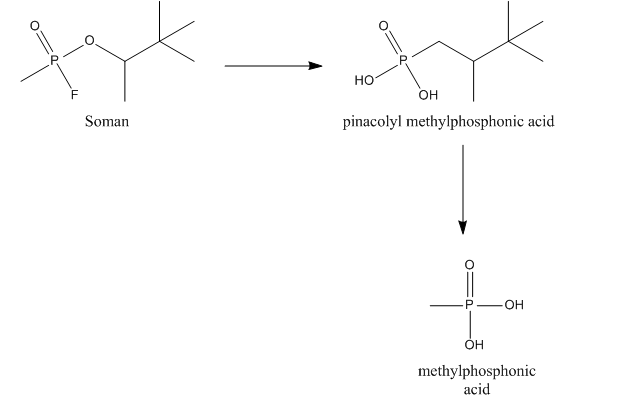
El somán puede hidrolizarse mediante una llamada A-esterasa, más específica, una diisopropilfluorofosfatasa. Esta esterasa, también llamada somanasa, reacciona con el enlace anhídrido entre el fósforo y el flúor y es responsable de la hidrólisis del flúor. Somanase también hidroliza el grupo metilo del somán dando como resultado la formación de ácido pinacolil metilfosfónico (PMPA), que es un inhibidor de AChE menos potente.
El somán también puede unirse a otras esterasas , por ejemplo, AChE , colinesterasa (ChE) y carboxilesterasas (CarbE). En esta unión, el somán pierde su flúor. Después de unirse a AChE o ChE, el soman también pierde su grupo fosforilo, lo que lleva a la formación de ácido metilfosfónico (MPA). La unión a CarbE reduce la concentración total de somán en la sangre, lo que resulta en una menor toxicidad. Además, los CarbE participan en la desintoxicación al hidrolizar somán a PMPA. Así que CarbE explica la desintoxicación del somán de dos maneras.
La importancia de la desintoxicación del somán después de la exposición se ilustró en experimentos de Fonnum y Sterri (1981). Informaron que solo el 5% de la LD50 inhibía la AChE en ratas, lo que provocaba efectos tóxicos agudos. Esto muestra que las reacciones metabólicas explicaron la desintoxicación del 95% restante de la dosis.
Signos y síntomas
Como el somán está estrechamente relacionado con compuestos como el sarín, las indicaciones de una intoxicación por somán son relativamente similares. Uno de los primeros signos observables de una intoxicación por somán es la miosis . Algunas, pero no todas, las indicaciones posteriores son vómitos, dolor muscular extremo y problemas del sistema nervioso periférico. Estos síntomas aparecen tan pronto como 10 minutos después de la exposición y pueden durar muchos días.
Además de los efectos tóxicos directos sobre el sistema nervioso, las personas expuestas al somán pueden experimentar efectos a largo plazo, la mayoría de los cuales son psicológicos. Los sujetos que fueron expuestos a una pequeña dosis de somán sufrieron efectos tóxicos graves; una vez tratados, los sujetos a menudo desarrollaron depresión, tenían pensamientos antisociales, estaban retraídos y sometidos, dormían sin descanso y tenían pesadillas. Estos síntomas duraron seis meses después de la exposición, pero desaparecieron sin daños duraderos.
Toxicidad y eficacia
Se estima que la CL 50 de somán en el aire es de 70 mg min por m 3 . En comparación con el valor de LC 50 de una rata, la concentración letal humana es mucho menor (954,3 mg min / m 3 frente a 70 mg min / m 3 ). Para compuestos como el somán, que también se puede utilizar como arma, a menudo una fracción de la dosis LC 50 es donde aparecen los primeros efectos. La miosis es uno de los primeros síntomas de la intoxicación por somán y se puede observar en dosis inferiores al 1% de la CL 50 .
Efectos sobre los animales
Se han realizado experimentos en los que se expuso a ratas al somán para probar si se podían observar efectos conductuales en dosis bajas sin generar síntomas evidentes. La exposición de las ratas al somán en una dosis de menos del 3 por ciento de la LD 50 provocó alteraciones del comportamiento. La evitación activa de las ratas expuestas fue menor que la evitación de las ratas no expuestas (experimento de caja de transporte bidireccional). También se vieron afectados la coordinación motora (tarea de paso de obstáculos), el comportamiento de campo abierto y el comportamiento de evitación tanto activo como pasivo. Se puede concluir que las ratas expuestas al somán se desempeñaron con menos éxito en tareas que requieren actividad motora, así como la función de estructuras superiores del sistema nervioso central (SNC) al mismo tiempo. En esto, el somán tiene un efecto predominantemente central.
El conocimiento de los efectos de dosis bajas de somán y otros inhibidores de esterasa de colina en ratas podría posiblemente utilizarse para explicar la incidencia relativamente alta de accidentes de avión debido a errores de los pilotos agrícolas. Si este conocimiento pudiera aplicarse a los seres humanos, se podría explicar esta alta incidencia con actividad deprimida de la colina esterasa debido a la exposición a pesticidas. No se sabe si se puede hacer la extrapolación de ratas a humanos.
Referencias
enlaces externos
- Senado de los Estados Unidos, 103 ° Congreso, 2 ° período de sesiones. (25 de mayo de 1994). Hoja de datos de seguridad del material - Somain de agentes nerviosos letales (GD y GD espesado) . Consultado el 6 de noviembre de 2004.
- Inhibidores y sustratos de AChE en Proteopedia
- 2wfz en Proteopedia
- 2wg0 en Proteopedia
- 2wg1 en Proteopedia
- 1som en Proteopedia
- https://somantoxicologia.wixsite.com/meusite