Ni- - Nor-
En la nomenclatura química , nor- es un prefijo para nombrar un análogo estructural que puede derivarse de un compuesto original mediante la eliminación de un átomo de carbono junto con los átomos de hidrógeno que lo acompañan. El compuesto nor puede derivarse mediante la eliminación de un CH
3, CH
2, o grupo CH, o de un átomo de C. El prefijo "nor-" también incluye la eliminación de un puente de metileno en un compuesto parental cíclico , seguida de la contracción del anillo . (El prefijo " homo- ", que indica el siguiente miembro superior de una serie homóloga , suele limitarse a los carbonos no cíclicos). Los términos desmetil- o desmetil- son sinónimos de "nor-".
"Ni" es una abreviatura de normal. Originalmente, el término se usó para indicar la forma completamente desmetilada del compuesto original. Más tarde, el significado se restringió a la eliminación de un grupo. Tampoco se escribe directamente delante del nombre de la raíz, sin un guión entre, a menos que haya otro prefijo después de ni (por ejemplo, α-). Si se eliminan varios grupos se utiliza el prefijo dinor, trinor, tetranor, etcétera. El prefijo está precedido por el número de posición (localizador) de los átomos de carbono que desaparecen. Por ejemplo 2,3-dinor. Se conserva la numeración original del compuesto original. De acuerdo con la nomenclatura de la IUPAC, este prefijo no se escribe en cursiva y a diferencia de ni, cuando es di o superior ni, al final de los números separados por comas, se usa un guión. Como, por ejemplo, la 2,3-dinor-6-ceto, la prostaglandina F1α se produce mediante la oxidación beta del compuesto original 6-ceto prostaglandina F1α. Aquí, aunque en realidad el carbono 1 y 2 se pierden por oxidación. El nuevo Carbono 1 ahora se ha convertido en un CCOH similar al compuesto original, como si solo se hubieran eliminado el carbono 2 y 3 del compuesto original. "Dinor" no tiene que ser reducción en carbonos adyacentes, por ejemplo, ácido 5-acetil-4,18-dinor-retinoico, donde 4 se refiere a un carbono del anillo y 18 se refiere a un grupo metilo en el 5º carbono del anillo.
El uso alternativo de "ni" al nombrar la forma no ramificada de un compuesto dentro de una serie de isómeros (también denominado "normal") es obsoleto y no está permitido en los nombres de la IUPAC.
Historia
Posiblemente el primer uso conocido del prefijo "ni" sea el de A. Matthiessen y GC Foster en 1867 en una publicación sobre la reacción entre un ácido fuerte y ácido opiánico (ver imagen).
El ácido opiánico (C 10 H 10 O 5 ) es un compuesto con dos grupos metilo y lo llamaron "ácido dimetil nor-opiánico". Después de la reacción con un ácido fuerte, se obtuvo un compuesto con solo un metilo (C 9 H 8 O 5 ). A este ácido opiánico parcialmente desmetilado lo llamaron "ácido opiánico metil normal". El compuesto completamente desmetilado (C 8 H 6 O 5 ) se denotó por el término "ácido opiánico normal", abreviado como "ácido nor-opiánico".
De manera similar, Matthiessen y Foster llamaron narcotina , que tiene tres grupos metoxi , "trimetil nor-narcotina". La narcotina desmetilada singular se denominó "dimetil no-narcotina", la narcotina más desmetilada "metil no-narcotina" y la forma completamente desmetilada "narcotina normal" o "no-narcotina".
"Desde ese momento el significado del prefijo se ha generalizado para denotar el reemplazo de uno o más grupos metilo por H, o la desaparición del CH 2 de una cadena de carbono" .
En la actualidad, el significado está restringido para indicar la eliminación de un solo grupo de la estructura original, en lugar de la forma completamente desmetilada del compuesto original.
En la literatura, "ni" se denomina a veces el "próximo homólogo inferior", aunque en este contexto "homólogo" es un término inexacto. "Ni" solo se refiere a la eliminación de un átomo de carbono con el hidrógeno que lo acompaña, no a la eliminación de otras unidades. "Ni" compara dos compuestos relacionados; no describe la relación con una serie homóloga .
Etimología falsa
Se sugiere que "ni" es un acrónimo del alemán " N o hne R adikal" (" nitrógeno sin radical "). Al principio, el farmacólogo británico John H. Gaddum siguió esta teoría, pero en respuesta a una revisión de AM Woolman, Gaddum se retractó de su apoyo a esta etimología. Woolman creía que "N ohne Radikal" era un mnemónico alemán y probablemente un backronym , en lugar del significado real del prefijo "ni". Esto se puede argumentar con el hecho de que "el prefijo ni se usa para muchos compuestos que no contienen nitrógeno en absoluto" .
Uso obsoleto del término
Originalmente, "ni" tenía un significado ambiguo, ya que el término "normal" también podría referirse a la forma no ramificada en una serie de isómeros, por ejemplo, como con alcanos , alcanoles y algunos aminoácidos.
Los nombres de alcanos y alcanoles no ramificados, como " butano normal " y " alcohol propílico normal ", que ahora están obsoletos, se han convertido en el prefijo n- , sin embargo, no en "ni". Otros compuestos "normales" recibieron el prefijo "ni". Los nombres triviales más antiguos , como norleucina y norvalina, deben abandonarse; el uso del prefijo para compuestos isoméricos ya se desaconsejó en 1955 o antes.

Ejemplos de
 |
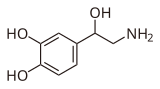
|
|
| epinefrina | norepinefrina | |
 |
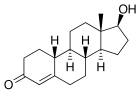
|
|
| testosterona | nortestosterona |


