Crioablación - Cryoablation
| Crioablación | |
|---|---|
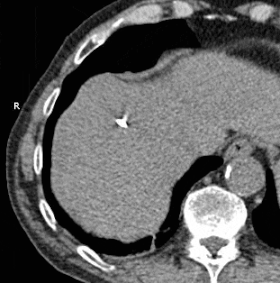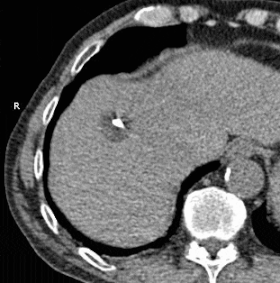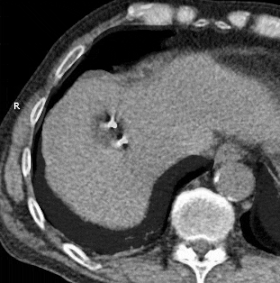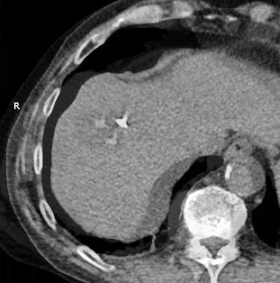 GIF animado que muestra la crioablación de masa en el lóbulo hepático derecho utilizando dos sondas. El tiempo transcurrido es de aproximadamente 30 minutos.
| |
| ICD-9-CM | 37,33 , 37,34 , 60,62 |
| Malla | D003452 |
La crioablación es un proceso que utiliza frío extremo para destruir tejido . La crioablación se realiza mediante agujas huecas (criosondas) a través de las cuales circulan fluidos refrigerados y térmicamente conductores. Las criosondas se colocan adyacentes al objetivo de tal manera que el proceso de congelación destruirá el tejido enfermo. Una vez que las sondas están en su lugar, la unidad de congelación criogénica adjunta elimina el calor ("enfría") la punta de la sonda y, por extensión, de los tejidos circundantes.
La ablación ocurre en tejido que ha sido congelado por al menos tres mecanismos:
- la formación de cristales de hielo dentro de las células, lo que interrumpe las membranas e interrumpe el metabolismo celular, entre otros procesos;
- la coagulación de la sangre interrumpiendo así el flujo sanguíneo al tejido, provocando a su vez isquemia y muerte celular; y
- inducción de la apoptosis , la llamada cascada de muerte celular programada.
La aplicación más común de la crioablación es la ablación de tumores sólidos que se encuentran en pulmón, hígado, mama, riñón y próstata. El uso en crioablación prostática y renal es el más común. Aunque a veces se aplica en criocirugía mediante abordajes quirúrgicos laparoscópicos o abiertos, la mayoría de las veces la crioablación se realiza de forma percutánea (a través de la piel y en el tejido diana que contiene el tumor) por un médico especialista, como un radiólogo intervencionista . El término proviene de crio- + ablación .
Próstata
La crioablación de próstata es moderadamente eficaz pero, como con cualquier proceso de extirpación de próstata, también puede provocar impotencia. La crioablación de próstata se utiliza en tres categorías de pacientes:
- como terapia primaria en pacientes para quienes la función sexual es menos importante o que son malos candidatos para la prostatectomía radical retropúbica (PRR, extirpación quirúrgica de la próstata);
- como terapia de rescate en pacientes que han fracasado con braquiterapia (el uso de "semillas" radioactivas implantadas colocadas dentro de la próstata) o radioterapia de haz externo (EBRT); y
- terapia focal para tumores más pequeños y discretos en pacientes más jóvenes.
Cáncer de hueso
La crioablación se ha explorado como una alternativa a la ablación por radiofrecuencia en el tratamiento del dolor moderado a intenso en personas con enfermedad ósea metastásica . El área de destrucción de tejido creada por esta técnica se puede monitorear de manera más efectiva mediante TC que con RFA, una ventaja potencial cuando se tratan tumores adyacentes a estructuras críticas.
Renal
La crioablación tiene resultados similares a la ablación por radiofrecuencia cuando se trata el carcinoma de células renales .
Cáncer de mama
La crioablación para el cáncer de mama generalmente solo es posible para tumores pequeños. A menudo se utiliza cirugía después de la crioablación. A partir de 2014, se requieren más investigaciones antes de que pueda reemplazar la lumpectomía .
Cardíaco
Otro tipo de crioablación se utiliza para restaurar la conducción eléctrica normal congelando el tejido o las vías del corazón que interfieren con la distribución normal de los impulsos eléctricos del corazón. La crioablación se utiliza en dos tipos de intervenciones para el tratamiento de arritmias : (1) procedimientos basados en catéter y (2) operaciones quirúrgicas.
Un catéter es un tubo muy delgado que se inserta en una vena de la pierna del paciente y se enrosca hasta el corazón, donde suministra energía para tratar la arritmia del paciente. En los procedimientos quirúrgicos, se usa una sonda flexible directamente sobre un corazón expuesto para aplicar la energía que interrumpe la arritmia. Al enfriar la punta de un catéter de crioablación ( cardiología ) o sonda ( cirugía cardíaca ) a temperaturas bajo cero, las células del corazón responsables de conducir la arritmia se alteran para que ya no conduzcan impulsos eléctricos.
Fibroadenoma
La crioablación también se utiliza actualmente para tratar los fibroadenomas de mama. Los fibroadenomas son tumores benignos de mama que se encuentran en aproximadamente el 10% de las mujeres (principalmente entre los 15 y los 30 años).
En este procedimiento que ha sido aprobado por la Administración de Drogas y Alimentos de los EE. UU . (FDA), se inserta una sonda guiada por ultrasonido en el fibroadenoma y luego se utilizan temperaturas extremadamente frías para destruir las células anormales. Con el tiempo, las células se reabsorben en el cuerpo. El procedimiento se puede realizar en un consultorio médico con anestesia local y deja muy pocas cicatrices en comparación con los procedimientos quirúrgicos abiertos.
Procedimientos basados en catéter
Se pueden usar diferentes técnicas de ablación basadas en catéter y generalmente se dividen en dos categorías: (1) procedimientos basados en frío donde se usa enfriamiento de tejido para tratar la arritmia, y (2) procedimientos basados en calor donde se usa alta temperatura para alterar la tejido conductor anormal en el corazón.
Crioablación
Las temperaturas frías se utilizan en la crioablación para enfriar o congelar las células que conducen ritmos cardíacos anormales. El catéter elimina el calor del tejido para enfriarlo a temperaturas tan bajas como -75 ° C. Esto provoca cicatrices localizadas, que cortan vías de conducción no deseadas.
Este es un tratamiento mucho más nuevo para la taquicardia supraventricular (TSV) que afecta directamente al nódulo auriculoventicular (AV). La TSV que afecta al nódulo AV es a menudo una contraindicación para el uso de ablación por radiofrecuencia debido al riesgo de lesionar el nódulo AV, lo que obliga a los pacientes a recibir un marcapasos permanente. Con la crioablación, las áreas de tejido pueden mapearse mediante congelación limitada y reversible (p. Ej., A -10 ° C). Si el resultado no es deseable, el tejido se puede recalentar sin daño permanente. De lo contrario, el tejido se puede extirpar permanentemente congelándolo a una temperatura más baja (por ejemplo, -73 ° C).
Esta terapia ha revolucionado la taquicardia reentrante del nódulo AV (AVNRT) y otras taquiarritmias del nódulo AV. Ha permitido que las personas que de otro modo no eran candidatas para la ablación por radiofrecuencia tengan la oportunidad de curar su problema. Esta tecnología se desarrolló en el Instituto del Corazón de Montreal a fines de la década de 1990. La terapia se adoptó con éxito en Europa en 2001 y en los EE. UU. En 2004 después del "Frosty Trial".
En 2004, Mark Krebs, MD, FACC, Matthew Hoskins, RN, BSN y Ken Peterman, RN, BSN fueron los pioneros en la tecnología en el medio oeste de los Estados Unidos en el Miami Valley Hospital en Dayton, Ohio. Estos expertos en electrofisiología lograron curar a los primeros 12 candidatos en sus instalaciones.
La crioablación para AVNRT y otras arritmias tiene algunos inconvenientes. Un estudio reciente concluyó que los tiempos de procedimiento son en promedio ligeramente más altos para la crioablación que para las ablaciones tradicionales por radiofrecuencia (basadas en calor). Además, se registró una mayor tasa de fallas de equipos utilizando esta técnica. Finalmente, aunque la tasa de éxito a corto plazo es equivalente a los tratamientos con RF, la crioablación parece tener una tasa de recurrencia a largo plazo significativamente más alta.
Prueba del sitio
La crioterapia puede producir un bloqueo eléctrico temporal al enfriar el tejido que se cree que conduce la arritmia. Esto le permite al médico asegurarse de que este sea el sitio correcto antes de desactivarlo permanentemente. La capacidad de probar un sitio de esta manera se conoce como prueba del sitio o criomapeo .
Cuando se realiza una ablación de tejido cerca del nódulo AV (un centro de conducción especial que transporta impulsos eléctricos desde las aurículas hasta los ventrículos), existe el riesgo de producir un bloqueo cardíaco, es decir, la conducción normal desde las aurículas no se puede transmitir a los ventrículos. Es menos probable que la congelación del tejido cerca del nódulo AV provoque un bloqueo cardíaco irreversible que la ablación con calor.
Procedimientos quirúrgicos
Al igual que en los procedimientos basados en catéteres, se pueden utilizar técnicas que utilizan temperaturas de calentamiento o enfriamiento para tratar las arritmias durante la cirugía cardíaca. También existen técnicas en las que se utilizan incisiones a corazón abierto para interrumpir la conducción eléctrica anormal ( procedimiento de laberinto ). La criocirugía implica el uso de técnicas de congelación para el tratamiento de arritmias durante la cirugía.
Un médico puede recomendar el uso de criocirugía durante el curso de la cirugía cardíaca como un procedimiento secundario para tratar cualquier arritmia que estuviera presente o que pueda aparecer durante el procedimiento de tórax abierto primario. Las operaciones cardíacas más comunes en las que se puede utilizar la criocirugía de esta manera son las reparaciones de la válvula mitral y el injerto de derivación de la arteria coronaria . Durante el procedimiento, se coloca una criosonda flexible sobre o alrededor del corazón y suministra energía fría que inhabilita el tejido responsable de conducir la arritmia.
Malformaciones vasculares
La crioablación se ha utilizado recientemente para tratar malformaciones vasculares de bajo flujo , como malformaciones venosas (VM) y anomalías vasculares fibroadiposas (FAVA). La crioablación ha demostrado ser eficaz para tratar estos trastornos tanto como tratamiento primario como después de la escleroterapia .
Crioinmunoterapia
La crioinmunoterapia es un tratamiento oncológico para varios cánceres que combina la crioablación del tumor con el tratamiento de inmunoterapia . La crioablación in vivo de un tumor, por sí sola, puede inducir una respuesta antitumoral sistémica inmunoestimuladora, lo que da como resultado una vacuna contra el cáncer: el efecto abscopal . Sin embargo, la crioablación sola puede producir una respuesta inmune insuficiente, dependiendo de varios factores, como una alta tasa de congelación. La combinación de crioterapia con inmunoterapia mejora la respuesta inmunoestimulante y tiene efectos sinérgicos para el tratamiento del cáncer.
Historia
El uso del frío para aliviar el dolor y como antiinflamatorio se conoce desde la época de Hipócrates (460-377 aC). Desde entonces, ha habido numerosos relatos del uso de hielo para aliviar el dolor, incluidos los antiguos egipcios y Avicena de Persia (982-1070 d. C.). Desde 1899, el Dr. Campbell White utilizó refrigerantes para tratar una variedad de afecciones, que incluyen: lupus eritematoso, herpes zóster, chancroide, nevus, verrugas, úlceras varicosas en las piernas, carbúnculos, carcinomas y epiteliomas. De Quervain utilizó con éxito la nieve carbónica para tratar papilomas de vejiga y cánceres de vejiga en 1917. El Dr. Irving S. Cooper, en 1913, progresó en el campo de la crioterapia diseñando una sonda de nitrógeno líquido capaz de alcanzar temperaturas de -196 ° C y utilizando para tratar la enfermedad de Parkinson y un cáncer previamente inoperable. La criosonda de Cooper avanzó en la práctica de la crioterapia, lo que generó un creciente interés y práctica de la crioterapia. En 1964, el Dr. Cahan utilizó con éxito su invento de sonda de nitrógeno líquido para tratar los fibromas uterinos y el cáncer de cuello uterino. La crioterapia continuó avanzando con el Dr. Amoils desarrollando una sonda de nitrógeno líquido capaz de lograr la expansión del enfriamiento, en 1967.
Con los avances tecnológicos de la criosonda en la década de 1960, llegó una mayor aceptación y práctica de la crioterapia. Desde la década de 1960, los cánceres de hígado, próstata, mama, huesos y otros cánceres se estaban tratando con crioablación en muchas partes del mundo. El médico japonés Dr. Tanaka comenzó a tratar la crioablación por cáncer de mama metastásico en 1968. Durante las siguientes tres décadas, la Dra. Tanaka trató con éxito cáncer de mama pequeño y localizado, así como avanzado e irresecable con crioablación mínimamente invasiva. Todos los casos de cáncer de mama del Dr. Tanaka se consideraron incurables: avanzado, irresecable y resistente a la radioterapia, la quimioterapia y la terapia endocrina. Al mismo tiempo, los médicos, incluidos el Dr. Ablin y el Dr. Gage, comenzaron a utilizar la crioablación para el tratamiento del cáncer de próstata y de huesos . El Dr. Paul J. Wang MD y el Dr. Peter L. Friedman MD, PhD inventaron la crioablación para el corazón y las arritmias cardíacas en 1988. Sus patentes eran para el catéter de crioablación y el mapeo criogénico (Patentes de EE. UU. 5147355A y 5423807A).
Las décadas de 1980 y 1990 vieron un avance dramático en aparatos y técnicas de imagen, con la introducción de CMS Cryoprobe y Accuprobe. Se dispuso de criosondas guiadas por ultrasonido , resonancia magnética y tomografía computarizada y mejoraron las capacidades de las criosondas en el tratamiento. Emocionada por los últimos avances en crioterapia, China adoptó la crioterapia en la década de 1990 para tratar muchas afecciones oncológicas. Con los beneficios bien establecidos, la FDA aprobó el tratamiento del cáncer de próstata con crioablación en 1998.
