Moléculas liberadoras de monóxido de carbono - Carbon monoxide-releasing molecules
Las moléculas liberadoras de monóxido de carbono ( CORM ) son compuestos químicos diseñados para liberar cantidades controladas de monóxido de carbono (CO). Los CORM se están desarrollando como agentes terapéuticos potenciales para administrar CO localmente a las células y tejidos, superando así las limitaciones de los protocolos de inhalación de gas CO.
El CO es mejor conocido por su toxicidad en la intoxicación por monóxido de carbono en dosis altas. Sin embargo, el CO se encuentra entre las moléculas de señalización gaseosas endógenas y la dosis baja de CO se ha relacionado con beneficios terapéuticos. La investigación preclínica se ha centrado en la actividad antiinflamatoria del CO con aplicaciones significativas en enfermedades cardiovasculares, oncología, cirugía de trasplantes y neuroprotección.
La mayor parte del CO producido en los mamíferos se origina en la degradación del hemo por las tres isoformas de la hemo oxigenasa , por lo que el HO-1 es inducido por el estrés oxidativo , el CO y una serie de xenobióticos . HO-2 y HO-3 son constitutivos. Otras fuentes endógenas pueden incluir la peroxidación de lípidos,
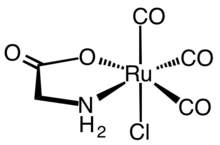
La reacción enzimática de la hemo oxigenasa inspiró el desarrollo de CORM sintéticos. Los primeros CORM sintéticos eran típicamente complejos de carbonilo metálico . Un CORM representativo que se ha caracterizado ampliamente tanto desde un punto de vista bioquímico como farmacológico es el complejo de rutenio (II) Ru ( glicinato ) Cl (CO) 3 , comúnmente conocido como CORM-3.
Clasificaciones CORM
La fuente más simple de CO proviene de una reacción de combustión a través de fuentes de combustión como combustibles fósiles o leña . Las fuentes que liberan CO por descomposición térmica o combustión generalmente no se consideran CORM. El tetracarbonilo de níquel fue el primer complejo de carbonilo utilizado para lograr la entrega local de CO en 1891.
CORM de metal de transición
La mayoría de los CORM terapéuticamente relevantes son complejos de metales de transición basados principalmente en hierro , molibdeno , rutenio , manganeso , cobalto y renio.
PhotoCORMs
La liberación de CO de los agentes portadores puede inducirse fotoquímicamente. Estos portadores se denominan fotoCORM e incluyen tanto complejos metálicos como compuestos sin metales ( orgánicos ) de diversos motivos estructurales que podrían considerarse un tipo especial de grupo protector fotolábil .
ET-CORM
Los CORM activados por enzimas (ET-CORM) se han desarrollado para mejorar la liberación local selectiva de CO. Algunos profármacos ET-CORM son activados por enzimas esterasas para la liberación de CO en sitios específicos.
CORM orgánicos
Se están desarrollando moléculas orgánicas pequeñas para superar las limitaciones de toxicidad de los CORM inorgánicos. El cloruro de metileno fue el primer CORM orgánico administrado por vía oral según informes previos de formación de carboxihemoglobina a través del metabolismo. El segundo CORM orgánico, CORM-A1 (boranocarbonato de sodio), se desarrolló sobre la base de un informe de 1960 sobre la liberación de CO a partir del boranocarbonato de potasio.
En 2003, oxocarbono cíclicos se sugirieron como fuente de CO terapéutico incluyendo ácido Deltic , ácido escuárico , el ácido crocónico , y ácido rhodizonic y sus sales.
En los últimos años se ha observado un creciente interés en los profármacos orgánicos de CO debido a la necesidad de considerar cuestiones de capacidad de desarrollo de fármacos en el desarrollo de terapias basadas en CO. Estos profármacos de CO tienen una tasa de liberación ajustable, una liberación activada y la capacidad de liberar más de una carga útil de un solo profármaco.
Híbridos de enzimas
Sobre la base del sinergismo del sistema hemo oxigenasa y el suministro de CO, surgió una nueva clase híbrida molecular CORM (HYCO) que consta de un inductor de HO-1 combinado y especies CORM. Uno de tales HYCO incluye un resto dimetilfumarato que activa NRF2 para inducir de ese modo HO-1, mientras que el resto CORM también libera CO.
Materiales que liberan monóxido de carbono
Los materiales liberadores de monóxido de carbono (CORMA) son esencialmente nuevas formulaciones de fármacos y plataformas de administración de fármacos que han surgido para superar las limitaciones farmacéuticas de la mayoría de las especies CORM. Un ejemplo de CORMA desarrollado por Hubbell consiste en una formulación de micelas preparadas a partir de copolímeros tribloque con una entidad CORM, que se activa para su liberación mediante la adición de cisteína . Otros andamios liberando CO-incluyen polímeros , péptidos , sílice nanopartículas , nanodiamante , nanopartículas magnéticas , nanofibras gel, metalo dendrímeros , y CORM-proteína (macromolécula) conjugados.
Infusión de carboxihemoglobina
La carboxihemoglobina se puede infundir para administrar CO. Los enfoques más comunes se basan en carboxihemoglobina bovina aliada con polietilenglicol (PEG) y carboxihemoglobina humana conjugada con maleimida PEG.
Porfirinas
Las estructuras de porfirina como hemo , hemina y análogos metálicos de protoporfirina IX (PPIX) (como cobalto PPIX) se han desplegado para inducir hemo oxigenasa y posteriormente sufrir biotransformación para liberar CO, el ion inorgánico y biliverdina / bilirrubina . Algunos PPIX análogos tales como estaño PPIX, mesoporfirina de estaño y zinc PPIX, son hemo oxigenasa inhibidores.
CO endógeno
A finales de la década de 1960, Tenhunen demostró una reacción enzimática para el catabolismo del hemo identificando así la enzima hemo oxigenasa (HO). HO es la principal fuente de producción de CO endógeno, aunque en los últimos años se han identificado otros contribuyentes menores. El CO se forma a una velocidad de 16,4 μmol / hora en el cuerpo humano, ~ 86% se origina a partir del hemo a través de la hemo oxigenasa y ~ 14% de fuentes no hemo que incluyen: fotooxidación, peroxidación de lípidos y xenobióticos. El nivel medio de carboxihemoglobina (CO-Hb) en un no fumador está entre el 0,2% y el 0,85% de CO-Hb (mientras que un fumador puede tener entre el 4% y el 10% de CO-Hb), aunque la ubicación geográfica, la ocupación, la salud y el comportamiento son variables que contribuyen.
Enzimas
Hemo oxigenasa
La hemo oxigenasa (HO) es un miembro que contiene hemo de la familia de proteínas de choque térmico (HSP) identificado como HSP32 . Hasta la fecha se han identificado tres isoformas de HO, incluidas la HO-1 inducida por estrés y las HO-2 y HO-3 constitutivas. La HO-1 se considera una proteína de rescate celular que se induce en respuesta al estrés oxidativo y numerosas enfermedades. Además, la HO-1 es inducida por innumerables moléculas que incluyen estatinas , hemina y productos naturales .
El HO cataliza la degradación del hemo a biliverdina / bilirrubina , iones ferrosos y CO. Aunque está presente en todo el cuerpo, el HO tiene una actividad significativa en el bazo en la degradación de la hemoglobina durante el reciclaje de eritrocitos (0,8% de la reserva de eritrocitos por día), que representa ~ 80% de la producción de CO endógeno derivado del hemo. La mayor parte del 20% restante de la producción de CO derivado del hemo se atribuye al catabolismo hepático de hemoproteínas ( mioglobina , citocromos , catalasa , peroxidasas , guanilato ciclasa soluble , óxido nítrico sintasa ) y eritropoyesis ineficaz en la médula ósea .
Peroxidación lipídica
La formación de CO a partir de la peroxidación de lípidos se informó por primera vez a fines de la década de 1960 y se considera un contribuyente menor a la producción de CO endógeno.
Farmacología del CO
El monóxido de carbono es una de las tres moléculas de señalización gaseosas junto con el óxido nítrico y el sulfuro de hidrógeno . Estos gases se denominan colectivamente gasotransmisores .
Señalización
La primera evidencia de CO como molécula de señalización se produjo al observar el CO que estimula la guanilato ciclasa soluble y la posterior producción de monofosfato de guanosina cíclico (cGMP) para servir como vasodilatador en las células del músculo liso vascular . Los efectos antiinflamatorios del CO se atribuyen a la activación de la vía de la proteína quinasa activada por mitógenos p38 (MAPK). Si bien el CO interactúa comúnmente con el átomo de hierro del hemo en una hemoproteína , se ha demostrado que el CO activa los canales de potasio dependientes del calcio al unirse en enlaces de hidrógeno con los residuos de histidina de superficie.
El CO tiene un efecto inhibidor sobre numerosas proteínas, como el citocromo P450 y la citocromo c oxidasa.
El CO es un modulador de canales iónicos con efectos tanto excitadores como inhibidores sobre numerosas clases de canales iónicos, como los canales de calcio dependientes de voltaje .
Distribución
El CO tiene aproximadamente 210 veces más afinidad por la hemoglobina que el oxígeno . La constante de disociación de equilibrio para la reacción Hb-CO ⇌ Hb + CO favorece fuertemente al complejo de CO, por lo que la liberación de CO para la excreción pulmonar lleva algún tiempo.
Sobre la base de esta afinidad de unión, la sangre es esencialmente un sumidero irreversible de CO y presenta un desafío terapéutico para el suministro de CO a células y tejidos.
Metabolismo
El CO se considera no reactivo en el cuerpo y se excreta principalmente por vía pulmonar y menos del 10% se oxida.
Referencias
Otras lecturas
- Kim HH, Choi S (agosto de 2018). "Aspectos terapéuticos del monóxido de carbono en enfermedades cardiovasculares" . artículo de revisión. Revista Internacional de Ciencias Moleculares . 19 (8): 2381. doi : 10.3390 / ijms19082381 . PMC 6121498 . PMID 30104479 .
- Ismailova A, Kuter D, Bohle DS, Butler IS (2018). "Una descripción general de las posibles aplicaciones terapéuticas de moléculas liberadoras de CO" . artículo de revisión. Química Bioinorgánica y Aplicaciones . 2018 : 8547364. doi : 10.1155 / 2018/8547364 . PMC 6109489 . PMID 30158958 .
- Abeyrathna N, Washington K, Bashur C, Liao Y (octubre de 2017). "Moléculas liberadoras de monóxido de carbono no metálico (CORM)". artículo de revisión. Química orgánica y biomolecular . 15 (41): 8692–8699. doi : 10.1039 / c7ob01674c . PMID 28948260 .
- Hopper C, Wollborn J (agosto de 2019). "Entrega de monóxido de carbono a través de anestésicos de éter halogenado". artículo de revisión. Óxido nítrico . 89 : 93–95. doi : 10.1016 / j.niox.2019.05.006 . PMID 31125687 .
- Wilson JL, Jesse HE, Poole RK, Davidge KS (mayo de 2012). "Efectos antibacterianos del monóxido de carbono". artículo de revisión. Biotecnología Farmacéutica Actual . 13 (6): 760–8. doi : 10.2174 / 138920112800399329 . PMID 22201612 .
- Slanina T, Sebej P (mayo de 2018). "PhotoCORMs activados por luz visible: diseño racional de moléculas orgánicas liberadoras de CO que se absorben en la ventana transparente de tejido" . artículo de revisión. Ciencias fotoquímicas y fotobiológicas . 17 (6): 692–710. doi : 10.1039 / C8PP00096D . PMID 29796556 .