Vinilogía - Vinylogy
La vinilogía es la transmisión de efectos electrónicos a través de un sistema de enlace orgánico conjugado . El concepto fue introducido en 1926 por Ludwig Claisen para explicar las propiedades ácidas de la formilacetona y los cetoaldehídos relacionados. Su forma de adjetivo, vinílogo , se usa para describir grupos funcionales en los que los restos estándar del grupo están separados por un doble enlace carbono-carbono. Por ejemplo, un ácido carboxílico con un doble enlace carbono-carbono (-HC = CH-, un " vinilo resto"; en realidad un grupo vinileno) entre un carbonilo grupo y un hidroxilo grupo se conoce como un viníloga ácido carboxílico .
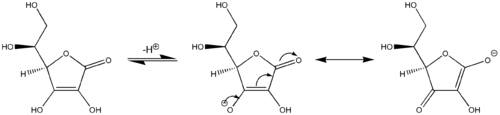
Debido a la transmisión de información electrónica a través de la conjugación, los grupos funcionales vinílogos a menudo poseen reactividad o propiedades químicas " análogas " en comparación con el grupo funcional original. Por lo tanto, la vinilogía es una heurística útil para la predicción del comportamiento de sistemas que son estructuralmente similares pero que contienen enlaces C = C intermedios que se conjugan con los grupos funcionales adjuntos. Por ejemplo, una propiedad clave de los ácidos carboxílicos es su acidez Brønsted. El ácido carboxílico más simple, el ácido fórmico (HC (= O) –OH), es un ácido orgánico moderadamente fuerte con una p K a de 3,7. Es de esperar que los ácidos carboxílicos vinílogos tengan una acidez similar. De hecho, el vinílica de ácido fórmico, 2-formil-1-eten-1-ol, HC (= O) -CH = CH-OH tiene una acidez sustancial Brønsted, con un p estimado K un ~ 5-6. En particular, los ácidos carboxílicos vinílogos son ácidos sustancialmente más fuertes que los enoles típicos (p K a ~ 12). La vitamina C ( ácido ascórbico , ver más abajo ) es un ejemplo biológicamente importante de ácido carboxílico vinílogo.
La inserción de un o- o p- fenileno (es decir, un anillo de benceno en la orientación 1,2 o 1,4) también da como resultado algunas similitudes en la reactividad (llamada "fenilogía"), aunque el efecto es generalmente más débil, ya que la conjugación a través del anillo arilo requiere la consideración de formas de resonancia o intermedios en los que se interrumpe la aromaticidad.

Reactividad viníloga
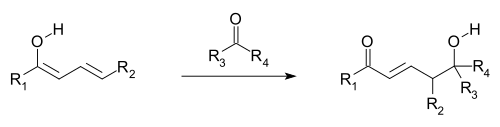
Se cree que las reacciones vinílogas se producen cuando los orbitales de los dobles enlaces del grupo vinilo y de un grupo captador de electrones adjunto (EWG; los orbitales π) están alineados y, por lo tanto, pueden superponerse y mezclarse (es decir, conjugarse ). La deslocalización de electrones permite que el EWG reciba la densidad de electrones mediante la participación del sistema conjugado. Las reacciones vinílogas también incluyen adiciones conjugadas , donde un nucleófilo reacciona en el extremo vinílico, así como una variación viníloga de la reacción aldólica , donde un electrófilo es atacado por un enolato vinílogo nucleófilo (ver la primera imagen y la siguiente). El enolato vinílogo reacciona en la posición terminal del sistema de doble enlace (el carbono γ), en lugar del carbono α inmediatamente adyacente al carbonilo, como lo haría un enolato simple. Los electrófilos alílicos a menudo reaccionan mediante el ataque vinílogo de un nucleófilo en lugar de la adición directa.
Otro ejemplo de reactividad viníloga: el ácido ascórbico (vitamina C) se comporta como un ácido carboxílico vinílogo por la participación de su resto carbonilo, un grupo vinilo dentro del anillo y el par solitario en el grupo hidroxilo que actúa como sistema conjugado . La acidez del protón hidroxilo en el extremo del grupo vinilo en el ácido ascórbico es más comparable a un ácido carboxílico típico que a un alcohol porque dos estructuras de resonancia principales estabilizan la carga negativa en la base conjugada del ácido ascórbico (estructuras central y derecha en la última imagen ), análoga a las dos estructuras de resonancia que estabilizan la carga negativa en el anión que resulta de la eliminación de un protón de un ácido carboxílico simple (cf. primera imagen). De manera análoga, los derivados del ácido sórbico , extendidos por otro resto "vinilo", también muestran un comportamiento vinílogo.
Otras lecturas
- Lisboa, Marilda P .; Hoang, Tung T .; Dudley, Gregory B. (2011). "Adición / fragmentación nucleófila en tándem de triflatos de acilo vinílogos: 2-metil-2- (1-oxo-5-heptinil) -1,3-ditiano" . Síntesis orgánicas . 88 : 353. doi : 10.15227 / orgsyn.088.0353 .