Temozolomida - Temozolomide
 | |
 | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Temodar, Temodal, Temcad, otros |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a601250 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración |
Por vía oral , intravenosa |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | casi el 100% |
| Enlace proteico | 15% (10-20%) |
| Metabolismo | hidrólisis |
| Metabolitos | 3-metil- (triazen-1-il) imidazol-4-carboxamida (MTIC, la especie activa ); ácido temozolomida |
| Vida media de eliminación | 1,8 horas |
| Excreción | principalmente riñón |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.158.652 |
| Datos químicos y físicos | |
| Fórmula | C 6 H 6 N 6 O 2 |
| Masa molar | 194,154 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| Punto de fusion | 212 ° C (414 ° F) (descomp.) |
| |
| |
|
| |
La temozolomida ( TMZ ), que se vende bajo la marca Temodar entre otros, es un medicamento que se usa para tratar algunos tumores cerebrales como el glioblastoma multiforme o el astrocitoma anaplásico. Se toma por vía oral o por infusión intravenosa.
Los efectos secundarios más frecuentes de la temozolomida son náuseas (malestar), vómitos , estreñimiento , pérdida de apetito , alopecia (caída del cabello), dolor de cabeza , fatiga (cansancio), convulsiones (ataques), erupción cutánea , neutropenia o linfopenia (niveles bajos de sangre blanca). -células) y trombocitopenia (recuentos bajos de plaquetas en sangre). Las personas que reciben la solución para perfusión también pueden presentar reacciones en el lugar de la inyección, como dolor, irritación, picazón, calor, hinchazón y enrojecimiento, así como hematomas.
La temozolomida es un agente alquilante que se usa como tratamiento de algunos cánceres de cerebro; como tratamiento de segunda línea para el astrocitoma y tratamiento de primera línea para el glioblastoma multiforme . Olaparib en combinación con temozolomida demostró una actividad clínica sustancial en el cáncer de pulmón microcítico recidivante .
Usos médicos
En los Estados Unidos, la temozolomida está indicada para el tratamiento de adultos con glioblastoma multiforme recién diagnosticado de forma concomitante con radioterapia y posteriormente como tratamiento en monoterapia; o adultos con astrocitoma anaplásico refractario que han experimentado progresión de la enfermedad con un régimen farmacológico que contiene nitrosourea y procarbazina .
En la Unión Europea, la temozolomida está indicada para adultos con glioblastoma multiforme recién diagnosticado de forma concomitante con radioterapia y posteriormente como tratamiento en monoterapia; o niños a partir de los tres años, adolescentes y adultos con glioma maligno, como glioblastoma multiforme o astrocitoma anaplásico, que presenten recidiva o progresión después de la terapia estándar.
Contraindicaciones
La temozolomida está contraindicada en personas con hipersensibilidad a ella o al fármaco similar dacarbazina . No se recomienda el uso de temozolomida en personas con mielosupresión grave .
Efectos adversos
El efecto secundario más común es la supresión de la médula ósea . Los efectos adversos no hematológicos más comunes asociados con la temozolomida son náuseas y vómitos, que son autolimitados o se controlan fácilmente con la terapia antiemética estándar . Estos últimos efectos suelen ser de leves a moderados (grados 1 a 2). La incidencia de náuseas y vómitos intensos es de alrededor del 4% cada uno. Los pacientes con vómitos preexistentes o con antecedentes de vómitos intensos pueden requerir tratamiento antiemético antes de iniciar el tratamiento con temozolomida. La temozolomida debe administrarse en ayunas, al menos una hora antes de las comidas. La terapia antiemética se puede administrar antes o después de la administración de temozolomida.
La temozolomida es genotóxica , teratogénica y fetotóxica y no debe usarse durante el embarazo. Las mujeres lactantes deben suspender la lactancia mientras reciben el medicamento debido al riesgo de secreción en la leche materna. Un estudio indicó que las mujeres que han tomado temozolomida sin medidas concomitantes de preservación de la fertilidad logran un menor índice de embarazo más adelante en la vida, pero el estudio fue demasiado pequeño para mostrar significación estadística en la hipótesis de que la temozolomida conferiría un riesgo de infertilidad femenina . En pacientes masculinos, la temozolomida puede tener efectos genotóxicos. Se aconseja a los hombres que no engendren un hijo durante o hasta seis meses después del tratamiento y que busquen asesoramiento sobre la crioconservación de los espermatozoides antes del tratamiento, debido a la posibilidad de infertilidad irreversible debido al tratamiento con temozolomida.
En muy raras ocasiones, la temozolomida puede causar insuficiencia respiratoria aguda o daño hepático.
Interacciones
Dado que la temozolomida no se metaboliza en el hígado y tiene una baja afinidad por las proteínas plasmáticas , se espera que tenga un bajo potencial de interacciones. Un análisis de los datos de los pacientes no mostró interacciones con una variedad de otros medicamentos; la excepción es el ácido valproico , que ralentiza ligeramente la eliminación de temozolomida del organismo. La combinación del fármaco con otros mielosupresores puede aumentar el riesgo de mielosupresión.
Farmacología
Mecanismo de acción
El beneficio terapéutico de la temozolomida depende de su capacidad para alquilar / metilar el ADN, lo que ocurre con mayor frecuencia en las posiciones N-7 u O-6 de los residuos de guanina . Esta metilación daña el ADN y desencadena la muerte de las células tumorales. Sin embargo, algunas células tumorales son capaces de reparar este tipo de daño en el ADN, y por lo tanto disminuir la eficacia terapéutica de la temozolomida, mediante la expresión de una proteína de O 6 alquilguanina alquiltransferasa ADN (AGT) codificada en los seres humanos por la O metiltransferasa -6-metilguanina-DNA ( MGMT ) gen. En algunos tumores, el silenciamiento epigenético del gen MGMT evita la síntesis de esta enzima y, como consecuencia, dichos tumores son más sensibles a la muerte por temozolomida. Por el contrario, la presencia de la proteína AGT en los tumores cerebrales predice una respuesta deficiente a la temozolomida y estos pacientes reciben pocos beneficios de la quimioterapia con temozolomida.
Farmacocinética
La temozolomida se absorbe rápida y casi completamente en el intestino y penetra fácilmente la barrera hematoencefálica ; la concentración en el líquido cefalorraquídeo es del 30% de la concentración en el plasma sanguíneo . La ingesta con alimentos reduce las concentraciones plasmáticas máximas en un 33% y el área bajo la curva en un 9%. Solo el 15% (10-20%) de la sustancia se une a las proteínas del plasma sanguíneo. La temozolomida es un profármaco ; se hidroliza espontáneamente a pH fisiológico a 3-metil- (triazen-1-il) imidazol-4-carboxamida (MTIC). MTIC se divide en monometilhidrazina , probablemente el agente metilante activo, y 5-aminoimidazol-4-carboxamida (AIC). Otros metabolitos incluyen ácido temozolomida y sustancias hidrófilas no identificadas .
La vida media plasmática es de 1,8 horas. La sustancia y sus metabolitos se excretan principalmente a través de la orina.
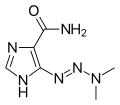
MTIC, el metabolito activo
AIC (parte del ribonucleótido AICA natural )
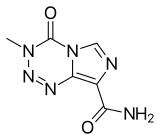
El fármaco relacionado dacarbazina para comparación.
Propiedades químicas
La temozolomida es un derivado de imidazotetrazina. Es ligeramente soluble en agua y ácidos acuosos y se descompone a 212 ° C (414 ° F). Recientemente se descubrió que la temozolomida es un explosivo, asignado provisionalmente como Clase 1 de la ONU .
Historia
El agente fue desarrollado por Malcolm Stevens y su equipo en la Universidad de Aston en Birmingham, Inglaterra .
Fue aprobado para uso médico en la Unión Europea en enero de 1999 y en los Estados Unidos en agosto de 1999. La formulación intravenosa fue aprobada en los Estados Unidos en febrero de 2009.
Investigar
Los estudios de laboratorio y los ensayos clínicos han comenzado a investigar la posibilidad de aumentar la potencia anticancerosa de la temozolomida combinándola con otros agentes farmacológicos. Por ejemplo, los ensayos clínicos han indicado que la adición de cloroquina podría ser beneficiosa para el tratamiento de pacientes con glioma . Los estudios de laboratorio encontraron que la temozolomida destruyó las células tumorales cerebrales de manera más eficiente cuando se agregó galato de epigalocatequina ( EGCG ), un componente del té verde ; sin embargo, la eficacia de este efecto aún no se ha confirmado en pacientes con tumores cerebrales . En 2010 se informaron estudios preclínicos sobre investigaciones sobre el uso del nuevo compuesto trans-crocetinato de sodio (TSC) que mejora la difusión de oxígeno cuando se combina con temozolomida y radioterapia, y en agosto de 2015 se estaba llevando a cabo un ensayo clínico.
Si bien los enfoques mencionados anteriormente han investigado si la combinación de temozolomida con otros agentes podría mejorar el resultado terapéutico, también se han iniciado esfuerzos para estudiar si la alteración de la molécula de temozolomida en sí misma puede aumentar su actividad. Uno de estos enfoques fusionó permanentemente alcohol perilílico , un compuesto natural con actividad terapéutica demostrada en pacientes con cáncer de cerebro, a la molécula de temozolomida. El nuevo compuesto resultante, llamado NEO212 o TMZ-POH, reveló una actividad anticancerígena que era significativamente mayor que la de cualquiera de sus dos moléculas originales, temozolomida y alcohol perilílico. Aunque a partir de 2016, NEO212 no se ha probado en humanos, ha demostrado una actividad terapéutica superior contra el cáncer en modelos animales de glioma , melanoma y metástasis cerebral de cáncer de mama triple negativo .
Debido a que las células tumorales que expresan el gen MGMT son más resistentes a los efectos de la temozolomida, los investigadores investigaron si la inclusión de O 6 -bencilguanina ( O 6 -BG), un inhibidor de AGT, podría superar esta resistencia y mejorar la eficacia terapéutica del fármaco. En el laboratorio, esta combinación mostró un aumento de la actividad de la temozolomida en cultivos de células tumorales in vitro y en modelos animales in vivo . Sin embargo, un ensayo clínico de fase II completado recientemente con pacientes con tumores cerebrales arrojó resultados mixtos; Si bien hubo alguna mejora en la actividad terapéutica cuando se administraron O 6 -BG y temozolomida a pacientes con glioma anaplásico resistente a temozolomida , no pareció haber una restauración significativa de la sensibilidad a temozolomida en pacientes con glioblastoma multiforme resistente a temozolomida .
Algunos esfuerzos se centran en la ingeniería de células madre hematopoyéticas que expresan el gen MGMT antes de trasplantarlas a pacientes con tumores cerebrales. Esto permitiría que los pacientes recibieran dosis más fuertes de temozolomida, ya que las células hematopoyéticas del paciente serían resistentes al fármaco.
Las dosis altas de temozolomida en los gliomas de grado alto tienen baja toxicidad, pero los resultados son comparables a las dosis estándar.
Ahora se han descrito dos mecanismos de resistencia a los efectos de la temozolomida: 1) resistencia intrínseca conferida por deficiencia de MGMT (MGMTd) y 2) resistencia intrínseca o adquirida a través de deficiencia de MMR (MMRd). La enzima MGMT es la primera línea de reparación de bases no emparejadas creadas por TMZ. Las células normalmente son competentes en MGMT (MGMTp) ya que tienen un promotor MGMT no metilado que permite que el gen se exprese normalmente. En este estado, el daño del ADN inducido por TMZ puede repararse eficazmente en las células tumorales (y en las células normales) mediante la enzima MGMT activa. Las células pueden crecer y atravesar el ciclo celular normalmente sin detenerse ni morir. Sin embargo, en algunos tumores, las células son deficientes en MGMT (MGMTd). Esto se debe más comúnmente a la metilación anormal del promotor del gen MGMT y la supresión de la expresión del gen. También se ha descrito que MGMTd se produce por transposición del promotor. En las células con MGMTd, el daño del ADN por TMZ activa la siguiente etapa de reparación en las células con un complejo enzimático de reparación de desajustes (MMRp) competente. En MMRp, el complejo de proteínas MMR identifica el daño y hace que las células se detengan y sufran la muerte, lo que inhibe el crecimiento del tumor. Sin embargo, si las células tienen una deficiencia combinada de MGMTd y MMR (MGMTd + MMRd), las células retienen las mutaciones inducidas y continúan su ciclo y son resistentes a los efectos de TMZ.
En gliomas y otros cánceres, se ha informado que la MMRd se presenta como MMRd primaria (bMMRd de Lynch intrínseca o de la línea germinal) o como MMRd secundaria (adquirida, no presente en el tumor original no tratado). Esto último ocurre después de un tratamiento eficaz y citorreducción de tumores con TMZ y luego la selección o inducción de proteínas y células mutantes MSH6, MSH2, MLH1 o PMS2 que son resistentes a MMRd y TMZ. Este último se describe como una vía de resistencia adquirida con mutaciones hotspot en pacientes con glioma (MSH6 p.T1219I). También es probable que existan otras vías de resistencia.
Referencias
Otras lecturas
- Kaloshi G, Benouaich-Amiel A, Diakite F y col. (Mayo de 2007). "Temozolomida para gliomas de bajo grado: impacto predictivo de la pérdida de 1p / 19q en la respuesta y el resultado" . Neurología . 68 (21): 1831–6. doi : 10.1212 / 01.wnl.0000262034.26310.a2 . PMID 17515545 . Lay resumen .
enlaces externos
- "Temozolomida" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
- "Temozolomida (Temodal)" . Cancer Research Reino Unido .