Oxígeno sólido - Solid oxygen
El oxígeno sólido se forma a presión atmosférica normal a una temperatura por debajo de 54,36 K (-218,79 ° C, -361,82 ° F). El oxígeno sólido O 2 , como el oxígeno líquido , es una sustancia clara con un color azul celeste claro causado por la absorción en la parte roja del espectro de luz visible.
Las moléculas de oxígeno han atraído la atención debido a la relación entre la magnetización molecular y las estructuras cristalinas , las estructuras electrónicas y la superconductividad . El oxígeno es la única molécula diatómica simple (y una de las pocas moléculas en general) que transporta un momento magnético . Esto hace que el oxígeno sólido sea particularmente interesante, ya que se considera un cristal de "giro controlado" que muestra un orden magnético antiferromagnético en las fases de baja temperatura. Las propiedades magnéticas del oxígeno se han estudiado ampliamente. A presiones muy altas, el oxígeno sólido cambia de un estado aislante a uno metálico ; ya muy bajas temperaturas, incluso se transforma a un estado superconductor . Las investigaciones estructurales del oxígeno sólido comenzaron en la década de 1920 y, en la actualidad, se establecen de manera inequívoca seis fases cristalográficas distintas .
La densidad del oxígeno sólido oscila entre 21 cm 3 / mol en la fase α y 23,5 cm 3 / mol en la fase γ.
Etapas

Se sabe que existen seis fases diferentes de oxígeno sólido:
- Fase α: azul claro - se forma a 1 atm, por debajo de 23,8 K, estructura cristalina monoclínica .
- fase β: azul tenue a rosa - se forma a 1 atm, por debajo de 43,8 K, estructura cristalina romboédrica (a temperatura ambiente y alta presión comienza la transformación en tetraoxígeno).
- Fase γ: azul tenue - se forma a 1 atm, por debajo de 54,36 K, estructura cristalina cúbica.
- fase δ: naranja - se forma a temperatura ambiente a una presión de 9 GPa
- Fase ε: rojo oscuro a negro : se forma a temperatura ambiente a presiones superiores a 10 GPa
- Fase ζ: metálica - se forma a presiones superiores a 96 GPa
Se sabe que el oxígeno se solidifica en un estado llamado fase β a temperatura ambiente mediante la aplicación de presión, y con un aumento adicional de la presión, la fase β experimenta transiciones de fase a la fase δ a 9 GPa y la fase ε a 10 GPa; y, debido al aumento de las interacciones moleculares , el color de la fase β cambia a rosa, naranja, luego rojo (la fase estable de octaoxígeno), y el color rojo se oscurece aún más a negro al aumentar la presión. Se encontró que aparece una fase ζ metálica a 96 GPa cuando el oxígeno de la fase ε se comprime más.
Oxigeno rojo
A medida que la presión de oxígeno a temperatura ambiente aumenta a 10 gigapascales (1,500,000 psi), experimenta una transición de fase dramática . Su volumen disminuye significativamente y cambia de color de celeste a rojo intenso. Sin embargo, este es un alótropo diferente de oxígeno , O
8, no simplemente una fase cristalina diferente de O 2 .
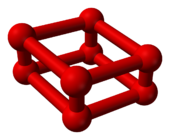 |

|
| Modelo de bola y palo de O 8 | Parte de la estructura cristalina del ε-oxígeno |
Oxígeno metálico
Una fase ζ aparece a 96 GPa cuando el oxígeno de la fase ε se comprime más. Esta fase se descubrió en 1990 presurizando oxígeno a 132 GPa. La fase ζ con racimo metálico exhibe superconductividad a presiones superiores a 100 GPa y una temperatura inferior a 0,6 K.
