Decavanadato de sodio - Sodium decavanadate
|
|

|
|
| Identificadores | |
|---|---|
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Número CE | |
|
PubChem CID
|
|
|
|
|
|
| Propiedades | |
| Na 6 [V 10 O 28 ] | |
| Masa molar | 1419,6 g |
| Apariencia | sólido naranja |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El decavanadato de sodio describe cualquier miembro de la familia de compuestos inorgánicos con la fórmula Na 6 [V 10 O 28 ] (H 2 O) n . Se trata de sales de sodio del anión decavanadato de color naranja [V 10 O 28 ] 6− . Se han aislado y estudiado muchas otras sales de decavanadato desde 1956, cuando se caracterizó por primera vez.
Preparación
La preparación de decavanadate se consigue por acidificación de una solución acuosa de orto vanadato :
- 10 Na 3 [VO 4 ] + 24 HOAc → Na 6 [V 10 O 28 ] + 12 H 2 O + 24 NaOAc
La formación de decavanadato se optimiza manteniendo un rango de pH de 4 a 7. Los productos secundarios típicos incluyen iones metavanadato, [VO 3 ] - y hexavanadato, [V 6 O 16 ] 2− .
Estructura
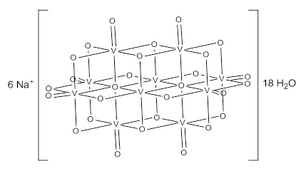
El ion decavanadato consta de 10 octaedros VO 6 fusionados y tiene simetría D 2h . La estructura de Na 6 [V 10 O 28 ] · 18H 2 O ha sido confirmado con la cristalografía de rayos X .
Los aniones decavanadato contienen tres conjuntos de átomos de V equivalentes (véase la figura 1). Estos incluyen dos octaedros VO 6 centrales (V c ) y cuatro grupos VO 5 tetragonales-piramidales periféricos (V a y V b ). Hay siete grupos únicos de átomos de oxígeno (etiquetados de la A a la G). Dos de estos (A) puentean seis centros V, cuatro (B) puentean tres centros V, catorce de estos (C, D y E) abarcan bordes entre pares de centros V, y ocho (F y G) son periféricos.
El estado de oxidación del vanadio en decavanadato es +5.
Propiedades ácido-base
Los compuestos de vanadato (V) acuosos se someten a diversas reacciones de autocondensación. Dependiendo del pH, los principales aniones de vanadato en solución incluyen VO 2 (H 2 O) 4 2+ , VO 4 3− , V 2 O 7 3− , V 3 O 9 3− , V 4 O 12 4− y V 10 O 28 6− . Los aniones suelen protonarse de forma reversible . Formas decavanadadas de acuerdo con este equilibrio:
- H 3 V 10 O 28 3− ⇌ H 2 V 10 O 28 4− + H +
- H 2 V 10 O 28 4− ⇌ HV 10 O 28 5− + H +
- HV 10 O 28 5− (aq) ⇌ V 10 O 28 6− + H +
La estructura de los diversos estados de protonación del ion decavanadate ha sido examinado por 51 espectroscopía V RMN . Cada especie da tres señales; con cambios químicos ligeramente variables alrededor de -425, -506 y -523 ppm en relación con el oxitricloruro de vanadio ; lo que sugiere que se produce un intercambio rápido de protones que da como resultado especies igualmente simétricas. Se ha demostrado que las tres protonaciones de decavanadato ocurren en los centros de oxígeno puente, indicados como B y C en la figura 1.
El decavanadato es más estable en la región de pH 4-7. Las soluciones de vanadato se vuelven de color naranja brillante a pH 6,5, lo que indica la presencia de decavanadato. Otros vanadatos son incoloros. Por debajo de pH 2,0, precipita V 2 O 5 marrón como hidrato.
- V 10 O 28 6− + 6H + + 12H 2 ⇌ 5 V 2 O 5
Usos potenciales
Se ha descubierto que el decavanadato inhibe la fosfoglicerato mutasa , una enzima que cataliza el paso 8 de la glucólisis . Además, se encontró que el decavandato tiene una modesta inhibición de la viabilidad de Leishmania tarentolae , lo que sugiere que el decavandato puede tener un uso potencial como inhibidor tópico de los parásitos protozoarios.
Decavanadatos relacionados
Se han caracterizado muchas sales de decavanadato. Las sales de NH 4 + , Ca 2+ , Ba 2+ , Sr 2+ y decavanadato del grupo I se preparan mediante la reacción ácido-base entre V 2 O 5 y el óxido, hidróxido, carbonato o hidrogenocarbonato del ión positivo deseado. .
- 6 NH 3 + 5 V 2 O 5 + 3 H 2 O ⇌ (NH 4 ) 6 [V 10 O 28 ]
Otros decavanadatos:
- (NH 4 ) 6 [V 10 O 28 ] · 6H 2 O
- K 6 [V 10 O 28 ] · 9H 2 O
- K 6 [V 10 O 28 ] · 10H 2 O
- Ca 3 [V 10 O 28 ] · 16H 2 O
- K 2 Mg 2 [V 10 O 28 ] · 16H 2 O
- K 2 Zn 2 [V 10 O 28 ] · 16H 2 O
- Cs 2 Mg 2 [V 10 O 28 ] · 16H 2 O
- Cs 4 Na 2 [V 10 O 28 ] · 10H 2 O
- K 4 Na 2 [V 10 O 28 ] · 16H 2 O
- Sr 3 [V 10 O 28 ] · 22H 2 O
- Ba 3 [V 10 O 28 ] · 19H 2 O
- [(C 6 H 5 ) 4 P] H 3 V 10 O 28 · 4CH 3 CN
- Ag 6 [V 10 O 28 ] · 4H 2 O
Los decavanadatos naturales incluyen:
- Ca 3 V 10 O 28 · 17 H 2 O ( Pascoite )
- Ca 2 Mg (V 10 O 28 ) · 16H 2 O ( Magnesiopascoita )
- Na 4 Mg (V 10 O 28 ) · 24H 2 O ( Huemulita )

