Bypass cardiopulmonar - Cardiopulmonary bypass
| Bypass cardiopulmonar | |
|---|---|
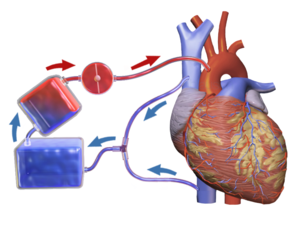
 Una máquina de circulación extracorpórea (parte superior derecha) en una cirugía de derivación de arteria coronaria .
| |
| ICD-9-CM | 39,61 |
| Malla | D002318 |
| Código OPS-301 | 14 |
| Otros códigos | 22570829 |
El bypass cardiopulmonar ( CEC ) es una técnica en la que una máquina asume temporalmente la función del corazón y los pulmones durante la cirugía , manteniendo la circulación de la sangre y el contenido de oxígeno del cuerpo del paciente. A la bomba de CPB en sí misma a menudo se la denomina máquina de circulación extracorpórea o "bomba". Las bombas de derivación cardiopulmonar son operadas por perfusionistas . La CPB es una forma de circulación extracorpórea . La oxigenación por membrana extracorpórea se utiliza generalmente para tratamientos a más largo plazo.
El CPB circula y oxigena mecánicamente la sangre para el cuerpo sin pasar por el corazón y los pulmones. Utiliza una máquina de circulación extracorpórea para mantener la perfusión a otros órganos y tejidos del cuerpo mientras el cirujano trabaja en un campo quirúrgico sin sangre. El cirujano coloca una cánula en la aurícula derecha, la vena cava o la vena femoral para extraer sangre del cuerpo. La sangre venosa se extrae del cuerpo mediante la cánula y luego se filtra, se enfría o se calienta y se oxigena antes de que vuelva al cuerpo mediante una bomba mecánica. La cánula utilizada para devolver la sangre oxigenada generalmente se inserta en la aorta ascendente, pero se puede insertar en la arteria femoral, arteria axilar o arteria braquiocefálica (entre otras).
Al paciente se le administra heparina para prevenir la coagulación y después se administra sulfato de protamina para revertir los efectos de la heparina. Durante el procedimiento, se puede mantener la hipotermia; La temperatura corporal generalmente se mantiene entre 28 ° C y 32 ° C (82,4–89,6 ° F). La sangre se enfría durante la CEC y se devuelve al cuerpo. La sangre enfriada ralentiza la tasa metabólica basal del cuerpo, disminuyendo su demanda de oxígeno. La sangre enfriada generalmente tiene una viscosidad más alta, pero la solución cristaloide utilizada para cebar el tubo de derivación diluye la sangre.
Usos
El bypass cardiopulmonar se usa comúnmente en operaciones que involucran el corazón. La técnica permite al equipo quirúrgico oxigenar y hacer circular la sangre del paciente, permitiendo así que el cirujano opere el corazón. En muchas operaciones, como el injerto de derivación de la arteria coronaria (CABG), el corazón se detiene (es decir, se detiene) debido a la dificultad de operar en el corazón que late. Las operaciones que requieren la apertura de las cámaras del corazón, por ejemplo, la reparación o el reemplazo de la válvula mitral , requieren el uso de CPB para evitar la ingestión de aire sistémicamente y para proporcionar un campo sin sangre para aumentar la visibilidad del cirujano. La máquina bombea la sangre y, utilizando un oxigenador, permite que los glóbulos rojos recojan oxígeno, además de permitir que disminuyan los niveles de dióxido de carbono. Esto imita la función del corazón y los pulmones, respectivamente.
El CPB se puede utilizar para la inducción de hipotermia corporal total , un estado en el que el cuerpo puede mantenerse durante hasta 45 minutos sin perfusión (flujo sanguíneo). Si el flujo sanguíneo se detiene a la temperatura corporal normal , el daño cerebral permanente ocurre normalmente en tres o cuatro minutos; la muerte puede sobrevenir poco después. De manera similar, el CPB se puede utilizar para calentar a las personas que padecen hipotermia . Este método de recalentamiento de CPB tiene éxito si la temperatura central del paciente es superior a 16 ° C.
La oxigenación por membrana extracorpórea ( ECMO ) es una versión simplificada de la máquina cardiopulmonar que incluye una bomba centrífuga y un oxigenador para asumir temporalmente la función del corazón y / o los pulmones. La ECMO es útil en pacientes postcirugía cardíaca con disfunción cardíaca o pulmonar, en pacientes con insuficiencia pulmonar aguda, embolias pulmonares masivas , traumatismo pulmonar por infecciones y una variedad de otros problemas que deterioran la función cardíaca o pulmonar. La ECMO le da tiempo al corazón y / o pulmones para repararse o recuperarse, pero es solo una solución temporal. Los pacientes con enfermedades terminales, cáncer, daño severo del sistema nervioso, sepsis incontrolada y otras condiciones pueden no ser candidatos para ECMO.
Procedimientos quirúrgicos en los que se utiliza el bypass cardiopulmonar
- Cirugía de bypass de la arteria coronaria
- Reparación y / o reemplazo de válvulas cardíacas ( válvula aórtica , válvula mitral , válvula tricúspide , válvula pulmonar )
- Reparación de grandes septales defectos ( defecto septal auricular , ventricular septal defecto , auriculoventricular septal defecto )
- Reparación y / o paliación de cardiopatías congénitas ( tetralogía de Fallot , transposición de los grandes vasos )
- Trasplante ( trasplante de corazón , trasplante de pulmón , trasplante de corazón-pulmón , el trasplante de hígado )
- Reparación de algunos aneurismas grandes ( aneurismas aórticos , aneurismas cerebrales )
- Tromboendarterectomía pulmonar
- Trombectomía pulmonar
- Perfusión de extremidades aisladas
Contraindicaciones y consideraciones especiales.
No existen contraindicaciones absolutas para el bypass cardiopulmonar. Sin embargo, hay varios factores que deben ser considerados por el equipo de atención al planificar una operación.
La trombocitopenia inducida por heparina (HIT) y la trombocitopenia y trombosis inducida por heparina (HITT) son afecciones potencialmente mortales asociadas con la administración de heparina. En HIT o HITT, se forman anticuerpos contra la heparina que provoca la activación plaquetaria y la formación de coágulos sanguíneos . Debido a que la heparina se usa típicamente en la CEC, los pacientes que se sabe que tienen los anticuerpos responsables de HIT y HITT requieren formas alternativas de anticoagulación. La bivalirudina es la alternativa a la heparina más estudiada en pacientes con HIT o HITT que requieren CEC.
Un pequeño porcentaje de pacientes, como aquellos con deficiencia de antitrombina III , pueden presentar resistencia a la heparina. En estos pacientes, los pacientes pueden necesitar heparina adicional, plasma fresco congelado u otros hemoderivados, como antitrombina III recombinante, para lograr una anticoagulación adecuada.
Una vena cava superior izquierda persistente (PLSVC) es una variación del sistema torácico en la que la vena cava del lado izquierdo no involuciona durante el desarrollo normal. Es la variación más común del sistema venoso torácico y ocurre en aproximadamente el 0,3% de la población. La anomalía a menudo se detecta en estudios de imágenes preoperatorios, pero también se puede descubrir durante la operación. Una PLSVC puede dificultar el drenaje venoso adecuado o la liberación de cardiopledgia retrógrada. El manejo de un PLSVC durante la CEC depende de factores como el tamaño y el sitio de drenaje del PSLVC.
Riesgos y complicaciones
| Complicación | Incidencia (eventos / 1000) |
Muerte o lesión grave (%) |
|---|---|---|
| Reacción de protamina | 1.3 | 10,5 |
| Trombosis | 0,3–0,4 | 2.6–5.2 |
| Disección aórtica | 0,4-0,8 | 14.3–33.1 |
| Embolia gaseosa | 0,2-1,3 | 0,2–8,7 |
| Embolia gaseosa sistémica masiva | 0.03–0.07 | 50–52 |
| Desplazamiento de la cánula (causando sangrado masivo) | 0,2-1,6 | 4.2–7.1 |
| El síndrome de dificultad respiratoria aguda | - | - |
| Arritmias | - | - |
| Síndrome de fuga capilar | - | - |
| Hemólisis | - | - |
| Síndrome de posperfusión (" cabeza de bomba") | - | - |
La CPB no es benigna y existen varios problemas asociados. Como consecuencia, el CPB solo se usa durante las varias horas que puede llevar una cirugía cardíaca. Se sabe que la CPB activa la cascada de la coagulación y estimula los mediadores inflamatorios, lo que conduce a hemólisis y coagulopatías. Este problema empeora a medida que las proteínas del complemento se acumulan en los oxigenadores de membrana. Por esta razón, la mayoría de los oxigenadores vienen con la recomendación del fabricante de que solo se usen durante un máximo de seis horas, aunque a veces se usan hasta diez horas, con cuidado de que no se coagulen y dejen de funcionar. Durante períodos más prolongados, se utiliza una ECMO (oxigenación por membrana extracorpórea), que puede estar en funcionamiento hasta 31 días, como en un caso taiwanés, durante 16 días, después de lo cual el paciente recibió un trasplante de corazón.
La complicación más común asociada con la CEC es una reacción de protamina durante la reversión de la anticoagulación. Hay tres tipos de reacciones a la protamina, y cada una puede causar hipotensión potencialmente mortal (tipo I), anafilaxia (tipo II) o hipertensión pulmonar (tipo III). Los pacientes con exposición previa a la protamina, como los que han tenido una vasectomía previa (la protamina está contenida en el esperma) o los diabéticos (la protamina está contenida en las formulaciones de insulina neutra de protamina hagedorn (NPH)), tienen un mayor riesgo de reacciones a la protamina tipo II. debido a la sensibilidad cruzada. Debido a que la protamina es un fármaco de acción rápida, por lo general se administra lentamente para permitir el seguimiento de posibles reacciones. El primer paso en el manejo de una reacción de protamina es detener inmediatamente la infusión de protamina. Los corticosteroides se utilizan para todo tipo de reacciones de protamina. La clorfenamina se usa para reacciones de tipo II (anafilácticas). Para las reacciones de tipo III, se vuelve a administrar la heparina y es posible que el paciente deba volver a la derivación.
La CPB puede contribuir al deterioro cognitivo inmediato. El sistema de circulación sanguínea corazón-pulmón y la propia cirugía de conexión liberan una variedad de desechos en el torrente sanguíneo, incluidos fragmentos de glóbulos, tubos y placa. Por ejemplo, cuando los cirujanos pinzan y conectan la aorta al tubo, los émbolos resultantes pueden bloquear el flujo sanguíneo y causar mini accidentes cerebrovasculares. Otros factores de la cirugía cardíaca relacionados con el daño mental pueden ser eventos de hipoxia, temperatura corporal alta o baja, presión arterial anormal, ritmos cardíacos irregulares y fiebre después de la cirugía.
Componentes
El bypass cardiopulmonar consta de dos unidades funcionales principales, la bomba y el oxigenador que extrae sangre relativamente pobre en oxígeno del cuerpo de un paciente y la reemplaza con sangre rica en oxígeno a través de una serie de tubos (mangueras). Se utiliza un intercambiador de calor para controlar la temperatura corporal calentando o enfriando la sangre en el circuito. Es importante que todos los componentes del circuito estén recubiertos internamente por heparina u otro anticoagulante para evitar la coagulación dentro del circuito.
Tubería
Los componentes del circuito CPB están interconectados por una serie de tubos de caucho de silicona o PVC .
Zapatillas
Bomba centrífuga
Muchos circuitos de CPB ahora emplean una bomba centrífuga para el mantenimiento y control del flujo sanguíneo durante la CPB. Al alterar la velocidad de revolución (RPM) del cabezal de la bomba, el flujo sanguíneo se produce por la fuerza centrífuga . Muchos consideran que este tipo de acción de bombeo es superior a la acción de la bomba de rodillos porque se cree que previene la sobrepresurización, pinzamiento o torsión de las líneas y produce menos daño a los productos sanguíneos ( hemólisis , etc.).
Bomba de rodillos
La consola de la bomba generalmente comprende varias bombas rotativas impulsadas por motor que "masajean" los tubos peristálticamente . Esta acción impulsa suavemente la sangre a través del tubo. Esto se conoce comúnmente como bomba de rodillos o bomba peristáltica . Las bombas son más asequibles que sus homólogas centrífugas, pero son susceptibles a la sobrepresurización si las líneas se sujetan o se retuercen. También es más probable que provoquen una embolia gaseosa masiva y requieran una supervisión estrecha y constante por parte del perfusionista.
Oxigenador
El oxigenador está diseñado para agregar oxígeno a la sangre infundida y eliminar parte del dióxido de carbono de la sangre venosa . La cirugía cardíaca fue posible gracias a la CEC mediante el uso de oxigenadores de burbujas , pero los oxigenadores de membrana han reemplazado a los oxigenadores de burbujas desde la década de 1980. Las principales razones de esto son que los oxigenadores de membrana tienden a generar muchas menos microburbujas, denominadas microembolias gaseosas, que generalmente se consideran perjudiciales para el paciente y reducen el daño a las células sanguíneas, en comparación con los oxigenadores de burbujas . Más recientemente, se ha generalizado el uso de oxigenadores de fibra hueca. Estos derivados de oxigenadores de membrana reducen aún más la aparición de microemboli al reducir la interfase directa aire-sangre al mismo tiempo que proporcionan un intercambio de gases adecuado.
Otro tipo de oxigenador que está ganando popularidad recientemente es el oxigenador de sangre recubierto de heparina, que se cree que produce menos inflamación sistémica y disminuye la propensión a que la sangre se coagule en el circuito de CPB.
Intercambiadores de calor
Debido a que la hipotermia se usa con frecuencia en la CEC para reducir las demandas metabólicas (incluida la del corazón), los intercambiadores de calor se implementan para calentar y enfriar la sangre dentro del circuito. El calentamiento y enfriamiento se logra pasando la línea a través de un baño de agua tibia o con hielo. Se requiere un intercambiador de calor separado para la línea de cardiopledgia.
Cánulas
Se cosen múltiples cánulas en el cuerpo del paciente en una variedad de ubicaciones, según el tipo de cirugía. Una cánula venosa elimina la sangre venosa sin oxígeno del cuerpo de un paciente. Una cánula arterial infunde sangre rica en oxígeno en el sistema arterial. Los principales determinantes de la selección del tamaño de la cánula están determinados por el tamaño y el peso del paciente, la velocidad de flujo anticipada y el tamaño del vaso que se canula. Una cánula de cardioplejía administra una solución de cardioplejía para hacer que el corazón deje de latir.
Algunos sitios de canulación de uso común:
| Venoso | Arterial | Cardioplejía |
|---|---|---|
| Aurícula derecha | Aorta proximal , distal a la pinza cruzada | Aorta proximal , proximal a la pinza cruzada |
| Vena cavae | Arteria femoral | Seno coronario (parto retrógrado) |
| Vena femoral | Arteria axilar | Ostia coronaria |
| Aorta distal | Injertos de derivación (durante CABG ) | |
| Ápice del corazón |
Cardioplejía
La cardiopledgia es una solución líquida que se usa para proteger el corazón durante la CEC. Se administra mediante una cánula a la abertura de las arterias coronarias (generalmente a través de la raíz aórtica) y / o a las venas cardíacas (a través del seno coronario). Estos métodos de administración se denominan anterógrado y retrógrado, respectivamente. La solución de cardiopledgia protege el corazón deteniendo (es decir, deteniendo) el corazón, disminuyendo así su demanda metabólica. Hay varios tipos de soluciones de cardiopledgia, pero la mayoría funcionan inhibiendo las corrientes rápidas de sodio en el corazón, evitando así la conducción del potencial de acción . Otros tipos de soluciones actúan inhibiendo las acciones del calcio sobre los miocitos .
Técnica
Planificación preoperatoria
La CPB requiere una previsión significativa antes de la cirugía. En particular, las estrategias de canulación, enfriamiento y cardioprotección deben coordinarse entre el cirujano , el anestesiólogo , el perfusionista y el personal de enfermería .
Estrategia de canulación
La estrategia de canulación varía según varios detalles específicos de la operación y del paciente. La canulación arterial típica implica la colocación de una única canulación dentro de la aorta ascendente distal . La forma más simple implica la colocación de una sola cánula (conocida como cánula de doble etapa) que se pasa a través de la aurícula derecha y hacia la vena cava inferior . En algunas operaciones, como las que involucran la válvula tricúspide o mitral , se utilizan dos cánulas: una se pasa a través de la vena cava inferior y la otra a través de la vena cava superior . Esto se conoce como canulación de una sola etapa.
Técnica intraoperatoria
Se debe cebar un circuito de CEC con líquido y eliminar todo el aire de la línea / cánula arterial antes de conectarlo al paciente. El circuito se ceba con una solución cristaloide y, a veces, también se agregan productos sanguíneos. Antes de la canulación (generalmente después de abrir el pericardio cuando se usa una canulación central), se administra heparina u otro anticoagulante hasta que el tiempo de coagulación activado sea superior a 480 segundos.
Se inspecciona el sitio de canulación arterial en busca de calcificación u otra enfermedad. Se pueden usar imágenes preoperatorias o una sonda de ultrasonido para ayudar a identificar las calcificaciones aórticas que potencialmente podrían desprenderse y causar una oclusión o un accidente cerebrovascular . Una vez que el sitio de canulación se considera seguro, se colocan dos suturas concéntricas en jareta en forma de diamante en la aorta ascendente distal. Se hace una incisión de puñalada con un bisturí dentro de las jaretas y se pasa la cánula arterial a través de la incisión. Es importante que la cánula se pase perpendicular a la aorta para evitar crear una disección aórtica . Las suturas en bolsa se ceñen alrededor de la cánula con un torniquete y se aseguran a la cánula. En este punto, el perfusionista avanza la línea arterial del circuito de CEC y el cirujano conecta la línea arterial que viene del paciente a la línea arterial que viene de la máquina de CEC. Se debe tener cuidado para asegurarse de que no haya aire en el circuito cuando los dos están conectados, o de lo contrario el paciente podría sufrir una embolia gaseosa . Otros sitios para la canulación arterial incluyen la arteria axilar , la arteria braquiocefálica o la arteria femoral .
Aparte de las diferencias en la ubicación, la canulación venosa se realiza de manera similar a la canulación arterial. Dado que la calcificación del sistema venoso es menos común, la inspección o el uso de una ecografía para la calcificación en los sitios de canulación es innecesaria. Además, debido a que el sistema venoso está bajo mucha menos presión que el sistema arterial, solo se requiere una sutura para mantener la cánula en su lugar. Si solo se va a utilizar una cánula única (canulación de dos etapas), se pasa a través del apéndice auricular derecho , a través de la válvula tricúspide y hacia la vena cava inferior. Si se requieren dos cánulas (canulación de una sola etapa), la primera normalmente se pasa a través de la vena cava superior y la segunda a través de la vena cava inferior. La vena femoral también puede canularse en pacientes seleccionados.
Si es necesario detener el corazón para la operación, también se requieren cánulas de cardioplejía . Cardiopledgia anterógrada (flujo hacia adelante, a través de las arterias del corazón), cardiopledgia retrógrada (flujo hacia atrás, a través de las venas del corazón), o ambos tipos se pueden utilizar dependiendo de la operación y preferencia del cirujano. Para la cardiopledgia anterógrada, se hace una pequeña incisión en la aorta proximal al sitio de canulación arterial (entre el corazón y el sitio de canulación arterial) y se coloca la cánula a través de este para administrar cardiopledgia a las arterias coronarias . Para la cardiopledgia retrógrada, se hace una incisión en la superficie posterior (posterior) del corazón a través del ventrículo derecho . La cánula se coloca en esta incisión, se pasa a través de la válvula tricúspide y se introduce en el seno coronario . Las líneas de cardiopledgia están conectadas a la máquina CPB.
En este punto, el paciente está listo para realizar la derivación. La sangre de la (s) cánula (s) venosa (s) ingresa a la máquina de CPB por gravedad, donde se oxigena y se enfría (si es necesario) antes de regresar al cuerpo a través de la cánula arterial. Ahora se puede administrar cardiopledgia para detener el corazón, y se coloca una pinza cruzada a través de la aorta entre la cánula arterial y la cánula de cardiopledgia para evitar que la sangre arterial fluya hacia atrás hacia el corazón.
Una vez que el paciente está listo para retirarse del soporte de derivación, se retiran la abrazadera cruzada y las cánulas y se administra sulfato de protamina para revertir los efectos anticoagulantes de la heparina.
Historia

El fisiólogo austriaco-alemán Maximilian von Frey construyó un prototipo temprano de una máquina corazón-pulmón en 1885 en el Instituto Fisiológico Carl Ludwig de la Universidad de Leipzig . Sin embargo, estas máquinas no eran factibles antes del descubrimiento de la heparina en 1916, que previene la coagulación de la sangre . El científico soviético Sergei Brukhonenko desarrolló una máquina de circulación extracorpórea para la perfusión corporal total en 1926 que se utilizó en experimentos con caninos. Un equipo de científicos de la Universidad de Birmingham (incluido Eric Charles, un ingeniero químico) estuvo entre los pioneros de esta tecnología.
El Dr. Clarence Dennis dirigió el equipo del Centro Médico de la Universidad de Minnesota que, el 5 de abril de 1951, llevó a cabo la primera operación humana con cardiotomía abierta con control mecánico temporal de las funciones cardíaca y pulmonar. El paciente no sobrevivió debido a un defecto cardíaco congénito complejo inesperado. Un miembro del equipo fue el Dr. Russell M. Nelson , quien luego se convirtió en presidente de La Iglesia de Jesucristo de los Santos de los Últimos Días y quien realizó la primera cirugía a corazón abierto en Utah .
El primer soporte mecánico exitoso de la función ventricular izquierda fue realizado el 3 de julio de 1952 por Forest Dewey Dodrill utilizando una máquina desarrollada conjuntamente con General Motors, la Dodrill-GMR . La máquina se utilizó más tarde para apoyar la función del ventrículo derecho.
El primer procedimiento a corazón abierto con éxito en un ser humano que utiliza la máquina corazón-pulmón se llevó a cabo por John Gibbon y Frank F. Allbritten, Jr. el 6 de mayo de 1953 en el Hospital de la Universidad Thomas Jefferson en Filadelfia . Repararon un defecto del tabique auricular en una mujer de 18 años. La máquina de Gibbon fue desarrollada aún más en un instrumento confiable por un equipo quirúrgico dirigido por John W. Kirklin en la Clínica Mayo en Rochester, Minnesota, a mediados de la década de 1950.
El oxigenador fue conceptualizado por primera vez en el siglo XVII por Robert Hooke y desarrollado en prácticos oxigenadores extracorpóreos por fisiólogos experimentales franceses y alemanes en el siglo XIX. Los oxigenadores de burbujas no tienen una barrera intermedia entre la sangre y el oxígeno, se denominan oxigenadores de "contacto directo". Los oxigenadores de membrana introducen una membrana permeable al gas entre la sangre y el oxígeno que reduce el trauma sanguíneo de los oxigenadores de contacto directo. Gran parte del trabajo desde la década de 1960 se centró en superar la desventaja del intercambio de gases de la barrera de la membrana, lo que llevó al desarrollo de oxigenadores microporosos de fibra hueca de alto rendimiento que eventualmente reemplazaron a los oxigenadores de contacto directo en los quirófanos.
En 1983, Ken Litzie patentó un sistema de bypass cardíaco de emergencia cerrado que redujo la complejidad del circuito y los componentes. Este dispositivo mejoró la supervivencia del paciente después de un paro cardíaco porque podría implementarse rápidamente en entornos no quirúrgicos.
Referencias
enlaces externos
- Consorcio internacional para la perfusión basada en evidencia
- CircuitSurfers: Blog de perfusión sobre bypass cardiopulmonar
- Hessel EA, Edmunds LH (2003). "Circulación extracorpórea: sistemas de perfusión" . En Cohn LH, Edmunds LH (eds.). Cirugía cardíaca en el adulto . Nueva York: McGraw-Hill. págs. 317–38. Archivado desde el original el 10 de diciembre de 2006 . Consultado el 9 de diciembre de 2006 .
- Manual Multimedia de Cirugía Cardiotorácica. Recolección de bypass cardiopulmonar.
- Profiles in Science: The Clarence Dennis Papers Artículos seleccionados de Clarence Dennis, al que se le atribuye el primer intento de cirugía de bypass cardiopulmonar.