Barrelene - Barrelene
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Biciclo [2.2.2] octa-2,5,7-trieno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 8 H 8 | |||
| Masa molar | 104.15 | ||
| Densidad | 1.013 g / mL | ||
| Punto de ebullición | 153,7 ° C (308,7 ° F; 426,8 K) | ||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El barreleno es un compuesto orgánico bicíclico con fórmula química C 8 H 8 y nombre sistemático biciclo [2.2.2] octa-2,5,7-trieno. Sintetizado y descrito por primera vez por Howard Zimmerman en 1960, el nombre deriva de la semejanza con un barril , siendo las duelas tres unidades de etileno unidas a dos grupos de metino . Es el aducto formal de Diels-Alder de benceno y acetileno . Debido a su geometría molecular inusual , el compuesto es de considerable interés para los químicos teóricos.
Los iptícenos , con los grupos alqueno como parte de un arenos , son compuestos relacionados. También es un material de partida para muchos otros compuestos orgánicos, como el semibullvaleno .
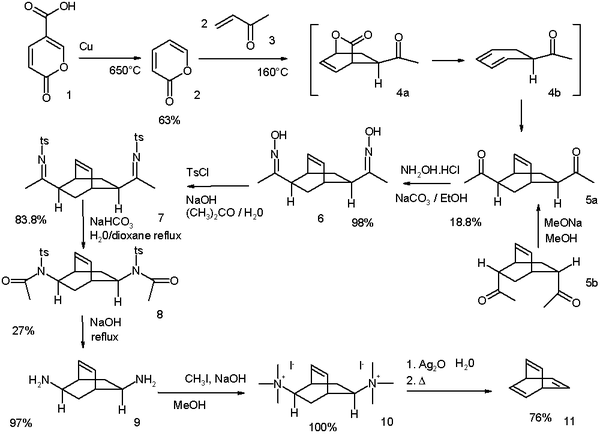
El Zimmerman original, síntesis modificada en 1969, parte del ácido coumálico :
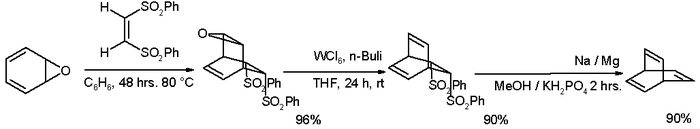
Desde entonces se han ideado muchas rutas alternativas, una de ellas a partir de la oxepina :
También se ha informado de una ruta alternativa que permite la síntesis del sistema de barreleno original y una variedad de barrelenos sustituidos.
Reacciones de Barrelene
El barreleno se hidrogena con hidrógeno gaseoso y el catalizador de Adams en etanol para dar biciclo [2.2.2] -octano completamente saturado . La bromación con bromo en tetraclorometano da un aducto de bromo porque interviene una reacción de acoplamiento :
La epoxidación de barrelene con oxona da la trioxatrishomobarrelene que en el reordenamiento con trifluoruro de boro (fuerza de accionamiento: alivio de energía de deformación ) se convierte en el trioxatrishomocubane:
Este compuesto se puede imaginar como un cubano con tres átomos de oxígeno insertados en tres bordes opuestos o como un 9-corona-3 coronado por dos unidades de metino . La molécula es quiral y se han aislado los enantiómeros separados .
Ciertos barrelenos se han utilizado como monómero en una polimerización por metátesis de apertura de anillo :
El catalizador es un carbeno de Fischer (un catalizador de bis- (hexafluoro-terc-butoxi) carbeno de molibdeno ) y la cadena de alquilo larga unida al monómero es necesaria para la solubilidad. La oxidación del polímero con DDQ produce el colgante de naftaleno de poli (p-fenileno vinileno) .
Las soluciones de isopentano de barreleno se someten a isomerización fotolítica cuando se añade acetona como fotosensibilizador para producir semibullvaleno . La irradiación prolongada da como resultado una isomerización adicional para formar ciclooctatetraeno .
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: Recomendaciones y nombres preferidos de la IUPAC 2013 . La Real Sociedad de Química . pag. 1257. doi : 10.1039 / 9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Síntesis y propiedades físicas de barrelene, una molécula única similar a Möbius Howard E. Zimmerman, Gary L. Grunewald, Robert M. Paufler, Maynard A. Sherwin J. Am. Chem. Soc. ; 1969 ; 91 (9); 2330–2338. doi : 10.1021 / ja01037a024
- ^ Esquema de reacción: la descarboxilación del ácido coumálico (1) tiene lugar a 650 ° C con cobre para dar α- pirona (2). La reacción con metil vinil cetona (3) es un tándem de Diels-Alder / secuencia / retro-Diels-Alder de Diels-Alder, que produce di- cetona 5 como una mezcla de dos isómeros . Es posible convertir el isómero endo 5b en el isómero exo 5a mediante un proceso de epimerización a través del enol . Los grupos cetona se convierten en grupos oxima en 6 por reacción con hidroxilamina y luego en grupos tosilato en 7 por reacción con cloruro de tosilo . Un básico transposición de Beckmann toma el esquema para dar amida 8 y su hidrólisis a la di- amina 9 se lleva a cabo con hidróxido de sodio . Finalmente, una eliminación de Hofmann a través de la sal de amonio 10 da el barreleno 11.
- ^ Barrelene, una nueva síntesis conveniente Sergio Cossu, Simone Battaggia y Ottorino De Lucchi J. Org. Chem. ; 1997 ; 62 (12) págs. 4162–4163; doi : 10.1021 / jo962267f
- ^ El primer paso de esta reacción entre oxepina (uno de los posibles tautómeros ) con ( Z ) -1,2-bis (fenilsulfonil) etileno es una reacción de Diels-Alder . Los reactivos para la desoxidación son hexacloruro de tungsteno y butillitio . La segunda reacción de eliminación tiene lugar con amalgama de sodio en el estilo de olefinación de Julia .
- ^ Síntesis de biciclo [2.2.2] octatrienos sustituidos Michael W. Wagaman, Erika Bellmann, Michèle Cucullu y Robert H. Grubbs J. Org. Chem. ; 1997 ; 62 (26) págs. 9076–9082; doi : 10.1021 / jo971039y
- ^ endo, exo, syn-3,7,10-trioxapentaciclo [3.3.3.0 2,4 .0 6,8 .0 9,11 ] undecano
- ^ 4,7,11-Triheterotrishomocubanes - Moléculas quirales altamente simétricas en forma de hélice derivadas de Barrelene Sergei I. Kozhushkov et al. European Journal of Organic Chemistry Volumen 2006 , Número 11, Páginas 2590-2600 Resumen
- ^ Síntesis de poli (1,4-naphthylenevinylenes): La metátesis Polimerización de Benzobarrelenes Lin Pu, Michael W. Wagaman, y Robert H. Grubbs macromoléculas ; 1996 ; 29 (4) págs. 1138-1143; (Artículo) doi : 10.1021 / ma9500143
- ^ Síntesis de Orgánica y soluble en agua de poli (1,4-phenylenevinylenes) que contienen grupos carboxilo: Living apertura de anillo de metátesis de polimerización (ROMP) de 2,3-Dicarboxybarrelenes Michael W. Wagaman, y Robert H. Grubbs macromoléculas ; 1997 ; 30 (14) págs. 3978–3985; (Artículo) doi : 10.1021 / ma9701595
- ^ Zimmerman, ÉL; Grunewald, GL (1966). "La química de Barrelene. III. Una fotoisomerización única a Semibullvalene". Mermelada. Chem. Soc. 88 (1): 183–184. doi : 10.1021 / ja00953a045 .