Neurogénesis adulta - Adult neurogenesis

La neurogénesis adulta es el proceso por el cual se generan neuronas a partir de células madre neurales en el adulto. Este proceso difiere de la neurogénesis prenatal .
En la mayoría de los mamíferos, nacen nuevas neuronas durante la edad adulta en dos regiones del cerebro:
- La zona subgranular (SGZ), parte de la circunvolución dentada del hipocampo , donde las células madre neurales dan a luz a las células granulares (implicadas en la formación de la memoria y el aprendizaje).
- La zona subventricular (SVZ) de los ventrículos laterales , que se puede dividir en tres microdominios: lateral, dorsal y medial. Las células madre neurales migran al bulbo olfatorio a través de la corriente migratoria rostral donde se diferencian en interneuronas que participan en el sentido del olfato . En los seres humanos, sin embargo, pocas o ninguna neuronas del bulbo olfatorio se generan después del nacimiento.
Se ha prestado más atención a la neurogénesis en la circunvolución dentada que en el estriado . En los roedores , muchas de las neuronas de la circunvolución dentada del recién nacido mueren poco después de nacer, pero algunas de ellas se integran funcionalmente en el tejido cerebral circundante. El número de neuronas que nacen en el hipocampo humano sigue siendo controvertido; algunos estudios han informado que en humanos adultos se agregan alrededor de 700 nuevas neuronas en el hipocampo cada día, mientras que otros estudios muestran que la neurogénesis del hipocampo adulto no existe en humanos o, si existe, está en niveles indetectables. Por tanto, el papel de las nuevas neuronas en la función del cerebro adulto sigue sin estar claro. Se informa que la neurogénesis adulta desempeña un papel en el aprendizaje y la memoria, las emociones, el estrés, la depresión, la respuesta a las lesiones y otras afecciones.
Mecanismo
Células madre neurales adultas
Las células madre neurales (NSC, por sus siglas en inglés) son células multipotentes y autorrenovables que generan los principales fenotipos del sistema nervioso .
Reprogramación de linaje (transdiferenciación)
La evidencia emergente sugiere que los pericitos microvasculares neurales, bajo la instrucción de las células gliales residentes, se reprograman en interneuronas y enriquecen los microcircuitos neuronales locales. Esta respuesta se amplifica por la angiogénesis concomitante .
Organismos modelo de neurogénesis
Planaria
Las planarias son uno de los primeros organismos modelo utilizados para estudiar la regeneración con Pallas como el antepasado de los estudios planarios. Las planarias son un modelo clásico de invertebrados que en las últimas décadas se han utilizado para examinar la neurogénesis. El sistema nervioso central de una planaria es simple, aunque completamente formado con dos lóbulos ubicados en la cabeza y dos cordones nerviosos ventrales . Este modelo se reproduce asexualmente produciendo un sistema nervioso completo y en pleno funcionamiento después de la división, lo que permite un examen constante de la neurogénesis.
Ajolote
El axolotl se usa con menos frecuencia que otros vertebrados, pero sigue siendo un modelo clásico para examinar la regeneración y la neurogénesis. Aunque el axolotl se ha hecho un hueco en la investigación biomédica en términos de regeneración de extremidades, el organismo modelo ha mostrado una sólida capacidad para generar nuevas neuronas después del daño. Los axolotl han contribuido como un organismo puente entre invertebrados y mamíferos, ya que la especie tiene la capacidad regenerativa para experimentar una neurogénesis completa formando una amplia gama de poblaciones neuronales que no se limitan a un nicho pequeño, sin embargo, la complejidad y la arquitectura son complejas y análogas en muchos sentidos a desarrollo neuronal humano.
Pez cebra
El pez cebra ha sido durante mucho tiempo un modelo de desarrollo clásico debido a su transparencia durante la organogénesis y se ha utilizado mucho en la neurogénesis del desarrollo temprano). El pez cebra muestra una fuerte capacidad neurogenerativa capaz de regenerar una variedad de tejidos y una diversidad neuronal completa (con la excepción de los astrocitos , ya que aún no se han identificado dentro del cerebro del pez cebra) con neurogénesis continua a lo largo de la vida. En las últimas décadas, el modelo ha solidificado su papel en la regeneración y neurogénesis de adultos después de un daño. El pez cebra, como el ajolote, ha jugado un papel clave como organismo puente entre invertebrados y mamíferos. El pez cebra es un organismo de rápido desarrollo que es relativamente económico de mantener, a la vez que proporciona al campo facilidad de manipulación genética y un sistema nervioso complejo.
Polluelo
Aunque las aves se han utilizado principalmente para estudiar el desarrollo embrionario temprano, en las últimas décadas el polluelo en desarrollo ha desempeñado un papel fundamental en el examen de la neurogénesis y la regeneración, ya que el polluelo joven es capaz de recambio neuronal a una edad temprana, pero pierde la capacidad neurogenerativa. en la edad adulta. La pérdida de la capacidad neuroregenerativa durante la maduración ha permitido a los investigadores examinar más a fondo los reguladores genéticos de la neurogénesis.
Roedores
Los roedores , ratones y ratas, han sido el organismo modelo más destacado desde el descubrimiento de las neuronas modernas por Santiago Ramón y Cajal . Los roedores tienen una arquitectura muy similar y un sistema nervioso complejo con muy poca capacidad regenerativa similar al que se encuentra en los humanos. Por esa razón, los roedores se han utilizado mucho en las pruebas preclínicas . Los roedores muestran una amplia gama de circuitos neuronales responsables de comportamientos complejos, lo que los hace ideales para estudios de poda dendrítica y cizallamiento axonal. Si bien el organismo es un análogo humano fuerte, el modelo tiene sus limitaciones que no se encuentran en los modelos anteriores: mayor costo de mantenimiento, menor número de reproductores y capacidades neurogenerativas limitadas.
Hasta cierto punto, la neurogénesis adulta en roedores puede ser inducida por la interrupción selectiva de la señalización de Notch en los astrocitos : esto produce nuevas neuronas que se integran funcionalmente en el circuito estriatal .
Pulpo
También conocido como pulpo común , cefalópodo , este organismo tiene un intrincado sistema nervioso que demuestra la capacidad del cerebro para producir nuevas células. En este caso y en otros taxones en comparación, estos organismos se adaptan a entornos impredecibles mediante el uso de células cerebrales recién formadas. Esto es durante un período de vida corto (la hembra alrededor de un año) donde los pulpos comunes silvestres concentran la mayor parte de su energía en el apareamiento y el cuidado de las crías. Los hallazgos sugieren que el pulpo vulgar, al igual que otras especies de vida corta, tiene una proliferación compleja del hipocampo, necesaria para la navegación espacial y la memoria a corto y largo plazo.
Carboneros
Los carboneros de cabeza negra son una especie modelo muy conocida en el campo de la neurociencia por sus mecanismos neuronales en la vocalización , plasticidad y memoria de las canciones . Los carboneros de cabeza negra son diferentes de otras especies en el grupo más grande de pájaros cantores porque se caracterizan por comportamientos de almacenamiento de alimentos. Debido a este comportamiento, los carboneros pueden describirse a través de su notable memoria espacial . Se han descrito cambios estacionales en las densidades del hipocampo desde 1994, donde la supervivencia neuronal alcanza su punto máximo durante el otoño (octubre), medida por células marcadas con timidina (ver seguimiento de neurogénesis a continuación), semanas después de la inyección. En comparación con las aves que almacenan en caché que no son alimentos, como el gorrión común, los carboneros tuvieron un reclutamiento de neuronas del hipocampo significativamente mayor desde el otoño hasta la primavera. Los cambios en la densidad del hipocampo están directamente asociados con un mayor comportamiento de acumulación, especialmente durante el invierno, cuando una mejor memoria espacial maximiza su supervivencia.
Durante las 2 décadas transcurridas desde el descubrimiento inicial, el papel específico del hipocampo del carbonero en la memoria ha ganado una gran atención. En un entorno experimental, las lesiones del hipocampo afectan la memoria de ubicaciones, validando nociones previas para este papel específico. Además, la inhibición experimental de la proliferación neuronal disminuye las puntuaciones en las tareas de memoria espacial, lo que respalda que las nuevas neuronas desempeñan el mismo papel que las preexistentes. La función específica del hipocampo, junto con los cambios estacionales en su volumen, apuntan hacia sus ventajas temporales para la consolidación de la memoria espacial. En conjunto, la neurogénesis adulta en el hipocampo de los carboneros de cabeza negra sugiere mecanismos selectivos para la supervivencia neuronal en correlación directa con el comportamiento estacional de almacenamiento en caché de alimentos.
Desde el punto de vista del desarrollo, se cree que las células progenitoras llamadas células gliales radiales mitigan las neuronas recién nacidas hacia sus destinos. Las células gliales radiales extienden procesos desde su soma en la zona ventricular aviar hasta el parénquima del prosencéfalo adulto. Estas nuevas neuronas se han observado tan pronto como 3 días después de la administración de timidina en el HVC y tan pronto como 7 días antes de llegar al hipocampo. La migración aviar de nuevas neuronas es análoga a las especies de mamíferos, lo que proporciona una dirección futura en la exploración de la neurogénesis en especies de mamíferos y más allá. Sin embargo, se ha demostrado que el cautiverio reduce los volúmenes del hipocampo en comparación con sus homólogos salvajes. La neurogénesis reducida en aves cautivas puede ser causada por estrés, falta de ejercicio, interacción social disminuida y oportunidades limitadas de almacenamiento en caché.
Seguimiento de la neurogénesis
La creación de nuevas neuronas funcionales se puede medir de varias formas, que se resumen en las siguientes secciones.
Etiquetado de ADN
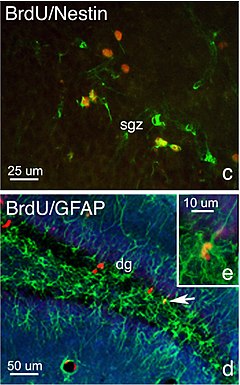
El ADN etiquetado puede rastrear el linaje de la célula en división y determinar la ubicación de sus células hijas. Se inserta un análogo de ácido nucleico en el genoma de una célula generadora de neuronas (como una célula glial o una célula madre neural ). Los análogos de timina (3H) timidina y BrdU son marcadores de ADN de uso común y se usan para radiomarcaje e inmunohistoquímica, respectivamente.
Determinación del destino a través de marcadores de linaje neuronal
El marcaje de ADN se puede utilizar junto con marcadores de linaje neuronal para determinar el destino de nuevas células cerebrales funcionales . Primero, los nucleótidos marcados incorporados se utilizan para detectar las poblaciones de células hijas recién divididas . A continuación, se determinan los tipos de células específicos con diferencias únicas en su expresión de proteínas , que pueden usarse como antígenos en un inmunoensayo . Por ejemplo, NeuN / Fox3 y GFAP son antígenos comúnmente utilizados para detectar neuronas , glía y células ependimarias . Ki67 es el antígeno más utilizado para detectar la proliferación celular . Algunos antígenos pueden usarse para medir etapas específicas de células madre . Por ejemplo, las células madre requieren el gen sox2 para mantener la pluripotencia y se utilizan para detectar concentraciones duraderas de células madre en el tejido del SNC . La proteína nestina es un filamento intermedio , esencial para el crecimiento radial de los axones , por lo que se utiliza para detectar la formación de nuevas sinapsis .
Recombinación Cre-Lox
Algunos estudios de rastreo genético utilizan la recombinación cre-lox para unir un promotor a un gen indicador , como el gen lacZ o GFP . Este método se puede utilizar para la cuantificación a largo plazo de la división celular y el marcaje, mientras que los procedimientos mencionados anteriormente solo son útiles para la cuantificación a corto plazo.
Vectores virales
Recientemente se ha vuelto más común usar virus recombinantes para insertar la información genética que codifica marcadores específicos (generalmente fluoróforos de proteínas como GFP ) que solo se expresan en células de cierto tipo. El gen marcador se inserta cadena abajo de un promotor , lo que lleva a la transcripción de ese marcador solo en las células que contienen el factor o factores de transcripción que se unen a ese promotor. Por ejemplo, un plásmido recombinante puede contener el promotor de la doblecortina , una proteína expresada predominantemente por neuronas , corriente arriba de una secuencia que codifica la GFP , lo que hace que las células infectadas tengan una fluorescencia verde tras la exposición a la luz en el rango de azul a ultravioleta, dejando células que no expresan doblecortina. no se ven afectados, incluso si contienen el plásmido . Muchas células contendrán múltiples copias del plásmido y del propio fluoróforo, lo que permitirá que las propiedades fluorescentes se transfieran a lo largo del linaje de una célula infectada .
Al etiquetar una célula que da lugar a neuronas, como las células madre neurales o las células precursoras neurales, se puede rastrear la creación, proliferación e incluso la migración de neuronas recién creadas. Sin embargo, es importante tener en cuenta que, si bien el plásmido es estable durante largos períodos de tiempo, sus productos proteicos pueden tener vidas medias muy variables y su fluorescencia puede disminuir y diluirse demasiado para ser visto dependiendo del número de rondas de replicación que han sufrido, lo que hace que este método sea más útil para rastrear precursores neurales auto-similares o células madre neurales en lugar de las propias neuronas. La inserción de material genético a través de un vector viral tiende a ser esporádica e infrecuente en relación con el número total de células en una región determinada de tejido , lo que hace que la cuantificación de la división celular sea inexacta. Sin embargo, el método anterior puede proporcionar datos muy precisos con respecto a cuándo nació una célula , así como morfologías celulares completas .
Métodos para inhibir la neurogénesis.
Muchos estudios que analizan el papel de la neurogénesis adulta utilizan un método para inhibir la proliferación celular en regiones específicas del cerebro, imitando una inhibición de la neurogénesis, para observar los efectos sobre el comportamiento.
Inhibición farmacológica
La inhibición farmacológica se utiliza ampliamente en diversos estudios, ya que aporta muchos beneficios. Generalmente es económico en comparación con otros métodos, como la irradiación, se puede usar en varias especies y no requiere ningún procedimiento invasivo o cirugías para los sujetos.
Sin embargo, plantea ciertos desafíos, ya que estos inhibidores no pueden usarse para inhibir la proliferación en regiones específicas, lo que conduce a efectos inespecíficos de otros sistemas que se ven afectados. Para evitar estos efectos, se debe trabajar más para determinar las dosis óptimas con el fin de minimizar los efectos en los sistemas no relacionados con la neurogénesis.
Un inhibidor farmacológico común de la neurogénesis en adultos es el acetato de metilazoximetanol (MAM), un agente quimioterapéutico. Otros inhibidores de la división celular que se utilizan habitualmente en los estudios son la citarabina y la temozolomida.
Farmacogenética
Otro método utilizado para estudiar los efectos de la neurogénesis en adultos es el uso de modelos farmacogenéticos. Estos modelos proporcionan diferentes beneficios de la ruta farmacológica, ya que permite una mayor especificidad al dirigirse a precursores específicos de la neurogénesis y promotores específicos de células madre. También permite la especificidad temporal con la interacción de ciertos fármacos. Esto es beneficioso para observar específicamente la neurogénesis en la edad adulta, después del desarrollo normal de otras regiones del cerebro.
La timidina quinasa del virus del herpes simple (HSV-TK) se ha utilizado en estudios junto con fármacos antivirales para inhibir la neurogénesis en adultos. Funciona dirigiéndose a las células madre utilizando proteínas ácidas fibrilares gliales y expresión de nestina. Estas células madre dirigidas sufren muerte celular en lugar de proliferación celular cuando se exponen a medicamentos antivirales.
La proteína Cre también se usa comúnmente para dirigirse a las células madre que sufrirán cambios genéticos tras el tratamiento con tamoxifeno.
Irradiación
La irradiación es un método que permite una inhibición muy específica de la neurogénesis adulta. Puede dirigirse al cerebro para evitar afectar otros sistemas y tener efectos inespecíficos. Incluso se puede usar para apuntar a regiones específicas del cerebro, lo cual es importante para determinar cómo la neurogénesis adulta en diferentes áreas del cerebro afecta el comportamiento.
Sin embargo, la irradiación es más cara que los otros métodos y también requiere un gran equipo con personas capacitadas.
Inhibición de la neurogénesis adulta en el hipocampo.
Muchos estudios han observado cómo la inhibición de la neurogénesis adulta en otros mamíferos, como ratas y ratones, afecta su comportamiento. Se ha demostrado que la inhibición de la neurogénesis adulta en el hipocampo tiene varios efectos sobre el aprendizaje y la memoria, el condicionamiento y las conductas de investigación.
Se ha observado una alteración del condicionamiento del miedo en estudios con ratas con falta de neurogénesis adulta en el hipocampo. La inhibición de la neurogénesis adulta en el hipocampo también se ha relacionado con cambios en el comportamiento en tareas de investigación. Las ratas también muestran comportamientos de congelación contextualizados disminuidos en respuesta al miedo contextualizado y al deterioro en el aprendizaje de ubicaciones espaciales cuando carecen de neurogénesis adulta.
Efectos sobre la separación de patrones
Se cree que los cambios en el aprendizaje y la memoria observados en los estudios mencionados anteriormente están relacionados con el papel de la neurogénesis adulta en la regulación de la separación de patrones. La separación de patrones se define como "un proceso para eliminar la redundancia de entradas similares para que los eventos se puedan separar entre sí y la interferencia se pueda reducir, y además puede producir un conjunto de salidas más ortogonales, dispersas y categorizadas".
Esta deficiencia en la separación de patrones podría explicar las deficiencias observadas en otras tareas de aprendizaje y memoria. Una capacidad disminuida para reducir la interferencia podría conducir a una mayor dificultad para formar y retener nuevos recuerdos, aunque es difícil discriminar entre los efectos de la neurogénesis en el aprendizaje y la separación de patrones debido a limitaciones en la interpretación de los resultados conductuales ".
Los estudios muestran que las ratas con neurogénesis adulta inhibida demuestran dificultad para diferenciar y aprender el condicionamiento contextualizado del miedo. Las ratas con neurogénesis adulta bloqueada también muestran una congelación diferencial deteriorada cuando se les requiere diferenciar entre contextos similares. Esto también afecta su reconocimiento espacial en las pruebas de laberinto de brazos radiales cuando los brazos están más juntos que cuando están más separados. Un metaanálisis de estudios conductuales que evalúan el efecto de la neurogénesis en diferentes pruebas de separación de patrones ha demostrado un efecto consistente de la ablación de la neurogénesis en el rendimiento, aunque existen excepciones en la literatura. "
Efectos sobre la inhibición del comportamiento
La inhibición del comportamiento es importante en ratas y otros animales para detener lo que estén haciendo actualmente para reevaluar una situación en respuesta a una amenaza o cualquier otra cosa que pueda requerir su atención.
Las ratas con hipocampo lesionado muestran menos inhibición conductual cuando se exponen a amenazas, como el olor a gato. La interrupción de la proliferación celular normal y el desarrollo de la circunvolución dentada en ratas en desarrollo también altera su respuesta de congelación, que es un ejemplo de inhibición del comportamiento, cuando se exponen a una rata macho adulta desconocida.
Este deterioro en la inhibición del comportamiento también se relaciona con el proceso de aprendizaje y memoria, ya que reprimir respuestas o comportamientos incorrectos requiere la capacidad de inhibir esa respuesta.
Trascendencia
Papel en el aprendizaje
La relevancia funcional de la neurogénesis adulta es incierta, pero hay alguna evidencia de que la neurogénesis adulta del hipocampo es importante para el aprendizaje y la memoria . Se han sugerido múltiples mecanismos para la relación entre el aumento de la neurogénesis y la mejora de la cognición, incluidas las teorías computacionales para demostrar que las nuevas neuronas aumentan la capacidad de memoria, reducen la interferencia entre los recuerdos o agregan información sobre el tiempo a los recuerdos. Dado que la tasa de neurogénesis no cambia sustancialmente durante la edad adulta, se ha propuesto que se pueden crear recuerdos episódicos únicos simplemente confiando en la capacidad aumentada de las neuronas jóvenes de una edad particular para establecer nuevas sinapsis estables con pares que representan la características únicas de un evento para memorizar Los experimentos destinados a la ablación de la neurogénesis no han resultado concluyentes, pero varios estudios han propuesto la dependencia neurogénica en algunos tipos de aprendizaje y otros no han visto ningún efecto. Los estudios han demostrado que el acto de aprender en sí está asociado con una mayor supervivencia neuronal. Sin embargo, los hallazgos generales de que la neurogénesis adulta es importante para cualquier tipo de aprendizaje son ambiguos.
Enfermedad de Alzheimer
Algunos estudios sugieren que la neurogénesis hipocampal disminuida puede conducir al desarrollo de la enfermedad de Alzheimer (EA). Sin embargo, otros plantean la hipótesis de que los pacientes con EA tienen un aumento de la neurogénesis en la región CA1 del cuerno de Ammon (la región principal de la patología del hipocampo de la EA) para compensar la pérdida neuronal. Si bien se desconoce la naturaleza exacta de la relación entre la neurogénesis y la enfermedad de Alzheimer, la neurogénesis estimulada por el factor de crecimiento similar a la insulina 1 produce cambios importantes en la plasticidad del hipocampo y parece estar involucrada en la patología de la enfermedad de Alzheimer. La alopregnanolona , un neurosteroide , ayuda a la neurogénesis continua en el cerebro. Los niveles de alopregnanolona en el cerebro disminuyen en la vejez y la enfermedad de Alzheimer. Se ha demostrado que la alopregnanolona revierte el deterioro de la neurogénesis para revertir los déficits cognitivos en un modelo de ratón de la enfermedad de Alzheimer. Se ha demostrado que los receptores de efrina y la señalización de efrina regulan la neurogénesis adulta en el hipocampo y se han estudiado como posibles objetivos para tratar algunos síntomas de la EA. También se ha descubierto que las moléculas asociadas con la patología de la EA, incluidas ApoE , PS1 y APP , afectan la neurogénesis adulta en el hipocampo.
Papel en la esquizofrenia
Los estudios sugieren que las personas con esquizofrenia tienen un volumen reducido del hipocampo, que se cree que es causado por una reducción de la neurogénesis adulta. En consecuencia, este fenómeno podría ser la causa subyacente de muchos de los síntomas de la enfermedad. Además, varios trabajos de investigación se refirieron a cuatro genes, la proteína de unión a distrobrevina 1 (DTNBP1), la neuregulina 1 (NRG1), alterada en la esquizofrenia 1 (DISC1), y el receptor de neuregulina 1 (ERBB4), como posiblemente responsables de este déficit en las personas normales. regeneración de neuronas. Las similitudes entre la depresión y la esquizofrenia sugieren un posible vínculo biológico entre las dos enfermedades. Sin embargo, se deben realizar más investigaciones para demostrar claramente esta relación.
Neurogénesis adulta y trastorno depresivo mayor
Las investigaciones indican que la neurogénesis del hipocampo del adulto está inversamente relacionada con el trastorno depresivo mayor (TDM). La neurogénesis está disminuida en el hipocampo de modelos animales de trastorno depresivo mayor, y muchos tratamientos para el trastorno, incluida la medicación antidepresiva y la terapia electroconvulsiva , aumentan la neurogénesis del hipocampo. Se ha teorizado que la disminución de la neurogénesis del hipocampo en individuos con trastorno depresivo mayor puede estar relacionada con los altos niveles de hormonas del estrés llamadas glucocorticoides , que también están asociadas con el trastorno. El hipocampo instruye al eje hipotalámico-pituitario-suprarrenal para producir menos glucocorticoides cuando los niveles de glucocorticoides son altos. Un hipocampo que funciona mal, por lo tanto, podría explicar los niveles crónicamente altos de glucocorticoides en individuos con trastorno depresivo mayor. Sin embargo, algunos estudios han indicado que la neurogénesis del hipocampo no es menor en individuos con trastorno depresivo mayor y que los niveles de glucocorticoides en sangre no cambian cuando cambia la neurogénesis del hipocampo, por lo que las asociaciones aún son inciertas.
Estrés y depresión
Muchos ahora creen que el estrés es el factor más importante para la aparición de la depresión . Como se discutió anteriormente, las células del hipocampo son sensibles al estrés, lo que puede conducir a una disminución de la neurogénesis. Esta área se está considerando con más frecuencia al examinar las causas y los tratamientos de la depresión. Los estudios han demostrado que la extirpación de la glándula suprarrenal en ratas provoca un aumento de la neurogénesis en la circunvolución dentada . La glándula suprarrenal es responsable de producir cortisol en respuesta a un factor de estrés, una sustancia que cuando se produce en cantidades crónicas provoca la regulación negativa de los receptores de serotonina y suprime el nacimiento de neuronas. En el mismo estudio se demostró que la administración de corticosterona a animales normales suprimió la neurogénesis, el efecto contrario. La clase más típica de antidepresivos administrados para esta enfermedad son los inhibidores selectivos de la recaptación de serotonina (ISRS) y su eficacia puede explicarse por la neurogénesis. En un cerebro normal, un aumento de la serotonina provoca la supresión de la hormona liberadora de corticotropina (CRH) a través de la conexión con el hipocampo. Actúa directamente sobre el núcleo paraventricular para disminuir la liberación de CRH y regular negativamente el funcionamiento de la noradrenalina en el locus coeruleus . Debido a que la CRH está siendo reprimida, la disminución de la neurogénesis asociada con niveles elevados de la misma también se está invirtiendo. Esto permite la producción de más células cerebrales, en particular en el receptor 5-HT1a en la circunvolución dentada del hipocampo, que se ha demostrado que mejora los síntomas de depresión. Normalmente, las neuronas tardan entre tres y seis semanas en madurar, que es aproximadamente la misma cantidad de tiempo que tardan los ISRS en hacer efecto. Esta correlación refuerza la hipótesis de que los ISRS actúan a través de la neurogénesis para disminuir los síntomas de la depresión. Algunos neurocientíficos han expresado su escepticismo de que la neurogénesis sea funcionalmente significativa, dado que una pequeña cantidad de neuronas nacientes están realmente integradas en los circuitos neuronales existentes. Sin embargo, un estudio reciente utilizó la irradiación de neuronas del hipocampo nacientes en primates no humanos (NHP) para demostrar que la neurogénesis es necesaria para la eficacia antidepresiva.
Las neuronas nacidas de adultos parecen tener un papel en la regulación del estrés . Los estudios han relacionado la neurogénesis con las acciones beneficiosas de antidepresivos específicos , lo que sugiere una conexión entre la disminución de la neurogénesis del hipocampo y la depresión. En un estudio pionero, los científicos demostraron que los beneficios conductuales de la administración de antidepresivos en ratones se invierten cuando se previene la neurogénesis con técnicas de irradiación X. De hecho, las neuronas recién nacidas son más excitables que las neuronas más viejas debido a una expresión diferencial de los receptores GABA . Un modelo plausible, por lo tanto, es que estas neuronas aumentan el papel del hipocampo en el mecanismo de retroalimentación negativa del eje HPA (estrés fisiológico) y quizás en la inhibición de la amígdala (la región del cerebro responsable de las respuestas de miedo a los estímulos). De hecho, la supresión de la neurogénesis adulta puede conducir a un aumento de la respuesta al estrés del eje HPA en situaciones levemente estresantes. Esto es consistente con numerosos hallazgos que relacionan las actividades para aliviar el estrés (aprendizaje, exposición a un ambiente nuevo pero benigno y ejercicio) con niveles aumentados de neurogénesis, así como la observación de que los animales expuestos a estrés fisiológico (cortisol) o estrés psicológico (p. Ej. aislamiento) muestran niveles marcadamente disminuidos de neuronas recién nacidas. En condiciones de estrés crónico, la elevación de las neuronas del recién nacido por los antidepresivos mejora el control dependiente del hipocampo sobre la respuesta al estrés; sin las neuronas del recién nacido, los antidepresivos no pueden restaurar la regulación de la respuesta al estrés y la recuperación se vuelve imposible.
Algunos estudios han planteado la hipótesis de que el aprendizaje y la memoria están relacionados con la depresión y que la neurogénesis puede promover la neuroplasticidad . Un estudio propone que el estado de ánimo puede estar regulado, en un nivel básico, por la plasticidad y, por lo tanto, no por la química . En consecuencia, los efectos del tratamiento antidepresivo solo serían secundarios al cambio en la plasticidad. Sin embargo, otro estudio ha demostrado una interacción entre los antidepresivos y la plasticidad; Se ha demostrado que el antidepresivo fluoxetina restaura la plasticidad en el cerebro de ratas adultas. Los resultados de este estudio implican que en lugar de ser secundario a cambios en la plasticidad, la terapia antidepresiva podría promoverla.
Efectos de la reducción del sueño
Un estudio ha relacionado la falta de sueño con una reducción de la neurogénesis del hipocampo de los roedores. El mecanismo propuesto para la disminución observada fue un aumento de los niveles de glucocorticoides . Se demostró que dos semanas de privación del sueño actuaron como un inhibidor de la neurogénesis, que se revirtió después de volver al sueño normal e incluso cambió a un aumento temporal de la proliferación celular normal. Más precisamente, cuando los niveles de corticosterona están elevados, la falta de sueño inhibe este proceso. No obstante, los niveles normales de neurogénesis después de la privación crónica del sueño regresan después de 2 semanas, con un aumento temporal de la neurogénesis. Si bien esto se reconoce, se pasa por alto la demanda de glucosa en sangre que se presenta durante los estados hipoglucémicos diabéticos temporales. La Asociación Estadounidense de Diabetes, entre muchos documentos, documenta la pseudosenilia y la agitación que se encuentran durante los estados hipoglucémicos temporales. Se necesita mucha más documentación clínica para demostrar de manera competente el vínculo entre la disminución de la glucosa hematológica y la actividad neuronal y el estado de ánimo.
Posible uso en el tratamiento de la enfermedad de Parkinson.
La enfermedad de Parkinson es un trastorno neurodegenerativo caracterizado por una pérdida progresiva de neuronas dopaminérgicas en la sustancia negra . El trasplante de células precursoras dopaminérgicas fetales ha allanado el camino para la posibilidad de una terapia de reemplazo celular que podría mejorar los síntomas clínicos en los pacientes afectados. En los últimos años, los científicos han proporcionado pruebas de la existencia de células madre neurales con el potencial de producir nuevas neuronas, en particular de un fenotipo dopaminérgico, en el cerebro de los mamíferos adultos. El agotamiento experimental de la dopamina en roedores disminuye la proliferación de células precursoras tanto en la zona subependimaria como en la zona subgranular. La proliferación se restablece por completo mediante un agonista selectivo de receptores tipo D2 (D2L). Se han identificado células madre neurales en las regiones cerebrales neurogénicas, donde la neurogénesis es constitutivamente continua, pero también en las zonas no neurogénicas, como el mesencéfalo y el cuerpo estriado, donde no se cree que la neurogénesis ocurra en condiciones fisiológicas normales. Investigaciones más recientes han demostrado que, de hecho, existe neurogénesis en el cuerpo estriado. Una comprensión detallada de los factores que gobiernan las células madre neurales adultas in vivo puede conducir finalmente a terapias celulares elegantes para trastornos neurodegenerativos como la enfermedad de Parkinson mediante la movilización de células madre neurales endógenas autólogas para reemplazar las neuronas degeneradas.
Lesión cerebral traumática
Las lesiones cerebrales traumáticas varían en su mecanismo de lesión, produciendo un trauma contundente o penetrante que resulta en una lesión primaria y secundaria con excitotoxicidad y muerte neuronal relativamente extendida. Debido a la abrumadora cantidad de lesiones cerebrales traumáticas como resultado de la Guerra contra el Terrorismo , se han realizado enormes cantidades de investigación para comprender mejor la fisiopatología de las lesiones cerebrales traumáticas, así como las intervenciones neuroprotectoras y las posibles intervenciones que provocan la neurogénesis restauradora. Las intervenciones hormonales, como la progesterona, el estrógeno y la alopregnanolona, se han examinado en profundidad en las últimas décadas como posibles agentes neuroprotectores después de lesiones cerebrales traumáticas para reducir la respuesta inflamatoria que frena la muerte neuronal. En roedores, que carecen de la capacidad regenerativa para la neurogénesis adulta , se ha identificado la activación de las células madre después de la administración del agonista del receptor nicotínico de acetilcolina α7, PNU-282987 , en retinas dañadas con un trabajo de seguimiento que examina la activación de la neurogénesis en mamíferos después de una lesión cerebral traumática. . Actualmente, no existe ninguna intervención médica que haya pasado los ensayos clínicos de fase III para su uso en la población humana.
Los factores que afectan
Cambios en la vejez
La neurogénesis se reduce sustancialmente en el hipocampo de los animales ancianos, lo que aumenta la posibilidad de que pueda estar relacionada con la disminución de la función del hipocampo relacionada con la edad. Por ejemplo, la tasa de neurogénesis en animales viejos predice la memoria. Sin embargo, las células recién nacidas en animales envejecidos están integradas funcionalmente. Dado que la neurogénesis ocurre durante toda la vida, podría esperarse que el hipocampo aumentara de tamaño de manera constante durante la edad adulta y que, por lo tanto, el número de células granulares aumentaría en los animales de edad avanzada. Sin embargo, este no es el caso, lo que indica que la proliferación se equilibra con la muerte celular. Por lo tanto, no es la adición de nuevas neuronas al hipocampo lo que parece estar relacionado con las funciones del hipocampo, sino más bien la tasa de renovación de las células granulares.
Efectos del ejercicio
Los científicos han demostrado que la actividad física en forma de ejercicio voluntario da como resultado un aumento en el número de neuronas recién nacidas en el hipocampo de ratones y ratas. Estos y otros estudios han demostrado que el aprendizaje en ambas especies se puede mejorar con el ejercicio físico. Investigaciones recientes han demostrado que el factor neurotrófico derivado del cerebro y el factor de crecimiento similar a la insulina 1 son mediadores clave de la neurogénesis inducida por el ejercicio. El ejercicio aumenta la producción de BDNF, así como la subunidad NR2B del receptor NMDA. El ejercicio aumenta la captación de IGF-1 del torrente sanguíneo en varias regiones del cerebro, incluido el hipocampo. Además, IGF-1 altera la expresión de c-fos en el hipocampo. Cuando se bloquea el IGF-1, el ejercicio ya no induce la neurogénesis. Otra investigación demostró que los ratones en ejercicio que no producían beta-endorfina, una hormona que eleva el estado de ánimo, no tenían cambios en la neurogénesis. Sin embargo, los ratones que produjeron esta hormona, junto con el ejercicio, mostraron un aumento en las células del recién nacido y su tasa de supervivencia. Si bien la asociación entre la neurogénesis mediada por el ejercicio y la mejora del aprendizaje sigue sin estar clara, este estudio podría tener fuertes implicaciones en los campos del envejecimiento y / o la enfermedad de Alzheimer .
Efectos de los cannabinoides
Algunos estudios han demostrado que la estimulación de los cannabinoides da como resultado el crecimiento de nuevas células nerviosas en el hipocampo a partir de células madre tanto embrionarias como adultas. En 2005, un estudio clínico de ratas en la Universidad de Saskatchewan mostró la regeneración de células nerviosas en el hipocampo. Los estudios han demostrado que una droga sintética parecida al THC , el principal ingrediente psicoactivo de la marihuana, brinda cierta protección contra la inflamación cerebral , lo que podría resultar en una mejor memoria a una edad avanzada. Esto se debe a los receptores del sistema que también pueden influir en la producción de nuevas neuronas. No obstante, un estudio dirigido a la Universidad de Rutgers demostró cómo la sincronización de los potenciales de acción en el hipocampo de ratas se alteraba después de la administración de THC. La falta de sincronización se correspondía con un rendimiento deficiente en una prueba estándar de memoria. Estudios recientes indican que un cannabinoide natural del cannabis, el cannabidiol (CBD), aumenta la neurogénesis adulta sin afectar el aprendizaje. Sin embargo, el THC afectó el aprendizaje y no tuvo ningún efecto sobre la neurogénesis. Una mayor proporción de CBD a THC en los análisis de cabello de los consumidores de cannabis se correlaciona con la protección contra la reducción de la materia gris en el hipocampo derecho. También se ha observado que el CBD atenúa los déficits en el recuerdo de la prosa y la memoria asociativa visuoespacial de quienes se encuentran actualmente bajo la influencia del cannabis, lo que implica efectos neuroprotectores contra la exposición intensa al THC. La neurogénesis podría desempeñar un papel en sus efectos neuroprotectores, pero se requiere más investigación.
Algunos estudios han informado de una asociación positiva entre el THC y la neurogénesis del hipocampo. Algunos de ellos hipotetizan un efecto bifásico, algunos de ellos expresan que parte de los efectos negativos podrían ser atribuibles a la neuroadaptación por exposición en un período específico de la vida, y que podría revertirse.
Regulación
Muchos factores pueden afectar la tasa de neurogénesis del hipocampo. Se ha demostrado que el ejercicio y un entorno enriquecido promueven la supervivencia de las neuronas y la integración exitosa de las células del recién nacido en el hipocampo existente. Otro factor es la lesión del sistema nervioso central, ya que la neurogénesis ocurre después de isquemia cerebral , ataques epilépticos y meningitis bacteriana . Por otro lado, condiciones como el estrés crónico , la infección viral y el envejecimiento pueden resultar en una disminución de la proliferación neuronal. Los factores circulantes dentro de la sangre pueden reducir la neurogénesis. En seres humanos sanos que envejecen, los niveles de ciertas quimiocinas en plasma y líquido cefalorraquídeo están elevados. En un modelo de ratón, los niveles plasmáticos de estas quimiocinas se correlacionan con una reducción de la neurogénesis, lo que sugiere que la neurogénesis puede estar modulada por ciertos cambios sistémicos globales dependientes de la edad. Estas quimiocinas incluyen CCL11 , CCL2 y CCL12 , que están muy localizadas en cromosomas humanos y de ratón, lo que implica un locus genético en el envejecimiento. Otro estudio implicó a la citoquina, IL-1beta, que es producida por la glía. Ese estudio encontró que el bloqueo de IL-1 podría prevenir parcialmente el deterioro severo de la neurogénesis causado por una infección viral.
La regulación epigenética también juega un papel importante en la neurogénesis. La metilación del ADN es fundamental en la determinación del destino de las células madre neurales adultas en la zona subventricular para la neurogénesis posnatal mediante la regulación de genes neurónicos como Dlx2 , Neurog2 y Sp8 . Se ha demostrado que muchos microARN como miR-124 y miR-9 influyen en el tamaño cortical y la formación de capas durante el desarrollo.
Historia
Los primeros neuroanatomistas, incluido Santiago Ramón y Cajal , consideraban el sistema nervioso fijo e incapaz de regenerarse. La primera evidencia de neurogénesis de mamíferos adultos en la corteza cerebral fue presentada por Joseph Altman en 1962, seguida de una demostración de neurogénesis adulta en la circunvolución dentada del hipocampo en 1963. En 1969, Joseph Altman descubrió y nombró la corriente migratoria rostral como el fuente de neuronas de células granulares generadas por adultos en el bulbo olfatorio. Hasta la década de 1980, la comunidad científica ignoró estos hallazgos a pesar del uso del método más directo para demostrar la proliferación celular en los primeros estudios, es decir, la autorradiografía de 3H-timidina. En ese momento, Shirley Bayer (y Michael Kaplan ) demostraron nuevamente que la neurogénesis adulta existe en los mamíferos (ratas), y Nottebohm mostró el mismo fenómeno en las aves, lo que generó un renovado interés en el tema. Los estudios realizados en la década de 1990 finalmente colocaron la investigación sobre la neurogénesis en adultos en una búsqueda generalizada. También a principios de la década de 1990 se demostró la neurogénesis del hipocampo en primates no humanos y en humanos. Más recientemente, también se ha caracterizado la neurogénesis en el cerebelo de conejos adultos. Además, algunos autores (en particular Elizabeth Gould ) han sugerido que la neurogénesis adulta también puede ocurrir en regiones dentro del cerebro que generalmente no están asociadas con la neurogénesis, incluida la neocorteza . Sin embargo, otros han cuestionado la evidencia científica de estos hallazgos, argumentando que las nuevas células pueden ser de origen glial . Investigaciones recientes han dilucidado el efecto regulador de GABA sobre las células madre neurales. Los conocidos efectos inhibidores de GABA en todo el cerebro también afectan los circuitos locales que hacen que una célula madre se vuelva inactiva. Descubrieron que el diazepam (Valium) tiene un efecto similar.
Ver también
- Membrana neuronal artificial
- Desarrollo neuronal
- Neuroplasticidad
- Neurotropina
- Neurulacion
- Gliogénesis
- Noogénesis
Referencias
- Notas
- Aimone JB, Jessberger S y Gage FH (2007) Neurogénesis de adultos. Scholarpedia, pág. 8739
- Gould E, Reeves AJ, Fallah M, Tanapat P, Gross CG, Fuchs E (abril de 1999). "Neurogénesis hipocampal en primates adultos del Viejo Mundo" . Proc. Natl. Acad. Sci. USA . 96 (9): 5263–7. Código Bibliográfico : 1999PNAS ... 96.5263G . doi : 10.1073 / pnas.96.9.5263 . PMC 21852 . PMID 10220454 .
- Gould E, Reeves AJ, Graziano MS, Gross CG (octubre de 1999). "Neurogénesis en la neocorteza de primates adultos". Ciencia . 286 (5439): 548–52. doi : 10.1126 / science.286.5439.548 . PMID 10521353 .
- Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ (marzo de 1999). "El aprendizaje mejora la neurogénesis adulta en la formación del hipocampo". Nat. Neurosci . 2 (3): 260–5. doi : 10.1038 / 6365 . PMID 10195219 . S2CID 12112156 .
- Moghadam KS, Chen A, Heathcote RD (agosto de 2003). "Establecimiento de un destino de células ventrales en la médula espinal". Dev. Dyn . 227 (4): 552–62. doi : 10.1002 / dvdy.10340 . PMID 12889064 . S2CID 209599 .
- Rakic P (enero de 2002). "Neurogénesis en la neocorteza de primates adultos: una evaluación de la evidencia". Nature Reviews Neurociencia . 3 (1): 65–71. doi : 10.1038 / nrn700 . PMID 11823806 . S2CID 15725675 .
- Rolls, ET y Treves, A. (1998). Redes neuronales y función cerebral. Oxford: OUP. ISBN 0-19-852432-3 .
- Santarelli L, Saxe M, Gross C, et al. (Agosto de 2003). "Requisito de la neurogénesis del hipocampo para los efectos conductuales de los antidepresivos". Ciencia . 301 (5634): 805–9. Código Bibliográfico : 2003Sci ... 301..805S . doi : 10.1126 / science.1083328 . PMID 12907793 . S2CID 9699898 .
- Schloesser RJ, Manji HK, Martinowich K (abril de 2009). "La supresión de la neurogénesis adulta conduce a un aumento de la respuesta del eje hipotálamo-pituitario-adrenal" . NeuroReport . 20 (6): 553–7. doi : 10.1097 / WNR.0b013e3283293e59 . PMC 2693911 . PMID 19322118 .
- Shankle WR, Rafii MS, Landing BH, Fallon JH (1999). "Aproximadamente duplicación del número de neuronas en la corteza humana postnatal y en 35 áreas citoarquitectónicas específicas desde el nacimiento hasta los 72 meses". Patología pediátrica y del desarrollo . 2 (3): 244-259. doi : 10.1007 / s100249900120 . PMID 10191348 . S2CID 23546857 .
- Zhao M, Momma S, Delfani K, et al. (Junio de 2003). "Evidencia de neurogénesis en la sustancia negra de mamíferos adultos" . Proc. Natl. Acad. Sci. USA . 100 (13): 7925-30. Código Bibliográfico : 2003PNAS..100.7925Z . doi : 10.1073 / pnas.1131955100 . PMC 164689 . PMID 12792021 .
enlaces externos
- Introducción concisa a la neurogénesis de Wellesley College
- Sitio web completo sobre neurogénesis de Lafayette College
- Literatura temprana sobre neurogénesis en adultos
- Neurogénesis en el cerebro adulto - Fred H. Gage y Henriette van Praag
- "Neurogénesis y enfermedad de Parkinson"
- Artículo de Scholarpedia sobre neurogénesis en adultos
- "Tendencias en neurociencias, 10 de octubre de 2001 (Michael S. Kaplan MD, PhD)
- New York Times: Estudios encuentran que los cerebros hacen crecer nuevas células
- Michael Specter: Rethinking the Brain : cómo las canciones de los canarios alteran un principio fundamental de la ciencia
- El experimento de neurogénesis : serie de artículos sobre la neurogénesis humana adulta
- Revista Seed: The Reinvention of the Self - Un trasfondo histórico en el campo de la neurogénesis y las implicaciones de esta investigación
- BBC Radio 4: The Memory Experience - Úselo o piérdalo
- PBS: Changing Your Mind - Grow Your Own Brain ( Cambia tu mente - Haz crecer tu propio cerebro)
- Lobes of Steel: El ejercicio aeróbico parece promover la neurogénesis , New York Times, 19 de agosto de 2007.
-
 Medios relacionados con la neurogénesis en Wikimedia Commons
Medios relacionados con la neurogénesis en Wikimedia Commons
