Uroporfirinógeno III - Uroporphyrinogen III

|
|
| Identificadores | |
|---|---|
| Malla | Uroporfirinógeno + III |
|
PubChem CID
|
|
|
Tablero CompTox ( EPA )
|
|
| Propiedades | |
| C 40 H 44 N 4 O 16 | |
| Masa molar | 836,795 g / mol |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El uroporfirinógeno III es un tetrapirrol , el primer intermedio macrocíclico en la biosíntesis de hemo , clorofila , vitamina B12 y sirohema . Es un compuesto incoloro, como otros porfirinógenos .
Estructura
La estructura molecular del uroporfirinógeno III se puede describir como un núcleo de hexahidroporfina , donde cada anillo de pirrol tiene los átomos de hidrógeno en sus dos carbonos más externos reemplazados por un grupo de ácido acético ( -CH
2 −COOH , "A") y un grupo de ácido propiónico ( −CH
2 −CH
2 -COOH , "P"). Los grupos se adjuntan de forma asimétrica: dando la vuelta al macrociclo, el orden es AP-AP-AP-PA.
Biosíntesis y metabolismo
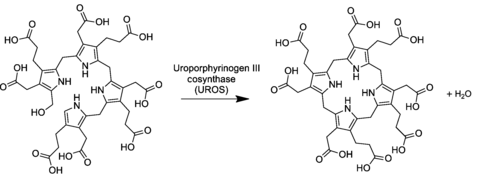
En la ruta general de biosíntesis de porfirina , el uroporfirinógeno III se deriva del tetrapirrol preuroporfirinógeno lineal (un hidroximetilbilano sustituido ) por la acción de la enzima uroporfirinógeno-III cosintasa .
La conversión implica una inversión de la última unidad de pirrol (intercambiando así los grupos ácido acético y propiónico) y una reacción de condensación que cierra el macrociclo eliminando el hidroxil- OH final con un átomo de hidrógeno del primer anillo.
En la biosíntesis de hemes y clorofilas, el uroporfirinógeno III se convierte en coproporfirinógeno III por la enzima uroporfirinógeno III descarboxilasa . En la biosíntesis de los sirohemas, el uroporfirinógeno III se convierte mediante dos metiltransferasas en dihidrosirohidroclorina , que posteriormente se oxida sirohidroclorina , un precursor del grupo protésico de los sirohemas .
Importancia médica
Si la uroporfirinógeno-III sintasa no está presente o inactiva, el hidroximetilbilano se ciclará espontáneamente en el isómero estructural uroporfirinógeno I , que se diferencia del isómero III en que los grupos ácido acético ("A") y ácido propiónico ("P") están dispuestos en un orden rotacionalmente simétrico, AP-AP-AP-AP. En este caso, el siguiente paso produjo coproporfirinógeno I , que se acumula, lo que conduce a la condición patológica porfiria eritropoyética congénita
Ver también
Referencias
- ^ Dalton, J (1969). "Formación del anillo macrocíclico en la biosíntesis de tetrapirrol". Naturaleza . 223 (5211): 1151–1153. Código Bibliográfico : 1969Natur.223.1151D . doi : 10.1038 / 2231151a0 . PMID 5810686 . S2CID 4177167 .
- ^ Paul R. Ortiz de Montellano (2008). "Hemes en biología". Enciclopedia de Wiley de biología química . John Wiley & Sons. doi : 10.1002 / 9780470048672.wecb221 . ISBN 978-0470048672 .
- ^ a b S. Sassa y A. Kappas (2000): "Aspectos moleculares de las porfirias heredadas". Journal of Internal Medicine , volumen 247, número 2, páginas 169-178. doi : 10.1046 / j.1365-2796.2000.00618.x