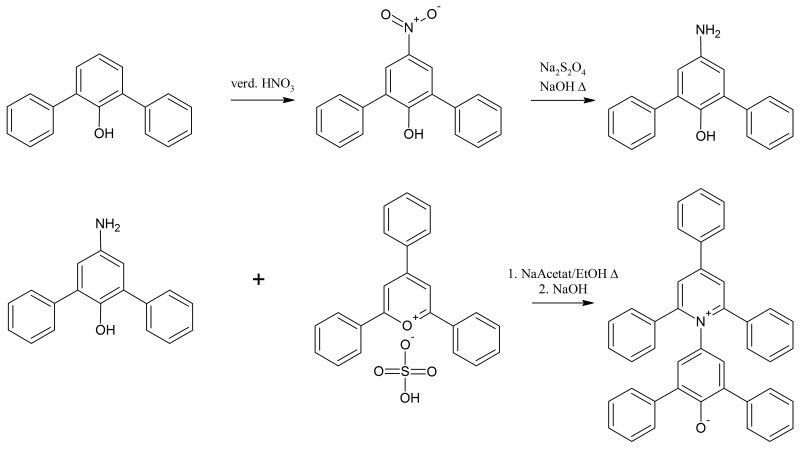Tinte de Reichardt - Reichardt's dye

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
2 5 - (2,4,6-Trifenilpiridin-1-io-1-ilo) [1 1 , 2 1 : 2 3 , 3 1 -terfenil] -2 2 -olato |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
|
PubChem CID
|
|
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 41 H 29 N O | |
| Masa molar | 551.689 g · mol −1 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
El tinte de Reichardt ( Betaine 30 ) es un tinte orgánico que pertenece a la clase de betaínas azo merocianinas . Este tinte destaca por sus propiedades solvatocrómicas , lo que significa que cambia de color según el disolvente en el que se disuelva. Tiene uno de los efectos solvatocrómicos más grandes jamás observados, con colores que varían en todo el espectro visible . Como resultado, ofrece resultados visuales sorprendentes para demostraciones químicas .

Este químico lleva el nombre de Christian Reichardt , quien lo desarrolló cuando trabajaba como estudiante de doctorado en el laboratorio de Karl Dimroth . Por lo tanto, a veces también se le llama tinte Dimroth-Reichardt. Los nombres también se refieren a veces a algunos análogos químicos cercanos, en particular, el que tiene grupos terc- butilo para sustituidos en los anillos de fenilo.
Síntesis
Una síntesis más nueva es:
El 2,6-difenilfenol se nitra con ácido nítrico diluido a 4-nitro-2,6-difenilfenol y posteriormente se reduce con ditionito de sodio a la amina . Este se hace reaccionar en presencia de acetato de sodio en etanol con hidrogenosulfato de 2,4,6-trifenilpirilio para dar el hidrogenosulfato del colorante y se forma la betaína añadiendo hidróxido de sodio .