Quinazolina - Quinazoline
|
|||
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Quinazolina |
|||
| Otros nombres
1,3-diazanaftaleno
benzopirimidina fenmiazina benzo-1,3-diazina |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.005.424 |
||
| Número CE | |||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 8 H 6 N 2 | |||
| Masa molar | 130,150 g · mol −1 | ||
| Apariencia | cristales de color amarillo claro | ||
| Densidad | 1,351 g / cm 3 , sólido | ||
| Punto de fusion | 48 ° C (118 ° F; 321 K) | ||
| Punto de ebullición | 243 ° C (469 ° F; 516 K) | ||
| Soluble | |||
| Acidez (p K a ) | 3,51 | ||
| Estructura | |||
| 2,2 D | |||
| Riesgos | |||
| Principales peligros | Irritante | ||
| Ficha de datos de seguridad | MSDS externa | ||
| Pictogramas GHS |

|
||
| Palabra de señal GHS | Advertencia | ||
| H315 , H319 , H335 | |||
| P261 , P264 , P271 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |||
| punto de inflamabilidad | 106 ° C (223 ° F; 379 K) | ||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
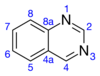
La quinazolina es un compuesto orgánico con la fórmula C 8 H 6 N 2 . Es un heterociclo aromático con una estructura bicíclica que consta de dos anillos aromáticos fusionados de seis miembros, un anillo de benceno y un anillo de pirimidina . Es un sólido cristalino de color amarillo claro que es soluble en agua. También conocida como 1,3-diazanaftaleno, la quinazolina recibió su nombre por ser un derivado aza de la quinolina . Aunque la molécula de quinazolina original rara vez se menciona por sí misma en la literatura técnica, se han sintetizado derivados sustituidos con fines medicinales, como agentes antipalúdicos y anticancerosos. La quinazolina es una molécula plana. Es isomérico con los otros diazanaftalenos del subgrupo de las benzodiazinas : cinolina , quinoxalina y ftalazina . Se identifican más de 200 alcaloides de quinazolina y quinolina biológicamente activos .
Síntesis
La síntesis de quinazolina se informó por primera vez en 1895 por August Bischler y Lang mediante la descarboxilación del derivado 2-carboxílico (ácido quinazolina-2-carboxílico). En 1903, Siegmund Gabriel informó sobre la síntesis de la quinazolina original a partir de o -nitrobencilamina, que se redujo con yoduro de hidrógeno y fósforo rojo a 2- aminobencilamina . El intermedio reducido se condensa con ácido fórmico para producir dihidroquinazolina, que se oxida a quinazolina.
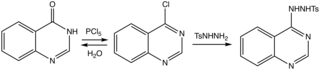
Se han revisado los métodos. Una ruta eficaz al heterociclo parental procede a través del derivado 4-cloro a la tosilhidrazida, que es eliminada por la base.
Reacciones
Reacciones de hidratación y adición
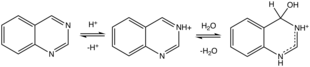
Protonatos (y metilatos) de quinazolina en N3. La protonación induce a la hidratación. Muchos sustratos ligeramente ácidos se agregan a través del enlace C = N3, estos incluyen cianuro de hidrógeno , bisulfito de sodio y metilcetonas.
Hidrólisis
En solución tibia, la quinazolina se hidroliza en condiciones ácidas y alcalinas a 2-aminobenzaldehído (o los productos de su autocondensación) y ácido fórmico y amoniaco / amonio.
Sustitución electrofílica y nucleofílica
El anillo de pirimidina resiste la sustitución electrofílica, aunque la posición 4 es más reactiva que la posición 2. En comparación, el anillo de benceno es más susceptible a la sustitución electrofílica. El orden de reactividad de la posición del anillo es 8> 6> 5> 7. Los derivados de 2 y 4 halo de quinazolina sufren desplazamiento por nucleófilos, como piperidina.
Importancia biológica y farmacológica
Gefitinib
En mayo de 2003, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) aprobó la quinazolina gefitinib . El fármaco, producido por AstraZeneca , es un inhibidor de la proteína quinasa del receptor del factor de crecimiento epidérmico (EGFR). Se une al sitio de unión de ATP del EGFR, inactivando así la cascada de transducción de señales antiapoptótica Ras, lo que evita un mayor crecimiento de las células cancerosas.
Lapatinib
En marzo de 2007, la FDA de EE. UU. Aprobó el fármaco lapatinib de GlaxoSmithKline para tratar el cáncer de mama metastásico o en estadio avanzado en combinación con la capecitabina de Roche . Lapatinib elimina el crecimiento de las células madre del cáncer de mama que provocan el crecimiento del tumor. La unión de lapatinib al sitio de unión de ATP en los dominios de la proteína quinasa EGFR y del receptor 2 del factor de crecimiento epidérmico humano (HER2) inhibe la activación del mecanismo de señal (mediante inhibición competitiva reversible).
Erlotinib
En mayo de 2013, erlotinib , un fármaco fabricado por Astellas , fue aprobado por la FDA de EE. UU. Para tratar a pacientes con NSCLC con tumores causados por mutaciones de EGFR. La unión de erlotinib a los sitios de unión de ATP de los receptores EGFR evita que EGFR produzca residuos de fosfotirosina (debido a la inhibición competitiva), lo que hace que el receptor sea incapaz de generar cascadas de señales para promover el crecimiento celular.
Afatinib
En julio de 2013, la FDA de EE. UU. Aprobó afatinib , un fármaco desarrollado por Boehringer Ingelheim , como inhibidor competitivo irreversible de las quinasas HER2 y EGFR. Si bien afatinib demuestra un mecanismo similar al laptinib en el que actúa como un inhibidor irreversible de HER2 y EGFR, afatinib también ha mostrado actividad contra tirosina quinasas que se han vuelto resistentes a gefinitib y erlotinib.
- Fármacos que contienen quinazolina
Gefitinib para el tratamiento del carcinoma de pulmón de células no pequeñas .
Lapatinib para el tratamiento del cáncer de mama metastásico o en estadio avanzado.
Erlotinib , un agente antitumoral.
Afatinib para el tratamiento de cánceres resistentes a gefinitib y erlotinib.