Melanopsina - Melanopsin
La melanopsina es un tipo de fotopigmento que pertenece a una familia más grande de proteínas retinianas sensibles a la luz llamadas opsinas y codificadas por el gen Opn4 . En la retina de los mamíferos, hay dos categorías adicionales de opsinas, ambas involucradas en la formación de imágenes visuales: rodopsina y fotopsina (tipos I, II y III) en las células fotorreceptoras de bastón y cono , respectivamente.
En los seres humanos, la melanopsina se encuentra en las células ganglionares de la retina intrínsecamente fotosensibles (ipRGC). También se encuentra en el iris de ratones y primates. La melanopsina también se encuentra en ratas, anfioxos y otros cordados. Las ipRGC son células fotorreceptoras que son particularmente sensibles a la absorción de luz visible de longitud de onda corta (azul) y comunican información directamente al área del cerebro llamada núcleo supraquiasmático (SCN), también conocido como el "reloj corporal" central, en los mamíferos. . La melanopsina juega un papel importante que no forma imágenes en el establecimiento de los ritmos circadianos, así como en otras funciones. Las mutaciones en el gen Opn4 pueden provocar trastornos clínicos, como el trastorno afectivo estacional (TAE). Según un estudio, se ha encontrado melanopsina en dieciocho sitios en el cerebro humano (fuera del tracto retinohipotalámico), intracelularmente, en un patrón granular, en la corteza cerebral, la corteza cerebelosa y varias regiones filogenéticamente antiguas, principalmente en el soma neuronal, no en núcleos. La melanopsina también se expresa en conos humanos. Sin embargo, solo del 0,11% al 0,55% de los conos humanos expresan melanopsina y se encuentran exclusivamente en las regiones periféricas de la retina. La retina periférica humana detecta la luz a altas intensidades que se explica mejor mediante cuatro clases de fotopigmentos diferentes.
Descubrimiento
La melanopsina fue descubierta por primera vez por Ignacio Provencio como una nueva opsina en los melanóforos , o células de la piel sensibles a la luz, de la rana con garras africanas en 1998. Un año después, los investigadores encontraron que los ratones sin bastones ni conos , las células involucradas en la imagen formando visión, todavía arrastrada a un ciclo de luz-oscuridad. Esta observación llevó a la conclusión de que ni los bastones ni los conos, ubicados en la retina externa , son necesarios para el arrastre circadiano y que existe una tercera clase de fotorreceptores en el ojo de los mamíferos. Provencio y sus colegas encontraron en 2000 que la melanopsina también está presente en la retina del ratón, específicamente en las células ganglionares , y que interviene en tareas fotorreceptivas no visuales. Se encontró que la melanopsina estaba codificada por Opn4 con ortólogos en una variedad de organismos.
Se descubrió que estas células ganglionares de la retina eran fotosensibles de forma innata, ya que respondían a la luz incluso cuando estaban aisladas, por lo que se denominaron células ganglionares de la retina intrínsecamente fotosensibles (ipRGC) . Constituyen una tercera clase de células fotorreceptoras en la retina de los mamíferos, además de los conos y bastones ya conocidos, y se demostró que son el principal conducto de entrada de luz al fotoentrenamiento circadiano . De hecho, Satchidananda Panda y sus colegas demostraron más tarde que el pigmento de melanopsina puede estar involucrado en el arrastre de un oscilador circadiano a los ciclos de luz en los mamíferos, ya que la melanopsina era necesaria para que los ratones ciegos respondieran a la luz.
Distribución de especies
Los mamíferos tienen genes de melanopsina ortólogos denominados Opn4m , que se derivan de una rama de la familia Opn4 y se conservan aproximadamente en un 50-55%. Sin embargo, los vertebrados no mamíferos, incluidos los pollos y el pez cebra, tienen otra versión del gen de la melanopsina, Opn4x , que parece tener un linaje distinto que divergió del Opn4m hace unos 360 millones de años. Los mamíferos perdieron el gen Opn4x relativamente temprano en su evolución, lo que llevó a una reducción general de la capacidad fotosensorial. Se piensa que este evento puede explicarse por el hecho de que ocurrió durante la época en la que evolucionaron los mamíferos nocturnos.
Estructura
El gen de la melanopsina humana, opn4 , se expresa en ipRGC , que comprende solo el 1-2% de las RGC en la retina interna de los mamíferos, según lo estudiado por Samer Hattar y sus colegas. El gen abarca aproximadamente 11,8 kb y está mapeado en el brazo largo del cromosoma 10 . El gen incluye nueve intrones y diez exones en comparación con los cuatro a siete exones que se encuentran típicamente en otras opsinas humanas. En los vertebrados no mamíferos, la melanopsina se encuentra en un subconjunto más amplio de células retinianas, así como en estructuras fotosensibles fuera de la retina, como el músculo iris del ojo, regiones cerebrales profundas, la glándula pineal y la piel. Los parámetros de Opn4 incluyen OPN1LW, OPN1MW, RHO y OPN3 y fueron descubiertos por Genome Project.
La melanopsina, como todas las demás opsinas animales (por ejemplo, rodopsina ), es un miembro de la familia del receptor acoplado a proteína G (GPCR) . La proteína melanopsina tiene siete hélices alfa integradas en la membrana plasmática, un dominio N-terminal y un dominio C-terminal . Se parece mucho más a las opsinas de los invertebrados que a los fotopigmentos de los vertebrados , especialmente en su secuencia de aminoácidos y en la cascada de señalización corriente abajo . Al igual que las opsinas invertebradas, parece ser un fotopigmento con actividad fotoisomerasa intrínseca y señales a través de una proteína G de la familia Gq.
Función
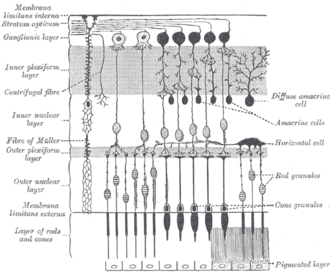
Las células ganglionares que contienen melanopsina, como bastones y conos, exhiben adaptación tanto a la luz como a la oscuridad ; ajustan su sensibilidad de acuerdo con la historia reciente de exposición a la luz. Sin embargo, mientras que los bastones y conos son responsables de la recepción de imágenes, patrones, movimiento y color, las ipRGC que contienen melanopsina contribuyen a diversas respuestas reflejas del cerebro y el cuerpo a la presencia de luz.
La evidencia de la detección de luz fisiológica de la melanopsina se ha probado en ratones. Una línea celular de ratón que normalmente no es fotosensible, Neuro-2a , se vuelve sensible a la luz mediante la adición de melanopsina humana. La fotorrespuesta es selectivamente sensible a la luz de longitud de onda corta (absorción máxima ~ 479 nm) y tiene una función de regeneración de fotoisomerasa intrínseca que se desplaza cromáticamente a longitudes de onda más largas.
Los fotorreceptores de melanopsina son sensibles a un rango de longitudes de onda y alcanzan un pico de absorción de luz en longitudes de onda de luz azul alrededor de 480 nanómetros. Otras longitudes de onda de luz activan el sistema de señalización de melanopsina con una eficiencia decreciente a medida que se alejan de los 480 nm óptimos. Por ejemplo, longitudes de onda más cortas alrededor de 445 nm (más cercanas al violeta en el espectro visible ) son la mitad de efectivas para la estimulación del fotorreceptor de melanopsina que la luz a 480 nm.
La melanopsina en el iris de algunos mamíferos, principalmente nocturnos, cierra el iris cuando se expone a la luz. Este reflejo de luz pupilar local (PLR) está ausente en los primates, aunque sus iris expresan melanopsina.
Mecanismo
Cuando la luz con una frecuencia adecuada ingresa al ojo, activa la melanopsina contenida en las células ganglionares de la retina intrínsecamente fotosensibles (ipRGC), lo que desencadena un potencial de acción . Estas señales eléctricas neuronales viajan a través de axones neuronales hacia objetivos cerebrales específicos, como el centro de control pupilar llamado núcleo olivar pretectal (OPN) del mesencéfalo. En consecuencia, la estimulación de la melanopsina en las ipRGC media las respuestas conductuales y fisiológicas a la luz, como la constricción de la pupila y la inhibición de la liberación de melatonina de la glándula pineal . Las ipRGC en la retina de los mamíferos son un extremo del tracto retinohipotalámico que se proyecta hacia el núcleo supraquiasmático (SCN) del hipotálamo . El núcleo supraquiasmático se describe a veces como el "reloj maestro" del cerebro, ya que mantiene el ritmo circadiano , y las señales nerviosas de las ipRGC al SCN arrastran el ritmo circadiano interno a la salida y puesta del sol. El SCN también recibe información de conos y bastones a través del tracto retinohipotalámico, por lo que la información de los tres tipos de células fotosensibles (bastones, conos e ipRGC) en la retina de los mamíferos se transmite al SCN (SCN).
Se cree que las células ganglionares que contienen melanopsina influyen en estos objetivos liberando los neurotransmisores glutamato y polipéptido activador de adenilato ciclasa pituitaria (PACAP) desde sus terminales axónicos. Las células ganglionares que contienen melanopsina también reciben información de los bastones y conos que se pueden sumar a la entrada de estas vías.
Efectos sobre el ritmo circadiano
La melanopsina tiene un papel importante en el fotoentrenamiento de los ritmos circadianos en los mamíferos. Un organismo fotoentrenado ha alineado su actividad con un ciclo de aproximadamente 24 horas, el ciclo solar en la Tierra. En los mamíferos, los axones que expresan melanopsina se dirigen al núcleo supraquiasmático (SCN) a través del tracto retinohipotalámico (RHT).
En los mamíferos, el ojo es el principal órgano fotosensible para la transmisión de señales luminosas al cerebro. Sin embargo, los humanos ciegos aún pueden incorporarse al ciclo ambiental de luz y oscuridad, a pesar de no tener una percepción consciente de la luz. Un estudio expuso a sujetos a luz brillante durante un período de tiempo prolongado y midió sus concentraciones de melatonina . La melatonina no solo se suprimió en humanos sin discapacidad visual, sino también en participantes ciegos, lo que sugiere que la vía fótica utilizada por el sistema circadiano está funcionalmente intacta a pesar de la ceguera. Por lo tanto, los médicos ya no practican la enucleación de pacientes ciegos o la extirpación de los ojos al nacer, ya que los ojos juegan un papel fundamental en el fotoentrenamiento del marcapasos circadiano.
En las razas mutantes de ratones que carecían solo de bastones, solo conos, o ambos bastones y conos, todas las razas de ratones todavía estaban atrapados por los estímulos de luz cambiantes en el entorno, pero con una respuesta limitada, lo que sugiere que los bastones y conos no son necesarios para el fotoentrenamiento circadiano. y que el ojo de los mamíferos debe tener otro fotopigmento necesario para la regulación del reloj circadiano .
Los ratones con inactivación de melanopsina muestran un fotoentrenamiento reducido. En comparación con los ratones de tipo salvaje que expresaban melanopsina normalmente, se observaron déficits en los cambios de fase inducidos por la luz en la actividad de locomoción en ratones sin melanopsina ( Opn4 - / - ). Estos ratones deficientes en melanopsina no perdieron por completo sus ritmos circadianos, ya que aún podían adaptarse a los estímulos ambientales cambiantes, aunque más lentamente de lo normal. Esto indicó que, aunque la melanopsina es suficiente para el arrastre, debe funcionar junto con otros fotopigmentos para la actividad normal del fotoentrenamiento. Los ratones con triple mutación que eran sin bastón, sin cono y sin melanopsina muestran una pérdida completa en los ritmos circadianos, por lo que los tres fotopigmentos en estos fotorreceptores, rodopsina , fotopsina y melanopsina, son necesarios para el fotoentrenamiento. Por tanto, existe una redundancia funcional entre los tres fotopigmentos en la vía del fotoentrenamiento de los mamíferos. La eliminación de un solo fotopigmento no elimina la capacidad del organismo de incorporarse a los ciclos ambientales de luz y oscuridad, pero reduce la intensidad de la respuesta.
Regulación
La melanopsina sufre fosforilación en su cola carboxi intracelular como una forma de desactivar su función. En comparación con otras opsinas, la melanopsina tiene una cola carboxi inusualmente larga que contiene 37 sitios de aminoácidos de serina y treonina que podrían sufrir fosforilación. Sin embargo, un grupo de siete aminoácidos es suficiente para desactivar la melanopsina del pez cebra. Estos sitios se desfosforilan cuando la melanopsina se expone a la luz y son únicos de los que regulan la rodopsina. Son importantes para una respuesta adecuada a los iones calcio en las ipRGC; la falta de sitios de fosforilación funcionales, particularmente en la serina-381 y la serina-398, reduce la respuesta de la célula a la entrada de iones de calcio inducida por la luz cuando se abren los canales de iones de calcio dependientes de voltaje.
En términos del gen Opn4, la dopamina (DA) es un factor en la regulación del ARNm de melanopsina en las ipRGC.
Significación clínica
El descubrimiento del papel de la melanopsina en la visión que no forma imágenes ha llevado a un crecimiento en la optogenética . Este campo se ha mostrado prometedor en aplicaciones clínicas, incluido el tratamiento de enfermedades oculares humanas como la retinosis pigmentaria y la diabetes . Se ha implicado una mutación de sentido erróneo en Opn4, P10L, en el 5% de los pacientes con trastorno afectivo estacional (SAD). Esta es una condición en la que las personas experimentan pensamientos depresivos en el invierno debido a la disminución de la luz disponible. Además, un receptor basado en melanopsina se ha relacionado con el dolor de migraña .
Restauración de la visión
Se han realizado investigaciones recientes sobre el papel de la melanopsina en la terapia optogenética para pacientes con la enfermedad ocular degenerativa retinitis pigmentosa (RP). La reintroducción de melanopsina funcional en los ojos de ratones con degeneración retiniana restaura el reflejo pupilar a la luz (PLR) . Estos mismos ratones también pudieron distinguir los estímulos de luz de los estímulos oscuros y mostraron una mayor sensibilidad a la luz de la habitación. La mayor sensibilidad demostrada por estos ratones es prometedora para la restauración de la visión que puede ser aplicable a humanos y enfermedades oculares humanas.
Control de los patrones de sueño / vigilia
La melanopsina puede ayudar a controlar los ciclos del sueño y la vigilia. Tsunematsu y sus colegas crearon ratones transgénicos que expresaban melanopsina en neuronas de orexina hipotalámicas . Con un pulso corto de 4 segundos de luz azul (guiado por fibras ópticas ), los ratones transgénicos pudieron pasar con éxito del sueño de ondas lentas (SWS), que comúnmente se conoce como "sueño profundo", a la vigilia prolongada. Después de apagar la luz azul, las neuronas de orexina hipotalámicas mostraron actividad durante varias decenas de segundos. Se ha demostrado que los bastones y conos no juegan ningún papel en el inicio del sueño por la luz, distinguiéndolos de las ipRGC y la melanopsina. Esto proporciona una fuerte evidencia de que existe un vínculo entre las ipRGC en humanos y el estado de alerta, particularmente con luz de alta frecuencia (por ejemplo, luz azul). Por tanto, la melanopsina se puede utilizar como diana terapéutica para controlar el ciclo sueño-vigilia.
Regulación de los niveles de glucosa en sangre.
En un artículo publicado por Ye y sus colegas en 2011, se utilizó melanopsina para crear un dispositivo de transcripción sintético optogenético que se probó en un entorno terapéutico para producir el péptido 1 similar al Fc-glucagón (Fc-GLP-1), una proteína de fusión que ayuda controlar los niveles de glucosa en sangre en mamíferos con diabetes tipo II . Los investigadores implantaron subcutáneamente a ratones con células HEK 293 transgénicas microencapsuladas que se cotransfectaron con dos vectores, incluido el gen de la melanopsina y el gen de interés bajo un promotor NFAT ( factor nuclear de células T activadas ), respectivamente. Es a través de esta vía de ingeniería que controlaron con éxito la expresión de Fc-GLP-1 en ratones diabéticos doblemente recesivos y redujeron la hiperglucemia , o niveles altos de glucosa en sangre, en estos ratones. Esto parece prometedor para el uso de melanopsina como herramienta optogenética para el tratamiento de la diabetes tipo II.
Ver también
- Efectos de luz sobre el ritmo circadiano
- Opsins
- Células ganglionares de retina intrínsecamente fotosensibles (ipRGC)
- Núcleo supraquiasmático (SCN)
- Tracto retinohipotalámico
Referencias
Otras lecturas
- Rovere G, Nadal-Nicolás FM, Wang J, Bernal-Garro JM, García-Carrillo N, Villegas-Pérez MP, et al. (Diciembre de 2016). "Respuesta de las células ganglionares de la retina que contienen o no contienen melanopsina a la hipertensión ocular aguda con o sin neuroprotección del factor neurotrófico derivado del cerebro" . Oftalmología investigadora y ciencia visual . 57 (15): 6652–6661. doi : 10.1167 / iovs.16-20146 . PMID 27930778 .





