Cloruro de plomo (II) - Lead(II) chloride

|
|

|
|
| Nombres | |
|---|---|
|
Nombres IUPAC
Cloruro de plomo (II) Dicloruro de
plomo |
|
| Otros nombres
Cloruro
plumboso Cotunita |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA |
100.028.950 |
| Número CE | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| PbCl 2 | |
| Masa molar | 278,10 g / mol |
| Apariencia | sólido blanco inodoro |
| Densidad | 5,85 g / cm 3 |
| Punto de fusion | 501 ° C (934 ° F; 774 K) |
| Punto de ebullición | 950 ° C (1.740 ° F; 1.220 K) |
| 0,99 g / L (20 ° C) | |
|
Producto de solubilidad ( K sp )
|
1,7 × 10 −5 (20 ° C) |
| Solubilidad | ligeramente soluble en HCl diluido , amoniaco ; insoluble en alcohol Soluble en agua caliente y en presencia de hidróxido alcalino. |
| −73,8 · 10 −6 cm 3 / mol | |
|
Índice de refracción ( n D )
|
2.199 |
| Estructura | |
| Ortorrómbico , OP12 | |
| Pnma, No. 62 | |
| Termoquímica | |
|
Entropía molar estándar ( S |
135,98 J K −1 mol −1 |
| -359,41 kJ / mol | |
| Peligros | |
| Ficha de datos de seguridad | Ver: página de datos |
| Pictogramas GHS |
  
|
| Palabra de señal GHS | Peligro |
| H302 , H332 , H351 , H360 , H372 , H400 , H410 | |
| P201 , P261 , P273 , P304 + 340 , P308 + 313 , P312 , P391 | |
| NFPA 704 (diamante de fuego) | |
| Dosis o concentración letal (LD, LC): | |
|
LD Lo ( menor publicado )
|
1500 mg / kg (conejillo de indias, oral) |
| Compuestos relacionados | |
|
Otros aniones
|
Fluoruro de plomo (II) Bromuro de plomo (II) Yoduro de plomo (II) |
|
Otros cationes
|
Cloruro de plomo (IV) Cloruro de estaño (II) Cloruro de germanio (II) |
|
Compuestos relacionados
|
Cloruro de talio (I) Cloruro de bismuto |
| Página de datos complementarios | |
|
Índice de refracción ( n ), constante dieléctrica (ε r ), etc. |
|
|
Datos termodinámicos |
Comportamiento de fase sólido-líquido-gas |
| UV , IR , RMN , MS | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El cloruro de plomo (II) (PbCl 2 ) es un compuesto inorgánico que es un sólido blanco en condiciones ambientales. Es poco soluble en agua. El cloruro de plomo (II) es uno de los reactivos a base de plomo más importantes . También se presenta de forma natural en forma de cotunita mineral .
Estructura y propiedades
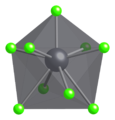
En el PbCl 2 sólido , cada ion de plomo está coordinado por nueve iones de cloruro en una formación de prisma triangular tricapado : seis se encuentran en los vértices de un prisma triangular y tres se encuentran más allá de los centros de cada cara de prisma rectangular. Los 9 iones de cloruro no son equidistantes del átomo de plomo central, 7 se encuentran en 280-309 pm y 2 en 370 pm. El PbCl 2 forma agujas ortorrómbicas blancas.
Modelo de bola y palo de parte de la estructura cristalina de la cotunita.
Geometría de coordinación de Pb 2+
En la fase gaseosa, las moléculas de PbCl 2 tienen una estructura doblada con el ángulo Cl-Pb-Cl de 98 ° y cada distancia de enlace Pb-Cl de 2,44 Å. Dicho PbCl 2 es emitido por motores de combustión interna que utilizan aditivos de plomo de tetraetilo de cloruro de etileno con fines antidetonantes.
El PbCl 2 es escasamente soluble en agua, producto de solubilidad K sp = 1,7 x 10 −5 a 20 ° C. Es uno de los 5 cloruros comúnmente insolubles en agua, los otros 4 son cloruro de talio (I) , cloruro de plata (AgCl) con K sp = 1.8 × 10 −10 , cloruro de cobre (I) (CuCl) con K sp = 1,72 × 10 −7 y cloruro de mercurio (I) (Hg 2 Cl 2 ) con K sp = 1,3 × 10 −18 .
Ocurrencia
El PbCl 2 se encuentra naturalmente en forma de cotunita mineral . Es incoloro, blanco, amarillo o verde con una densidad de 5,3 a 5,8 g / cm 3 . La dureza en la escala de Mohs es 1.5-2. La estructura cristalina es bipiramidal ortorrómbica y el grupo de puntos es 2 / m 2 / m 2 / m. Cada Pb tiene un número de coordinación de 9. La cotunita se encuentra cerca de los volcanes: Vesubio , Italia; Tarapacá , Chile; y Tolbachik , Rusia.
Síntesis
Doble desplazamiento / Metátesis
El cloruro de plomo (II) se precipita tras la adición de fuentes acuosas de cloruro (HCl, NaCl, KCl) a los compuestos de plomo (II)
- Compuestos solubles de plomo
-
Nitrato de plomo (II)
- Pb (NO 3 ) 2 + 2 NaCl (ac) → PbCl 2 (s) + NaNO 3 (ac)
-
Acetato de plomo (II)
- Pb (CH 3 COO) 2 (ac) + HCl (ac) → PbCl 2 (s) + 2 CH 3 COOH
-
Nitrato de plomo (II)
- Compuestos de plomo insolubles
-
Carbonato de plomo (II)
- PbCO 3 + 2 HCl (ac) → PbCl 2 (s) + CO 2 (g) + H 2 O
-
Dióxido de plomo
- PbO 2 (s) + 4 HCl → PbCl 2 (s) + Cl 2 + 2 H 2 O
-
Óxido de plomo (II)
- PbO (s) + 2 HCl → PbCl 2 (s) + H 2 O
-
Carbonato de plomo (II)
Reducción directa
El PbCl 2 puede formarse mediante la reducción de cloruro de cobre (II) por plomo metálico:
- Pb + CuCl 2 → PbCl 2 + Cu
Cloración directa
El PbCl 2 también se forma por la acción del cloro gaseoso sobre el plomo metálico:
- Pb + Cl 2 → PbCl 2
Reacciones
La adición de iones cloruro a una suspensión de PbCl 2 da lugar a iones complejos solubles . En estas reacciones, el cloruro adicional (u otros ligandos ) rompen los puentes de cloruro que comprenden la estructura polimérica del PbCl 2 sólido (s) .
- PbCl 2 (s) + Cl - → [PbCl 3 ] - (aq)
- PbCl 2 (s) + 2 Cl - → [PbCl 4 ] 2− (aq)
PbCl 2 reacciona con NaNO 2 fundido para dar PbO:
- PbCl 2 (l) + 3 NaNO 2 → PbO + NaNO 3 + 2 NO + 2 NaCl
El PbCl 2 se usa en la síntesis de cloruro de plomo (IV) (PbCl 4 ): Se burbujea Cl 2 a través de una solución saturada de PbCl 2 en NH 4 Cl acuoso formando [NH 4 ] 2 [PbCl 6 ]. Este último se hace reaccionar con ácido sulfúrico concentrado frío (H 2 SO 4 ) formando PbCl 4 como un aceite.
El cloruro de plomo (II) es el principal precursor de los derivados organometálicos del plomo, como los plumbocenos . Se emplean los agentes alquilantes habituales, incluidos los reactivos de Grignard y los compuestos de organolitio:
- 2 PbCl 2 + 4 RLi → R 4 Pb + 4 LiCl + Pb
- 2 PbCl 2 + 4 RMgBr → R 4 Pb + Pb + 4 MgBrCl
- 3 PbCl 2 + 6 RMgBr → R 3 Pb-PbR 3 + Pb + 6 MgBrCl
Estas reacciones producen derivados que son más similares a los compuestos de organosilicio, es decir , que el Pb (II) tiende a desproporcionarse tras la alquilación.
El PbCl 2 se puede utilizar para producir PbO 2 tratándolo con hipoclorito de sodio (NaClO), formando un precipitado marrón rojizo de PbO 2 .
Usos
- El PbCl 2 fundido se utiliza en la síntesis de cerámicas de titanato de plomo y titanato de bario y plomo mediante reacciones de sustitución de cationes:
- x PbCl 2 (l) + BaTiO 3 (s) → Ba 1− x Pb x TiO 3 + x BaCl 2
- El PbCl 2 se utiliza en la producción de vidrio transmisor de infrarrojos y vidrio ornamental llamado vidrio aureno . El vidrio aureno tiene una superficie iridiscente formada al rociar con PbCl 2 y recalentar en condiciones controladas. El cloruro estannoso (SnCl 2 ) se usa para el mismo propósito.
- El Pb se usa en el servicio de HCl aunque el PbCl 2 formado es ligeramente soluble en HCl. La adición de 6 a 25% de antimonio (Sb) aumenta la resistencia a la corrosión.
- Un cloruro básico de plomo, PbCl 2 · Pb (OH) 2 , se conoce como plomo blanco de Pattinson y se utiliza como pigmento en la pintura blanca. La pintura con plomo está ahora prohibida como un peligro para la salud en muchos países por la Convención sobre la Plomo Blanca (Pintura), 1921 .
- El PbCl 2 es un intermedio en el refinado del mineral de bismuto (Bi). El mineral que contiene Bi, Pb y Zn se trata primero con sosa cáustica fundida para eliminar las trazas de arsénico y telurio . A esto le sigue el proceso de Parkes para eliminar la plata y el oro presentes. El mineral ahora contiene Bi, Pb y Zn. Se trata con gas Cl 2 a 500 ° C. El ZnCl 2 se forma primero y se elimina. Luego se forma PbCl 2 y se elimina dejando Bi puro. BiCl 3 se formaría al final.
Toxicidad
Al igual que otros compuestos solubles de plomo, la exposición al PbCl 2 puede causar intoxicación por plomo .