Gelsolin (celular) - Gelsolin (cellular)
La gelesolina es una proteína de unión a actina que es un regulador clave del ensamblaje y desensamblaje del filamento de actina. La gelsolina es uno de los miembros más potentes de la superfamilia de gelsolina / villina que corta la actina , ya que corta con una eficacia de casi el 100%.
La gelsolina celular, que se encuentra dentro del citosol y las mitocondrias , tiene una forma secretada estrechamente relacionada, la gelsolina plasmática , que contiene una extensión adicional de 24 AA N-terminal. La capacidad de la gelsolina plasmática para cortar los filamentos de actina ayuda al cuerpo a recuperarse de enfermedades y lesiones que filtran actina celular a la sangre. Además, juega un papel importante en la inmunidad innata del huésped , activando los macrófagos y localizando la inflamación .
Estructura
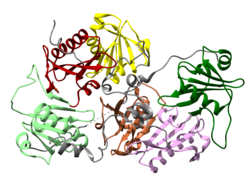
La gelesolina es una proteína de 82 kD con seis subdominios homólogos, denominados S1-S6. Cada subdominio está compuesto por una hoja β de cinco hebras , flanqueada por dos hélices α , una colocada perpendicular con respecto a las hebras y la otra paralela. Las hojas β de los tres subdominios N-terminales (S1-S3) se unen para formar una hoja β extendida, al igual que las hojas β de los subdominios C-terminales (S4-S6).
Regulación
Entre las proteínas reguladoras de actina que se unen a lípidos , la gelsolina (como la cofilina ) se une preferentemente a polifosfoinosítido (PPI). Las secuencias de unión en gelsolina se parecen mucho a los motivos de las otras proteínas de unión a PPI.
La actividad de Gelsolin es estimulada por iones de calcio (Ca 2+ ). Aunque la proteína conserva su integridad estructural general tanto en el estado activado como desactivado, la cola helicoidal S6 se mueve como un pestillo dependiendo de la concentración de iones de calcio. El extremo C-terminal detecta la concentración de calcio dentro de la célula. Cuando no hay Ca 2+ presente, la cola de S6 protege los sitios de unión a actina en una de las hélices de S2. Sin embargo, cuando un ión calcio se adhiere a la cola S6, se endereza, exponiendo los sitios de unión a la actina S2. El N-terminal está directamente involucrado en el corte de actina. S2 y S3 se unen a la actina antes de que la unión de S1 rompa los enlaces actina-actina y cubra el extremo con púas.
La gelesolina puede inhibirse mediante un aumento local de la concentración de fosfatidilinositol (4,5) -bisfosfato (PIP 2 ), un IBP. Este es un proceso de dos pasos. En primer lugar, (PIP 2 ) se une a S2 y S3, inhibiendo la gelsolina de la unión del lado de la actina. Luego, (PIP 2 ) se une al S1 de la gelsolina, evitando que la gelsolina corte la actina, aunque (PIP 2 ) no se une directamente al sitio de unión a la actina de la gelsolina.
La separación de la actina de Gelsolin, en contraste con la separación de los microtúbulos por la catanina , no requiere ningún aporte de energía adicional.
Función celular
Como importante regulador de la actina, la gelsolina desempeña un papel en la formación de podosomas (junto con Arp3, cortactina y Rho GTPasas).
La gelesolina también inhibe la apoptosis estabilizando las mitocondrias . Antes de la muerte celular, las mitocondrias normalmente pierden el potencial de membrana y se vuelven más permeables. La gelesolina puede impedir la liberación de citocromo C , obstruyendo la amplificación de la señal que habría llevado a la apoptosis.
La actina se puede reticular en un gel mediante proteínas de reticulación de actina. Gelsolin puede convertir este gel en un sol , de ahí el nombre gelsolin.
Estudios con animales
La investigación en ratones sugiere que la gelsolina, como otras proteínas que cortan la actina, no se expresa en un grado significativo hasta después de la etapa embrionaria temprana, aproximadamente 2 semanas en embriones murinos . Sin embargo, en muestras adultas, la gelsolina es particularmente importante en células móviles, como las plaquetas sanguíneas . Los ratones con genes que codifican gelsolina nulos experimentan un desarrollo embrionario normal , pero la deformación de sus plaquetas sanguíneas redujo su motilidad, lo que resultó en una respuesta más lenta a la cicatrización de heridas.
También se ha demostrado que una insuficiencia de gelsolina en ratones provoca un aumento de la permeabilidad de la barrera pulmonar vascular, lo que sugiere que la gelsolina es importante en la respuesta a la lesión pulmonar.
Proteínas relacionadas
| Dominio similar a la gelesolina | |
|---|---|

3FG7 ; Dominio 6 de la villina-1: un dominio similar a la gelsolina. La hélice larga es recta, consistente con laforma de gelsolina activadacon Ca 2+ .
| |
| Identificadores | |
| Símbolo | ? |
Las comparaciones de secuencias indican una relación evolutiva entre gelsolina, villin , fragmin y severin . Seis segmentos grandes que se repiten en gelsolina y villin, y tres segmentos similares en severin y fragmin. Las múltiples repeticiones están relacionadas en estructura (pero apenas en secuencia) con el dominio ADF-H , formando una superfamilia ( InterPro : IPR029006 ). La familia parece haber evolucionado a partir de una secuencia ancestral de 120 a 130 residuos de aminoácidos .
Las arqueas de Asgard codifican muchas gelsolinas funcionales.
Interacciones
La gelesolina es una proteína citoplasmática , regulada por calcio y moduladora de la actina que se une a los extremos con púas de los filamentos de actina , evitando el intercambio de monómeros (bloqueo o taponamiento de los extremos). Puede promover la nucleación (el ensamblaje de monómeros en filamentos), así como también cortar los filamentos existentes . Además, esta proteína se une con alta afinidad a la fibronectina . La gelsolina plasmática y la gelsolina citoplasmática se derivan de un solo gen mediante sitios de iniciación alternativos y corte y empalme diferencial .
Se ha demostrado que la gelesolina interactúa con:
Ver también
Referencias
enlaces externos
- Gelsolin en los encabezamientos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .