Dess – Martin periodinane - Dess–Martin periodinane
|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
Triacetato de 3-oxo-1λ 5 , 2-benziodoxol-1,1,1 (3 H ) -triilo |
|
| Otros nombres
Dess – Martin periodinane
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Tarjeta de información ECHA |
100.197.885 |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 13 H 13 IO 8 | |
| Masa molar | 424,14 g / mol |
| Apariencia | polvo blanco, chips, cristales o polvo y / o trozos cristalinos |
| Densidad | 1,362 g / cm 3 sólido |
| Punto de fusion | 103 a 133 ° C (217 a 271 ° F; 376 a 406 K) |
| Compuestos relacionados | |
|
Compuestos relacionados
|
Ácido 2-yodoxibenzoico |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
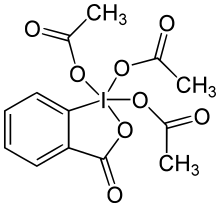
El periodinano de Dess-Martin ( DMP ) es un reactivo químico utilizado en la oxidación de Dess-Martin , que oxida los alcoholes primarios a aldehídos y los alcoholes secundarios a cetonas . Este periodinano tiene varias ventajas sobre los oxidantes a base de cromo y DMSO que incluyen condiciones más suaves (temperatura ambiente, pH neutro), tiempos de reacción más cortos, mayores rendimientos, tratamientos simplificados, alta quimioselectividad, tolerancia de grupos funcionales sensibles y una larga vida útil. Sin embargo, el uso a escala industrial se ve dificultado por su costo y su naturaleza potencialmente explosiva. Lleva el nombre de los químicos estadounidenses Daniel Benjamin Dess y James Cullen Martin, que desarrollaron el reactivo en 1983. Se basa en IBX , pero debido a los grupos acetato unidos al átomo de yodo central, DMP es mucho más reactivo que IBX y es mucho más reactivo. más soluble en disolventes orgánicos.
Preparación
Se ha determinado que la síntesis más amigable de IBX es tratar el ácido 2-yodobenzoico con oxona en agua, a temperaturas elevadas durante 3 horas. A continuación, IBX se acila utilizando las modificaciones de Irlanda y Liu del procedimiento original. Estas modificaciones permitieron mayores rendimientos y un procedimiento de elaboración simplificado. Los sólidos resultantes se pueden obtener mediante filtración y lavado con éter. Ireland y Liu utilizaron una cantidad catalítica de ácido tosílico , lo que permitió que la reacción se completara en menos de 2 horas (en comparación con la síntesis clásica, utilizando 24 horas) y con rendimientos superiores al 90%.
El método clásico presentado por Boeckman y Mullins implicaba calentar una solución de bromato de potasio , ácido sulfúrico , ácido 2-yodobenzoico para producir IBX (1-hidroxi-1,2-benziodoxol-3 (1H) -ona 1-óxido, 2-yodoxibenzoico ácido ). Luego se aciló IBX usando ácido acético y anhídrido acético .
Mecanismo de oxidación
El periodinano de Dess-Martin se utiliza principalmente como oxidante para alcoholes complejos, sensibles y multifuncionales . Una de las razones de su eficacia es su alta selectividad hacia la complejación del grupo hidroxilo , lo que permite que los alcoholes realicen un intercambio de ligandos rápidamente ; el primer paso en la reacción de oxidación.
La RMN de protón ha indicado que el uso de un equivalente de alcohol forma el diacetoxialcoxiperiodinano intermedio. El acetato actúa luego como base para desprotonar el α-H del alcohol para producir el compuesto de carbonilo , yodo y ácido acético .
Cuando se usa un diol o más de un equivalente de alcohol, en su lugar se forma acetoxidialcoxiperiodinano. Debido a la naturaleza lábil de este periodinano en particular, la oxidación ocurre mucho más rápido.
Schreiber y colaboradores han demostrado que el agua aumenta la velocidad de la reacción de oxidación. Dess y Martin habían observado originalmente que la oxidación del etanol aumentaba cuando había un equivalente extra de etanol. Se cree que la velocidad de disociación del ligando acetato final del yodo aumenta debido a la capacidad donadora de electrones del grupo hidroxilo (debilitando así el enlace I-OAc).
Quimioselectividad
Usando las condiciones estándar de periodinano de Dess-Martin, los alcoholes se pueden oxidar a aldehídos / cetonas sin afectar los anillos de furano , sulfuros , viniléteres y amidas secundarias . Los alcoholes alílicos se oxidan fácilmente usando DMP, que normalmente son difíciles de convertir en sus respectivos carbonilos usando los oxidantes típicos.
Myers y colaboradores determinaron que el DMP podía oxidar los aminoalcoholes N-protegidos, sin epimerización (a diferencia de la mayoría de los otros oxidantes, incluida la oxidación de Swern). Estos aminoalcoholes protegidos pueden ser muy importantes en la industria farmacéutica.
Los alcoholes bencílicos y alílicos reaccionan más rápido que los alcoholes saturados, mientras que el DMP oxida las aldoximas y cetoximas a sus respectivos aldehídos y cetonas, más rápido que un alcohol primario, secundario o bencílico a su respectivo carbonilo.
En un ejemplo de la oxidación de Dess-Martin, implica la transformación de un alcohol insaturado α-β sensible en su aldehído correspondiente. Este resto se ha encontrado en varios productos naturales y, debido a su alta funcionalidad, podría ser un valioso componente sintético en la síntesis orgánica. Thongsornkleeb y Danheiser oxidaron este alcohol sensible empleando la oxidación de Dess Martin y alterando el procedimiento de elaboración (diluyendo con pentanos, lavando con poli ( 4-vinilpiridina ) para eliminar el ácido acético generado durante la reacción, filtrando y concentrando por destilación.
t- butilo DMP
Los alcoholes difluoro y monofluoro son más difíciles de oxidar. Se ha utilizado la oxidación de Swern , pero tuvo que emplearse un gran exceso del oxidante y, en algunos casos, no dio resultados reproducibles. Linderman y Graves encontraron que la DMP tuvo éxito en la mayoría de los casos, pero no pudo tolerar la presencia de grupos funcionales nucleofílicos en el alcohol, ya que estos reaccionaban con la DMP desplazando el acetato. El uso del compuesto que se muestra a continuación produjo los carbonilos deseados con altos rendimientos ya que la adición del grupo terc -butoxi , debido a su volumen estérico , minimiza estas reacciones secundarias.
Ver también
- Oxidación de alcohol
- Clorocromato de piridinio
- Oxidación de Jones
- Oxidación de Oppenauer
- Oxidación de Pfitzner-Moffatt
- Oxidación de Parikh-Doering
- Oxidación de Albright-Goldman
- Oxidación de Swern
- Oxidación de Corey-Kim
- Oxidación Ley ( oxidación TPAP )
- Oxidación TEMPO







