Ácido cianúrico - Cyanuric acid
|
|||
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
1,3,5-triazinano-2,4,6-triona |
|||
| Otros nombres
1,3,5-triazina-2,4,6 (1 H , 3 H , 5 H ) -triona
1,3,5-Triazinetriol s -Triazinetriol s -Triazinetrione Tricarbimide isocianúrico ácido ácido Pseudocyanuric |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.003.290 |
||
| KEGG | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 3 H 3 N 3 O 3 | |||
| Masa molar | 129,07 g / mol | ||
| Apariencia | polvo cristalino blanco | ||
| Densidad | 1,75 g / cm 3 | ||
| Punto de fusion | 320–360 ° C (608–680 ° F; 593–633 K) se descompone | ||
| 0,27 g / 100 ml (25 ° C) | |||
| -61,5 · 10 −6 cm 3 / mol | |||
| Peligros | |||
| Ficha de datos de seguridad | ICSC 1313 | ||
| Compuestos relacionados | |||
|
Triazinas relacionadas
|
Fluoruro cianúrico Cloruro cianúrico Bromuro cianúrico |
||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El ácido cianúrico o 1,3,5-triazina-2,4,6-triol es un compuesto químico con la fórmula (CNOH) 3 . Como muchos productos químicos de utilidad industrial, esta triazina tiene muchos sinónimos. Este sólido blanco e inodoro se utiliza como precursor o componente de blanqueadores , desinfectantes y herbicidas. En 1997, la producción mundial fue de 160 millones de kilogramos.
Propiedades y síntesis
Propiedades
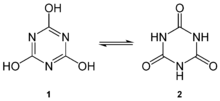
El ácido cianúrico se puede ver como el trímero cíclico de la elusiva especie de ácido cianico, HOCN. El anillo puede interconvertirse fácilmente entre dos estructuras mediante tautomería ceto-enólica . Aunque el tautómero de triol puede tener carácter aromático , la forma ceto predominante en solución. Los grupos hidroxilo (-OH) asumen un carácter fenólico . La desprotonación con base proporciona una serie de sales de cianurato :
- [C (O) NH] 3 ⇌ [C (O) NH] 2 [C (O) N] - + H + (pK a = 6,88)
- [C (O) NH] 2 [C (O) N] - ⇌ [C (O) NH] [C (O) N] 2 2− + H + (pK a = 11,40)
- [C (O) NH] [C (O) N] 2 2− ⇌ [C (O) N] 3 3− + H + (pK a = 13.5)
El ácido cianúrico se caracteriza por su fuerte interacción con la melamina , formando cianurato de melamina insoluble . Esta interacción bloquea el ácido cianúrico en el tautómero tri-ceto .
Síntesis
El ácido cianúrico (CYA) fue sintetizado por primera vez por Friedrich Wöhler en 1829 mediante la descomposición térmica de urea y ácido úrico . La ruta industrial actual hacia CYA implica la descomposición térmica de urea, con liberación de amoníaco . La conversión comienza aproximadamente a 175 ° C:
- 3 H 2 N-CO-NH 2 → [C (O) NH] 3 + 3 NH 3
CYA cristaliza en agua como dihidrato.
El ácido cianúrico se puede producir por hidrólisis de melamina bruta o residual seguida de cristalización . Las corrientes de desechos ácidos de las plantas que producen estos materiales contienen ácido cianúrico y, en ocasiones, triazinas sustituidas con amino disueltas, a saber, ammelina , ammelida y melamina. En un método, una solución de sulfato de amonio se calienta a ebullición y se trata con una cantidad estequiométrica de melamina, por lo que el ácido cianúrico presente precipita como un complejo de melamina-ácido cianúrico . Las diversas corrientes de desechos que contienen ácido cianúrico y triazinas sustituidas con amino pueden combinarse para su eliminación, y durante las condiciones adversas puede haber ácido cianúrico no disuelto en las corrientes de desechos .
Intermedios e impurezas
Los intermedios en la deshidratación incluyen tanto ácido isociánico , biuret y triuret :
- H 2 N-CO-NH 2 → HNCO + NH 3
- H 2 N-CO-NH 2 + HNCO → H 2 N-CO-NH-CO-NH 2
- H 2 N-CO-NH-CO-NH 2 + HNCO → H 2 N-CO-NH-CO-NH-CO-NH 2
Una impureza en la producción de CYA es la ammelida , especialmente si la temperatura de reacción excede los 190 ° C: 3 H 2 N-CO-NH-CO-NH 2 → [C (O)] 2 (CNH 2 ) (NH) 2 N + 2 NH 3 + H 2 O La primera aparición de ammelamida ocurre antes de los 225 ° C y se sospecha que también ocurre por la descomposición del biuret, pero se produce a una velocidad más lenta que la del CYA.
La formación de melamina, [C (NH 2 ) N] 3 , se produce entre 325 y 350 ° C y solo en cantidades muy pequeñas.
Aplicaciones
El ácido cianúrico se utiliza como estabilizador / tampón de cloro en piscinas . Se une al cloro libre y lo libera lentamente, extendiendo el tiempo necesario para agotar cada dosis de desinfectante .
El fármaco antineoplásico teroxirona se forma haciendo reaccionar ácido cianúrico con 3 equivalentes de epiclorhidrina .
Precursores de cianuratos clorados
El ácido cianúrico se utiliza principalmente como precursor de los cianuratos clorados N , que se utilizan para desinfectar el agua. El derivado dicloro se prepara mediante cloración directa:
- [C (O) NH] 3 + 2 Cl 2 + 2 NaOH → [C (O) NCl] 2 [C (O) NH]
Esta especie se convierte típicamente en su sal de sodio , dicloro-s-triazinetriona de sodio . La cloración adicional da ácido tricloroisocianúrico , [C (O) NCl] 3 . Estos compuestos de N- cloro sirven como desinfectantes y algicidas para el agua de las piscinas. Estabiliza el cloro de la piscina y evita que el cloro sea consumido rápidamente por la luz solar .
Precursores de reticulantes
Debido a su trifuncionalidad, CYA es un precursor de los agentes reticulantes , especialmente para resinas de poliuretano y plásticos termoendurecibles de poliisocianurato .
Análisis
La prueba de concentración de ácido cianúrico se realiza comúnmente con una prueba turbidométrica , que utiliza un reactivo, melamina, para precipitar el ácido cianúrico. La turbidez relativa de la muestra reaccionada cuantifica la concentración de CYA. Referenciada en 1957, esta prueba funciona porque la melamina se combina con el ácido cianúrico en el agua para formar un precipitado blanco fino e insoluble ( cianurato de melamina ) que hace que el agua se enturbie en proporción a la cantidad de ácido cianúrico que contiene. Más recientemente, se ha desarrollado un método sensible para analizar el ácido cianúrico en la orina .
La alimentación animal
La FDA permite que una cierta cantidad de ácido cianúrico esté presente en algunos aditivos de nitrógeno no proteico (NPN) que se utilizan en la alimentación animal y el agua potable . El ácido cianúrico se ha utilizado como NPN. Por ejemplo, Archer Daniels Midland fabrica un suplemento NPN para ganado, que contiene biuret, triuret, ácido cianúrico y urea .
Retiros del mercado de alimentos para mascotas en 2007
El ácido cianúrico está relacionado con el retiro de alimentos para mascotas de 2007 , la contaminación y el retiro generalizado de muchas marcas de alimentos para gatos y perros a partir de marzo de 2007. Las investigaciones han encontrado evidencia de que el ácido cianúrico, un componente de la orina, junto con la melamina se forman poco solubles. cristales que pueden causar insuficiencia renal (ver la sección de Análisis anterior).
Seguridad
El ácido cianúrico se clasifica como "esencialmente no tóxico". La dosis letal media oral al 50% ( DL 50 ) es de 7700 mg / kg en ratas.
Sin embargo, cuando el ácido cianúrico está presente junto con la melamina (que en sí misma es otra sustancia de baja toxicidad), formará un complejo insoluble y bastante nefrotóxico , como se demostró en perros y gatos durante la contaminación de alimentos para mascotas de 2007 y en niños durante la de 2008. Casos de escándalo de la leche china .
Ocurrencia natural
La sal de cobre impuro del ácido, con la fórmula Cu (C 3 N 3 O 3 H 2 ) 2 (NH 3 ) 2 , es actualmente el único mineral de isocianurato conocido, llamado joanneumita . Fue encontrado en un depósito de guano en Chile . Es muy raro.
Referencias
enlaces externos
- Tarjeta internacional de seguridad química 1313
- Página de contaminación de alimentos para mascotas de la Asociación Médica Veterinaria de Oregón (OVMA) : novedades y novedades que se actualizan periódicamente