Chlamydia trachomatis -Chlamydia trachomatis
| Chlamydia trachomatis | |
|---|---|
|
|
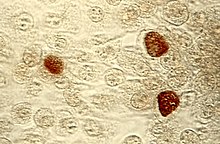
| Chlamydia trachomatis en marrón | |
|
clasificación cientifica |
|
| Dominio: | Bacterias |
| Filo: | Clamidias |
| Clase: | Clamidias |
| Pedido: | Chlamydiales |
| Familia: | Clamidáceas |
| Género: | Clamidia |
| Especies: |
C. trachomatis
|
| Nombre binomial | |
|
Chlamydia trachomatis (Busacca 1935) Rastrillo 1957 enmienda. Everett y col. 1999
|
|
| Sinónimos | |
|
|
Chlamydia trachomatis ( / k l ə m ɪ d i ə t r ə k oʊ m ə t ɪ s / ), comúnmente conocida como la clamidia, es una bacteria que causa la clamidia , que puede manifestarse de varias maneras, incluyendo: tracoma , linfogranuloma venéreo , uretritis no gonocócica , cervicitis , salpingitis , enfermedad pélvica inflamatoria . C. trachomatis es la causa infecciosa más común de ceguera y la bacteria de transmisión sexual más común.
Los diferentes tipos de C. trachomatis causan diferentes enfermedades. Las cepas más comunes causan enfermedades en el tracto genital , mientras que otras cepas causan enfermedades en los ojos o los ganglios linfáticos. Como otras especies de Chlamydia , el ciclo de vida de C. trachomatis consta de dos etapas de vida morfológicamente distintas: cuerpos elementales y cuerpos reticulados. Los cuerpos elementales son como esporas e infecciosos, mientras que los cuerpos reticulados se encuentran en la etapa de replicación y solo se ven dentro de las células hospedadoras.
Descripción
Chlamydia trachomatis es una bacteria gramnegativa que solo puede replicarse dentro de una célula huésped . A lo largo del ciclo de vida de C. trachomatis , las bacterias adoptan dos formas distintas. Los cuerpos elementales tienen de 200 a 400 nanómetros de diámetro y están rodeados por una pared celular rígida que les permite sobrevivir fuera de la célula huésped. Esta forma puede iniciar una nueva infección si entra en contacto con una célula huésped susceptible. Los cuerpos reticulados tienen de 600 a 1500 nanómetros de diámetro y se encuentran solo dentro de las células huésped. Ninguna forma es móvil.
El genoma de C. trachomatis es sustancialmente más pequeño que el de muchas otras bacterias en aproximadamente 1.04 megabases , codificando aproximadamente 900 genes. Varias funciones metabólicas importantes no están codificadas en el genoma de C. trachomatis y, en cambio, es probable que se eliminen de la célula huésped. Además del cromosoma que contiene la mayor parte del genoma, casi todas las cepas de C. trachomatis llevan un plásmido de 7,5 kilobase que contiene 8 genes. Se desconoce la función de este plásmido, aunque se han aislado cepas sin el plásmido, lo que sugiere que no es necesario para la supervivencia de la bacteria.
Ciclo vital
Como otras especies de Chlamydia , C. trachomatis tiene un ciclo de vida que consta de dos formas morfológicamente distintas. Primero, C. trachomatis se adhiere a una nueva célula huésped como una pequeña forma parecida a una espora llamada cuerpo elemental . El cuerpo elemental ingresa a la célula huésped, rodeado por una vacuola huésped , llamada inclusión. Dentro de la inclusión, C. trachomatis se transforma en una forma más grande y metabólicamente activa llamada cuerpo reticulado . El cuerpo reticulado modifica sustancialmente la inclusión, haciéndolo un ambiente más acogedor para la rápida replicación de la bacteria, que ocurre durante las siguientes 30 a 72 horas. La gran cantidad de bacterias intracelulares luego regresa a cuerpos elementales resistentes, antes de hacer que la célula se rompa y se libere al medio ambiente. Estos nuevos cuerpos elementales luego se eliminan en el semen o se liberan de las células epiteliales del tracto genital femenino y se adhieren a las nuevas células huésped.
Clasificación
C. trachomatis son bacterias del género Chlamydia , un grupo de parásitos intracelulares obligados de células eucariotas . Las células clamidiales no pueden llevar a cabo el metabolismo energético y carecen de vías biosintéticas.
Las cepas de C. trachomatis generalmente se dividen en tres biovariedades según el tipo de enfermedad que causan. Estos se subdividen en varias serovares basadas en los antígenos de superficie reconocidos por el sistema inmunológico. Los serovares A a C causan tracoma, que es la principal causa mundial de ceguera infecciosa prevenible. Los serovares D a K infectan el tracto genital y causan enfermedad pélvica inflamatoria, embarazos ectópicos e infertilidad. Los serovares L1 a L3 causan una infección invasiva de los ganglios linfáticos cerca de los genitales, denominada linfogranuloma venéreo .
Se cree que C. trachomatis se separó de otras especies de Chlamydia hace unos 6 millones de años. Este género contiene un total de nueve especies: C. trachomatis , C. muridarum , C. pneumoniae , C. pecorum , C. suis , C. abortus , C. felis , C. caviae y C. psittaci . El pariente más cercano a C. trachomatis es C. muridarum , que infecta ratones. Se ha descubierto que C. trachomatis junto con C. pneumoniae infectan a los seres humanos en mayor medida. C. trachomatis infecta exclusivamente a los seres humanos. C. pneumoniae también infecta a caballos, marsupiales y ranas. Algunas de las otras especies pueden tener un impacto considerable en la salud humana debido a su conocida transmisión zoonótica.
|
Cepas que causan linfogranuloma venéreo (serovares L1 a L3) |
|||||||||||||
|
|||||||||||||
Papel en la enfermedad
Los signos y síntomas clínicos de la infección por C. trachomatis en los genitales se presentan como la infección por clamidia, que puede ser asintomática o parecerse a una infección por gonorrea . Ambas son causas comunes de muchas otras afecciones, incluidas la enfermedad inflamatoria pélvica y la uretritis .
C. trachomatis es el agente infeccioso individual más importante asociado con la ceguera (tracoma), y también afecta a los ojos en forma de conjuntivitis de inclusión y es responsable de aproximadamente el 19% de los casos de conjuntivitis en adultos.
C. trachomatis en los pulmones se presenta como la infección respiratoria por chlamydia pneumoniae y puede afectar a todas las edades.
Patogénesis
Los cuerpos elementales generalmente están presentes en el semen de los hombres infectados y en las secreciones vaginales de las mujeres infectadas. Cuando entran en contacto con una nueva célula huésped, los cuerpos elementales se unen a la célula mediante la interacción entre adhesinas en su superficie y varias proteínas receptoras del huésped y proteoglicanos heparán sulfato . Una vez adheridas, las bacterias inyectan varias proteínas efectoras en la célula huésped utilizando un sistema de secreción de tipo tres . Estos efectores activan la célula huésped para que absorba los cuerpos elementales y evitan que la célula desencadene la apoptosis . Dentro de las 6 a 8 horas posteriores a la infección, los cuerpos elementales se transforman en cuerpos reticulados y se sintetizan varios efectores nuevos. Estos efectores incluyen una serie de proteínas que modifican la membrana de inclusión, llamadas proteínas Inc , así como proteínas que redirigen las vesículas del hospedador hacia la inclusión. De 8 a 16 horas después de la infección, se sintetiza otro conjunto de efectores, lo que impulsa la adquisición de nutrientes de la célula huésped. En esta etapa, los cuerpos reticulados comienzan a dividirse, lo que hace que la inclusión se expanda. Si varios cuerpos elementales han infectado una sola célula, sus inclusiones se fusionarán en este punto para crear una única inclusión grande en la célula huésped. De 24 a 72 horas después de la infección, los cuerpos reticulados pasan a cuerpos elementales que se liberan por lisis de la célula huésped o por extrusión de toda la inclusión en el tracto genital del huésped.
Presentación
La mayoría de las personas infectadas por C. trachomatis son asintomáticas. Sin embargo, la bacteria puede presentarse de tres formas: genitourinaria (genitales), pulmonar (pulmones) y ocular (ojos).
Los casos genitourinarios pueden incluir secreción genital, sangrado vaginal, picazón (prurito), micción dolorosa (disuria), entre otros síntomas. A menudo, los síntomas son similares a los de una infección del tracto urinario .
Cuando C. trachomatis se presenta en el ojo en forma de tracoma, comienza engrosando gradualmente los párpados y, finalmente, comienza a tirar de las pestañas hacia el párpado. En forma de conjuntivitis de inclusión, la infección se presenta con enrojecimiento, hinchazón, secreción mucopurulenta del ojo y la mayoría de los otros síntomas asociados con la conjuntivitis del adulto.
Cuando C. trachomatis se encuentra en los pulmones en forma de una infección respiratoria, generalmente presenta síntomas de secreción o congestión nasal, fiebre baja, ronquera y otros síntomas asociados con la neumonía general.
C. trachomatis puede infectar de forma latente los tejidos de las vellosidades coriónicas de las mujeres embarazadas, lo que afecta el resultado del embarazo.
Predominio
Tres veces más mujeres son diagnosticadas con infecciones genitourinarias por C. trachomatis que hombres. Las mujeres de 15 a 19 años tienen la prevalencia más alta, seguidas de las mujeres de 20 a 24 años, aunque la tasa de aumento del diagnóstico es mayor en los hombres que en las mujeres. Los factores de riesgo de infecciones genitourinarias incluyen relaciones sexuales sin protección con múltiples parejas, falta de uso de condones y un nivel socioeconómico bajo que viven en áreas urbanas.
Las infecciones pulmonares pueden ocurrir en bebés nacidos de mujeres con infecciones por clamidia activa, aunque la tasa de infección es inferior al 10%.
Las infecciones oculares toman la forma de conjuntivitis de inclusión o tracoma, tanto en adultos como en niños. Aproximadamente 84 millones en todo el mundo sufren infecciones oculares por C. trachomatis y 8 millones quedan ciegos como resultado de la infección. El tracoma es la principal fuente de ceguera infecciosa en algunas partes de las zonas rurales de África y Asia y es una enfermedad tropical desatendida que ha sido el objetivo de la Organización Mundial de la Salud para su eliminación para 2020. La conjuntivitis de inclusión de C. trachomatis es responsable de aproximadamente el 19% de los adultos casos de conjuntivitis.
Tratamiento
El tratamiento depende del sitio de la infección, la edad del paciente y si hay otra infección presente. Es posible tener C. trachomatis y una o más infecciones de transmisión sexual al mismo tiempo. El tratamiento a menudo se realiza con ambos socios simultáneamente para prevenir una reinfección. C. trachomatis puede tratarse con varios antibióticos, como azitromicina , eritromicina , ofloxacina y tetraciclina.
La tetraciclina es el antibiótico más preferido para tratar C. trachomatis y tiene la tasa de éxito más alta . La azitromicina y la doxiciclina tienen la misma eficacia para tratar C. trachomatis con 97 y 98 por ciento de éxito, respectivamente. La azitromicina se dosifica como una tableta de 1 gramo que se toma por vía oral como una dosis única, principalmente para ayudar con las preocupaciones de incumplimiento. El tratamiento con doxiciclina genérica 100 mg dos veces al día durante 7 días tiene el mismo éxito que la costosa doxiciclina de liberación retardada 200 mg una vez al día durante 7 días. La eritromicina es menos preferida ya que puede causar efectos secundarios gastrointestinales, que pueden conducir a la falta de adherencia. La levofloxacina y la ofloxacina generalmente no son mejores que la azitromicina o la doxiciclina y son más caras.
Si el tratamiento es necesario durante el embarazo, no se prescriben levofloxacina , ofloxacina, tetraciclina ni doxiciclina . En el caso de una paciente embarazada, los medicamentos que normalmente se recetan son azitromicina, amoxicilina y eritromicina. La azitromicina es el medicamento recomendado y se toma como una tableta de 1 gramo por vía oral en una sola dosis. A pesar de que la amoxicilina tiene menos efectos secundarios que los otros medicamentos para tratar la infección prenatal por C. trachomatis , ha existido la preocupación de que las mujeres embarazadas que toman antibióticos del tipo de la penicilina puedan desarrollar la persistencia de la clamidia. La tetraciclina no se usa porque algunos niños e incluso adultos no pueden soportar la droga, causando daño a la madre y al feto. La repetición de la prueba durante el embarazo se puede realizar tres semanas después del tratamiento. Si el riesgo de reinfección es alto, la detección se puede repetir durante todo el embarazo.
Si la infección ha progresado, asciende por el tracto reproductivo y se desarrolla una enfermedad inflamatoria pélvica, es posible que ya se hayan producido daños en las trompas de Falopio. En la mayoría de los casos, la infección por C. trachomatis se trata de forma ambulatoria con azitromicina o doxiciclina. Se recomienda tratar a la madre de un bebé con C. trachomatis del ojo, que puede evolucionar a neumonía. El tratamiento recomendado consiste en eritromicina base oral o etilsuccinato 50 mg / kg / día divididos en 4 dosis diarias durante dos semanas mientras se monitorean los síntomas de la estenosis pilórica hipertrófica infantil (IHPS) en bebés menores de 6 semanas.
Se han notificado algunos casos de cepas de C. trachomatis resistentes a múltiples tratamientos con antibióticos. Sin embargo, a partir de 2018, esta no es una causa importante de preocupación, ya que la resistencia a los antibióticos es rara en C. trachomatis en comparación con otras bacterias infecciosas.
Pruebas de laboratorio
Las especies de clamidia se identifican y distinguen fácilmente de otras especies de clamidia mediante pruebas basadas en ADN. Las pruebas para la clamidia se pueden solicitar a un médico, un laboratorio o en línea.
La mayoría de las cepas de C. trachomatis son reconocidas por anticuerpos monoclonales (mAb) contra epítopos en la región VS4 de MOMP. Sin embargo, estos mAb también pueden reaccionar de forma cruzada con otras dos especies de Chlamydia , C. suis y C. muridarum .
- Las pruebas de amplificación de ácidos nucleicos (NAAT) encuentran el material genético (ADN) de la bacteria Chlamydia . Estas pruebas son las más sensibles disponibles, lo que significa que son muy precisas y es muy poco probable que obtengan resultados falsos negativos. Una prueba de reacción en cadena de la polimerasa (PCR) es un ejemplo de una prueba de amplificación de ácido nucleico . Esta prueba también se puede realizar en una muestra de orina, hisopos uretrales en hombres o hisopos cervicales o vaginales en mujeres.
- Las pruebas de hibridación de ácidos nucleicos (prueba de sonda de ADN) también encuentran ADN de Chlamydia . Una prueba de sonda es muy precisa pero no tan sensible como las NAAT.
- El ensayo inmunoabsorbente ligado a enzimas (ELISA, EIA) encuentra sustancias ( antígenos de Chlamydia ) que activan el sistema inmunológico para combatir la infección por Chlamydia . El cuerpo elemental de clamidia (EB) -ELISA podría usarse para estratificar las diferentes etapas de la infección según el estado de inmunoglobulina-γ de los individuos infectados
- La prueba de anticuerpos fluorescentes directos también detecta antígenos de Chlamydia .
- El cultivo de células de clamidia es una prueba en la que la muestra sospechosa de clamidia se cultiva en un vial de células. El patógeno infecta las células y, después de un tiempo de incubación establecido (48 horas), los viales se tiñen y se ven en un microscopio de luz fluorescente. El cultivo celular es más caro y lleva más tiempo (dos días) que las otras pruebas. El cultivo debe cultivarse en un laboratorio.
Investigar
Debido a su importancia para la salud humana, C. trachomatis es objeto de investigación en laboratorios de todo el mundo. Las bacterias se cultivan comúnmente en líneas celulares inmortalizadas como las células McCoy (ver RPMI 1640 ) y las células HeLa . Las partículas infecciosas se pueden cuantificar infectando capas de células y contando el número de inclusiones, de forma análoga a un ensayo de placa . Investigaciones recientes han descubierto que un par de proteínas de enlace disulfuro, que son necesarias para que C. trachomatis pueda infectar las células huésped, es muy similar a un par de proteínas homólogas que se encuentran en Escherichia coli (E. coli), aunque la velocidad de la reacción es más lento en C. trachomatis .
Se han realizado otras investigaciones para tratar de tener una idea de cómo crear una vacuna contra C. trachomatis, encontrando que sería muy difícil crear una vacuna completamente efectiva o incluso parcialmente efectiva, ya que la respuesta del huésped a la infección involucra vías inmunológicas complejas que primero debe entenderse completamente para garantizar que se eviten los efectos adversos.
Vacuna
En agosto de 2016, el Danish Statens Serum Institut en el Hammersmith Hospital de Londres, Reino Unido, llevó a cabo un ensayo clínico de fase I, doble ciego, paralelo, aleatorizado y controlado con placebo , en mujeres sanas de 19 a 45 años. El ensayo tuvo como objetivo evaluar la seguridad y la capacidad de provocar una respuesta inmune de la vacuna contra la clamidia CTH522. En el ensayo se incluyeron 35 mujeres no infectadas con clamidia. El ensayo incluyó dos adyuvantes y un grupo de control de solución salina. Se encontró que la vacuna era segura y todas las mujeres que recibieron la vacuna independientemente del adyuvante desarrollaron una respuesta inmune contra la clamidia.
El Serum Institute ha anunciado que seguirá buscando financiación para llevar la vacuna a un ensayo de fase II.
Historia
C. trachomatis fue descrita por primera vez en 1907 por Stanislaus von Prowazek y Ludwig Halberstädter en raspados de casos de tracoma. Pensando que habían descubierto un "protozoo de manto", llamaron al organismo "Chlamydozoa" del griego "Chlamys", que significa manto. Durante las siguientes décadas, se pensó que el "clamidozoo" era un virus, ya que era lo suficientemente pequeño para pasar a través de filtros bacterianos y no podía crecer en medios de laboratorio conocidos. Sin embargo, en 1966, los estudios de microscopía electrónica mostraron que C. trachomatis era una bacteria. Esto se debe esencialmente al hecho de que se descubrió que poseen ADN, ARN y ribosomas como otras bacterias. A diferencia de las paredes celulares de la mayoría de las otras bacterias, la clamidia carece de ácido murámico, lo que dificulta la tinción de la pared celular. La bacteria todavía se clasifica como gramnegativa.
El agente C. trachomatis fue cultivado y aislado por primera vez en los sacos vitelinos de los huevos por Tang Fei-fan et al. en 1957. Este fue un hito importante porque fue posible preservar estos agentes que luego podrían usarse para futuros estudios genómicos y filogenéticos. El aislamiento de C. trachomatis acuñó el término aislado para describir cómo C. trachomatis se ha aislado de un entorno in vivo en una "cepa" en cultivo celular. Sólo se han estudiado en detalle unos pocos "aislados", lo que limita la información que se puede encontrar sobre la historia evolutiva de C. trachomatis .
Evolución
En la década de 1990 se demostró que existen varias especies de clamidia . Chlamydia trachomatis se describió por primera vez en registros históricos en el papiro de Ebers escrito entre 1553 y 1550 a. C. En el mundo antiguo, se conocía como la enfermedad cegadora tracoma. La enfermedad puede haber estado estrechamente relacionada con los humanos y probablemente haya sido anterior a la civilización. Ahora se sabe que C. trachomatis comprende 19 serovares que se identifican mediante anticuerpos monoclonales que reaccionan con los epítopos de la proteína principal de la membrana externa (MOMP). La comparación de secuencias de aminoácidos revela que MOMP contiene cuatro segmentos variables: S1,2, 3 y 4. Diferentes variantes del gen que codifica MOMP, diferencian los genotipos de los diferentes serovares. La relación antigénica de las serovares refleja los niveles de homología de ADN entre genes MOMP, especialmente dentro de estos segmentos.
Además, se han realizado más de 220 ensayos de la vacuna contra la clamidia en ratones y otras especies hospedadoras no humanas para atacar las cepas de C. muridarum y C. trachomatis . Sin embargo, ha sido difícil trasladar estos resultados a la especie humana debido a diferencias fisiológicas y anatómicas. Los ensayos futuros están trabajando con especies estrechamente relacionadas con el ser humano.
Ver también
Referencias
Otras lecturas
- Bellaminutti, Serena; Seracini, Silva; De Seta, Francesco; Gheit, Tarik; Tommasino, Massimo; Comar, Manola (noviembre de 2014). "Co-detección de VPH y Chlamydia trachomatis en mujeres jóvenes asintomáticas del área de alta incidencia de cáncer de cuello uterino". Revista de Virología Médica . 86 (11): 1920-1925. doi : 10.1002 / jmv.24041 . PMID 25132162 . S2CID 29787203 .
enlaces externos
| Scholia tiene un perfil de tema para Chlamydia trachomatis . |

