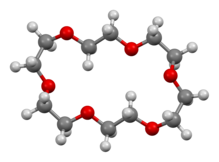
18-Corona-6 - 18-Crown-6

|
|
|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
1,4,7,10,13,16-Hexaoxaciclooctadecano |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 1619616 | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA |
100.037.687 |
| Número CE | |
| 4535 | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 12 H 24 O 6 | |
| Masa molar | 264,315 g / mol |
| Densidad | 1,237 g / cm 3 |
| Punto de fusion | 37 a 40 ° C (99 a 104 ° F; 310 a 313 K) |
| Punto de ebullición | 116 ° C (241 ° F; 389 K) (0,2 Torr) |
| 75 g / L | |
| Peligros | |
| Pictogramas GHS |

|
| Palabra de señal GHS | Advertencia |
| H302 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301 + 312 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Compuestos relacionados | |
|
Compuestos relacionados
|
Dibenzo-18-corona-6 Triglyme Hexaaza-18-corona-6 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
18-Crown-6 es un compuesto orgánico con la fórmula [C 2 H 4 O] 6 y el nombre IUPAC de 1,4,7,10,13,16-hexaoxaciclooctadecano. Es un sólido cristalino higroscópico blanco con un punto de fusión bajo. Como otros éteres corona , 18-corona-6 funciona como ligando para algunos cationes metálicos con una afinidad particular por los cationes de potasio ( constante de unión en metanol : 10 6 M −1 ). El grupo de puntos de 18-corona-6 es S 6 . El momento dipolar de 18-corona-6 varía en diferentes solventes y bajo diferentes temperaturas. Por debajo de 25 ° C, el momento dipolar de 18-corona-6 es 2,76 ± 0,06 D en ciclohexano y 2,73 ± 0,02 en benceno. La síntesis de los éteres corona condujo a la concesión del Premio Nobel de Química a Charles J. Pedersen .
Síntesis
Este compuesto se prepara mediante una síntesis de éter de Williamson modificada en presencia de un catión de plantilla: También se puede preparar mediante la oligomerización de óxido de etileno :
- (CH 2 OCH 2 CH 2 Cl) 2 + (CH 2 OCH 2 CH 2 OH) 2 + 2 KOH → (CH 2 CH 2 O) 6 + 2 KCl + 2 H 2 O
Puede purificarse por destilación , donde se hace evidente su tendencia a sobreenfriarse. El 18-Crown-6 también se puede purificar mediante recristalización en acetonitrilo caliente . Inicialmente forma un solvato insoluble. Puede prepararse material rigurosamente seco disolviendo el compuesto en THF seguido de la adición de NaK para dar [K (18-corona-6)] Na, una sal alcalida .
El análisis cristalográfico revela una molécula relativamente plana pero en la que los centros de oxígeno no están orientados en la geometría simétrica idealizada de 6 veces que se muestra habitualmente. La molécula sufre un cambio conformacional significativo tras la complejación.
Reacciones
18-Crown-6 tiene una alta afinidad por el ion hidronio H 3 O + , ya que puede caber dentro del éter de la corona. Por lo tanto, la reacción de 18-corona-6 con ácidos fuertes produce el catión . Por ejemplo, la interacción de 18-corona-6 con gas HCl en tolueno con un poco de humedad da una capa de líquido iónico con la composición , de la cual se puede aislar el sólido en reposo. La reacción de la capa de líquido iónico con dos equivalentes molares de agua da el producto cristalino .
Aplicaciones
18-Crown-6 se une a una variedad de pequeños cationes, utilizando los seis oxígenos como átomos donantes. Los éteres corona se pueden utilizar en el laboratorio como catalizadores de transferencia de fase . Las sales que normalmente son insolubles en disolventes orgánicos se vuelven solubles mediante el éter corona. Por ejemplo, el permanganato de potasio se disuelve en benceno en presencia de 18-corona-6, dando el llamado "benceno púrpura", que puede usarse para oxidar diversos compuestos orgánicos.
Varias reacciones de sustitución también se aceleran en presencia de 18-corona-6, que suprime el apareamiento de iones. Los aniones se convierten así en nucleófilos desnudos . Por ejemplo, al usar 18-crown-6, el acetato de potasio es un nucleófilo más poderoso en solventes orgánicos:
- [K (18-corona-6) + ] OAc - + C 6 H 5 CH 2 Cl → C 6 H 5 CH 2 OAc + [K (18-corona-6) + ] Cl -
La primera sal electrida que se examinó con cristalografía de rayos X , [Cs (18-crown-6) 2 ] + · e - , se sintetizó en 1983. Este sólido altamente sensible al aire y a la humedad tiene una estructura molecular sándwich, donde el electrón está atrapado dentro de cavidades reticulares casi esféricas. Sin embargo, la distancia más corta electrón-electrón es demasiado larga (8,68 Å) para hacer de este material un conductor de electricidad.
Referencias
- ^ a b c d e f Steed, Jonathan W .; Atwood, Jerry L. (2009). Química Supramolecular (2ª ed.). Wiley. ISBN 978-0-470-51233-3.
- ^ Caswell, Lyman R .; Savannunt, Diana S. (enero de 1988). "Efectos de la temperatura y el disolvente en los momentos dipolares experimentales de tres éteres corona". J. Heterocyclic Chem . 25 (1): 73–79. doi : 10.1002 / jhet.5570250111 .
- ↑ a b Gokel, George W .; Cram, Donald J .; Liotta, Charles L .; Harris, Henry P .; Cook, Fred L. (1977). "18-Corona-6". Org. Synth . 57 : 30. doi : 10.15227 / orgsyn.057.0030 .
- ^ Jilek, Robert E .; Fischer, Paul J .; Ellis, John E. (2014). Bis (1,2-bis (dimetilfosfano) etano) tricarboniltitanio (0) y hexacarboniltitanato (2−) . Síntesis inorgánica. 36 . págs. 127-134. doi : 10.1002 / 9781118744994.ch24 . ISBN 9781118744994.
- ^ Dunitz, JD; Seiler, P. (1974). "1,4,7,10,13,16-Hexaoxaciclooctadecano". Acta Crystallogr . B30 (11): 2739. doi : 10.1107 / S0567740874007928 .
- ^ Atwood, Jerry L .; Bott, Simon G .; Coleman, Anthony W .; Robinson, Kerry D .; Whetstone, Stephen B .; Means, C. Mitchell (diciembre de 1987). "El catión oxonio en disolventes aromáticos. Síntesis, estructura y comportamiento en solución de ". Revista de la Sociedad Química Estadounidense . 109 (26): 8100–8101. doi : 10.1021 / ja00260a033 .
- ^ Atwood, Jerry L .; Bott, Simon G .; Means, C. Mitchell; Coleman, Anthony W .; Zhang, Hongming; May, Michael T. (febrero de 1990). "Síntesis de sales del anión dicloruro de hidrógeno en disolventes aromáticos. 2. Síntesis y estructuras cristalinas de y afines ". Química inorgánica . 29 (3): 467–470. doi : 10.1021 / ic00328a025 .
- ^ Liotta, CL; Berknerin, J. (2004). "18-Corona-6". En Paquette, L. (ed.). Enciclopedia de reactivos para síntesis orgánica, juego de 8 volúmenes . Enciclopedia de reactivos para síntesis orgánica . Nueva York: J. Wiley & Sons. doi : 10.1002 / 047084289X.rc261 . ISBN 0471936235.
- ^ Wynn, David; et al. (1984). "La solubilidad de fluoruros de metales alcalinos en disolventes no acuosos con y sin éteres corona ...". Talanta . 31 (11): 1036–1040. doi : 10.1016 / 0039-9140 (84) 80244-1 .
- ^ Cook, Fred L .; Bowers, Chauncey W .; Liotta, CL (noviembre de 1974). "Química de aniones desnudos. III. Reacciones del complejo 18-corona-6 de cianuro de potasio con sustratos orgánicos en disolventes orgánicos apróticos". La Revista de Química Orgánica . 39 (23): 3416–3418. doi : 10.1021 / jo00937a026 .

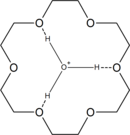
![{\ displaystyle {\ ce {[H3O.18-crown-6] +}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05959c612544dc9b3cb3553c23497b6cb0b79eae)
![{\ displaystyle {\ ce {[H3O.18-crown-6] + [HCl2] ^ {-}.}} 3.8 {\ ce {C6H5Me}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6c99a07eb7055bb324034bb06c5b326acac2040)
![{\ displaystyle {\ ce {[H3O.18-crown-6] + [HCl2] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a39f9fa425e04e4fb9893a6534ec9ebe14ec13d)
![{\ displaystyle {\ ce {(H5O2) [H3O.18-crown-6] Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea4d202cf03dca6460e22c323e76cdeaa4e4da33)

![{\ displaystyle {\ ce {[H3O + .18-crown-6] [Cl-H-Cl]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/570b60b09f20cda7d97987382a006e776dd9ed9e)
![{\ displaystyle {\ ce {[K.18-crown-6] [Cl-H-Cl]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/033a571d20719af08d7a5198f57da59afc23a226)
![{\ Displaystyle {\ ce {[Mg.18-crown-6] [Cl-H-Cl] 2}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abf6c19ea8d8195eea1d4679f2a696d69feb2f72)
![{\ displaystyle {\ ce {[H3O.18-crown-6] [Cl-H-Cl]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53c829dc937cd5208e3ccb616bdddf618c8b6332)
![{\ Displaystyle {\ ce {[H3O.18-crown-6] [Br-H-Br]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1dbd94a5bd7bbec553563db4f4df5d9496b9cf1)