Microscopía de excitación de dos fotones - Two-photon excitation microscopy
La microscopía de excitación de dos fotones ( TPEF o 2PEF ) es una técnica de obtención de imágenes de fluorescencia que permite obtener imágenes de tejido vivo de hasta aproximadamente un milímetro de espesor. A diferencia tradicional microscopía de fluorescencia , en el que la longitud de onda de excitación es más corto que la longitud de onda de emisión, excitación de dos fotones requiere excitación simultánea por dos fotones con longitud de onda más larga que la luz emitida. La microscopía de excitación de dos fotones normalmente utiliza luz de excitación de infrarrojo cercano (NIR) que también puede excitar tintes fluorescentes . Sin embargo, por cada excitación, se absorben dos fotones de luz NIR. El uso de luz infrarroja minimiza la dispersión en el tejido. Debido a la absorción multifotónica, la señal de fondo se suprime fuertemente. Ambos efectos conducen a una mayor profundidad de penetración para esta técnica. La excitación de dos fotones puede ser una alternativa superior a la microscopía confocal debido a su penetración tisular más profunda, detección de luz eficiente y fotoblanqueo reducido .

Concepto


La excitación de dos fotones emplea la absorción de dos fotones , un concepto descrito por primera vez por Maria Goeppert Mayer (1906-1972) en su tesis doctoral en 1931, y observado por primera vez en 1961 en un cristal de CaF 2 : Eu 2+ utilizando excitación láser por Wolfgang Kaiser . Isaac Abella demostró en 1962 en vapor de cesio que es posible la excitación de dos fotones de átomos individuales.
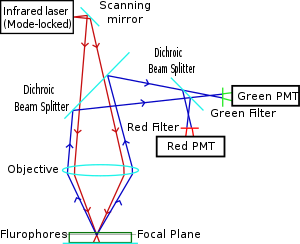
La microscopía de fluorescencia de excitación de dos fotones tiene similitudes con otras técnicas de microscopía láser confocal, como la microscopía confocal de barrido láser y la microscopía Raman . Estas técnicas utilizan rayos láser enfocados escaneados en un patrón de trama para generar imágenes, y ambos tienen un efecto de sección óptica . A diferencia de los microscopios confocales, los microscopios multifotónicos no contienen aberturas estenopeicas que dan a los microscopios confocales su calidad de sección óptica. La sección óptica producida por microscopios multifotónicos es el resultado de la función de dispersión puntual de la excitación: la función de dispersión puntual multifotónica suele tener forma de mancuerna (más larga en el plano xy), en comparación con la función de dispersión puntual en forma de pelota de rugby vertical de la función confocal. microscopios. El concepto de excitación de dos fotones se basa en la idea de que dos fotones, de energía fotónica comparativamente más baja que la necesaria para la excitación de un fotón, también pueden excitar un fluoróforo en un evento cuántico. Cada fotón transporta aproximadamente la mitad de la energía necesaria para excitar la molécula. La excitación da como resultado la posterior emisión de un fotón de fluorescencia con el mismo rendimiento cuántico que resultaría de la absorción convencional de un solo fotón. El fotón emitido suele tener una energía más alta (longitud de onda más corta) que cualquiera de los dos fotones excitantes. La probabilidad de la absorción casi simultánea de dos fotones es extremadamente baja. Por lo tanto, típicamente se requiere un flujo pico alto de fotones de excitación, generalmente generado por láser pulsado de femtosegundos . El propósito de emplear el efecto de dos fotones es que la dispersión axial de la función de dispersión de puntos es sustancialmente menor que para la excitación de un solo fotón. Como resultado, se mejora la extensión a lo largo de la dimensión z, lo que permite cortar secciones ópticas delgadas. Además, en muchos casos interesantes, la forma del lugar y su tamaño pueden diseñarse para lograr objetivos específicos deseados. Los láseres de excitación de longitud de onda más larga y energía más baja (normalmente infrarrojos) de los microscopios multifotónicos son adecuados para su uso en la obtención de imágenes de células vivas, ya que causan menos daño que los láseres de longitud de onda corta que se utilizan normalmente para la excitación de un solo fotón, por lo que las células se pueden observar para períodos más largos con menos efectos tóxicos.
Los fluoróforos más comúnmente utilizados tienen espectros de excitación en el rango de 400 a 500 nm, mientras que el láser utilizado para excitar la fluorescencia de dos fotones se encuentra en el rango de ~ 700 a 1000 nm (infrarrojo) producido por láseres de Ti-zafiro . Si el fluoróforo absorbe dos fotones infrarrojos simultáneamente, absorberá suficiente energía para elevarse al estado excitado. El fluoróforo emitirá entonces un solo fotón con una longitud de onda que depende del tipo de fluoróforo utilizado (típicamente en el espectro visible). Debido a que se absorben dos fotones durante la excitación del fluoróforo, la probabilidad de emisión fluorescente de los fluoróforos aumenta cuadráticamente con la intensidad de excitación. Por lo tanto, se genera mucha más fluorescencia de dos fotones donde el rayo láser está muy enfocado que donde es más difuso. Efectivamente, la excitación se restringe al pequeño volumen focal (~ 1 femtolitro), lo que resulta en un alto grado de rechazo de objetos fuera de foco. Esta localización de la excitación es la ventaja clave en comparación con los microscopios de excitación de fotón único , que necesitan emplear elementos como poros para rechazar la fluorescencia desenfocada. Luego, la fluorescencia de la muestra se recolecta mediante un detector de alta sensibilidad, como un tubo fotomultiplicador . Esta intensidad de luz observada se convierte en un píxel en la imagen final; el punto focal se escanea a lo largo de una región deseada de la muestra para formar todos los píxeles de la imagen.
Desarrollo
La microscopía de dos fotones fue pionera y patentada por Winfried Denk y James Strickler en el laboratorio de Watt W. Webb en la Universidad de Cornell en 1990. Combinaron la idea de la absorción de dos fotones con el uso de un escáner láser. En la microscopía de excitación de dos fotones, se enfoca un rayo láser infrarrojo a través de una lente de objetivo. El láser de Ti-zafiro que se utiliza normalmente tiene un ancho de pulso de aproximadamente 100 femtosegundos (fs) y una tasa de repetición de aproximadamente 80 MHz, lo que permite la alta densidad de fotones y el flujo necesarios para la absorción de dos fotones y se puede sintonizar en una amplia gama de longitudes de onda. También se han empleado láseres de fibra dopados con Yb de modo bloqueado con pulsos de 325 fs para la obtención de imágenes de colágeno, lo que demuestra una profundidad de penetración de más de 320 μm en colágeno, que es considerablemente superior a las profundidades de 250 a 300 μm que se pueden lograr cuando se acopla a un Ti- convencional. Láser de excitación de zafiro.
El uso de luz infrarroja para excitar los fluoróforos en los tejidos que dispersan la luz tiene beneficios adicionales. Las longitudes de onda más largas se dispersan en menor grado que las más cortas, lo que es un beneficio para las imágenes de alta resolución. Además, es menos probable que estos fotones de menor energía causen daños fuera del volumen focal. En comparación con un microscopio confocal, la detección de fotones es mucho más eficaz, ya que incluso los fotones dispersos contribuyen a la señal utilizable. Estos beneficios de la obtención de imágenes en tejidos dispersos solo se reconocieron varios años después de la invención de la microscopía de excitación de dos fotones.
Hay varias advertencias para el uso de la microscopía de dos fotones: los láseres pulsados necesarios para la excitación de dos fotones son mucho más costosos que los láseres de onda continua (CW) utilizados en la microscopía confocal. El espectro de absorción de dos fotones de una molécula puede variar significativamente de su contraparte de un fotón. Para objetos muy delgados, como células aisladas, los microscopios de fotón único (confocal) pueden producir imágenes con una resolución óptica más alta debido a sus longitudes de onda de excitación más cortas. En la dispersión de tejido, por otro lado, las capacidades superiores de detección de luz y corte óptico del microscopio de dos fotones dan como resultado un mejor rendimiento.
Aplicaciones
Principal
La microscopía de dos fotones se ha involucrado en numerosos campos que incluyen: fisiología, neurobiología, embriología e ingeniería de tejidos. Incluso los tejidos delgados y casi transparentes (como las células de la piel) se han visualizado con detalles claros gracias a esta técnica. Las capacidades de obtención de imágenes de alta velocidad de la microscopía de dos fotones también se pueden utilizar en biopsias ópticas no invasivas. En biología celular, la microscopía de dos fotones se ha utilizado adecuadamente para producir reacciones químicas localizadas. Utilizando microscopía basada en fluorescencia de dos fotones y segunda generación armónica , se demostró que las moléculas orgánicas del tipo de porfirina pueden tener diferentes momentos dipolares de transición para la fluorescencia de dos fotones y la segunda generación armónica, que de otro modo se cree que ocurren en el mismo dipolo de transición. momento. Se demostró que la excitación de dos fotones no degenerativa, o el uso de 2 fotones de longitudes de onda desiguales, aumenta la fluorescencia de todas las moléculas pequeñas y proteínas fluorescentes probadas.
Investigación sobre el cáncer
También se demostró que 2PEF es muy valioso para caracterizar el cáncer de piel. También se ha demostrado que revela la detención de las células tumorales, la interacción entre las plaquetas y las células tumorales, la interacción entre las células tumorales y los leucocitos y los procesos de colonización metastásica.
Neurociencias
2PEF y 3PEF se utilizan para caracterizar tejidos neurales intactos.
Imágenes del cerebro in vivo
La fluorescencia multifotónica (2PEF y 3PEF) es un medio útil para obtener imágenes del cerebro in vivo.
A través de las imágenes del cráneo (afeitado) de capilares y glóbulos rojos se publica en ratones, lo que sugiere una mayor profundidad y alta resolución desde más lejos que las aplicaciones de microscopía. Esto está en el artículo, "In vivo Imágenes de dos fotones revelan un espasmo vascular cerebral agudo y microtrombosis después de una lesión cerebral traumática leve en ratones"
Excitación de orden superior
También es posible la absorción simultánea de tres o más fotones, lo que permite una mayor microscopía de excitación multifotónica. La denominada "microscopía de fluorescencia excitada de tres fotones" (3PEF) es la técnica más utilizada después de la 2PEF, a la que es complementaria.
Colorantes y proteínas fluorescentes para microscopía de excitación de dos fotones
En general, todas las proteínas fluorescentes de uso común (CFP, GFP, YFP, RFP) y colorantes se pueden excitar en modo de dos fotones. Los espectros de excitación de dos fotones a menudo son considerablemente más amplios, lo que dificulta la excitación selectiva de los fluoróforos cambiando las longitudes de onda de excitación. Hay varias bases de datos en línea de espectros de dos fotones, disponibles en la Universidad de Cornell [1] y el Instituto Nacional de Física Química y Biofísica de Estonia.
Se han informado varios colorantes emisores de color verde, rojo y NIR (sondas y marcadores reactivos) con secciones transversales de absorción de 2 fotones extremadamente altas. Debido a la estructura de tipo donante-aceptor-donante, los tintes de escuaraína como Seta-670 , Seta-700 y Seta-660 exhiben eficiencias de absorción de 2 fotones (2PA) muy altas en comparación con otros tintes, SeTau-647 y SeTau-665 , un nuevo tipo de escuaraína- rotaxano , exhibe secciones transversales de acción de dos fotones extremadamente altas de hasta 10,000 GM en la región del IR cercano, insuperable por cualquier otra clase de colorantes orgánicos.
Ver también
- Almacenamiento de datos ópticos 3D
- Óptica no lineal
- Microscopía multifotónica de campo amplio
- Absorción de dos fotones
- Microscopía de tres fotones
- Microscopía de imagen de segundo armónico
Fuentes
- Schmitt, Michael; Mayerhöfer, Thomas; Popp, Jürgen; Kleppe, Ingo; Weisshart, Klaus (2013). "Interacción luz-materia". Manual de biofotónica . doi : 10.1002 / 9783527643981.bphot003 . ISBN 9783527643981.
- König, Karsten (2018). Microscopía multifotónica e imágenes de fluorescencia de por vida: aplicaciones en biología y medicina . De Gruyter. ISBN 978-3-11-042998-5.
- Keikhosravi, Adib; Bredfeldt, Jeremy S .; Sagar, Abdul Kader; Eliceiri, Kevin W. (2014). "Imágenes de cáncer de segunda generación armónica". Imágenes cuantitativas en biología celular . Métodos en biología celular. 123 . págs. 531–546. doi : 10.1016 / B978-0-12-420138-5.00028-8 . ISBN 9780124201385. PMID 24974046 .
- Hanry Yu; Nur Aida Abdul Rahim (2020). Imaging in Cellular and Tissue Engineering, 1ª edición . CRC Taylor y Francis. ISBN 9780367445867.
Referencias
enlaces externos
- Tintes adecuados para dos fotones
- introducción a la microscopía multifotónica
- Adquisición de múltiples imágenes en tiempo real para microscopía de barrido láser (artículo de microscopía de Sanderson)
- Construya su propio microscopio de 2 fotones con velocidad de video
- Microscopía de luz de fluorescencia de dos fotones, ENCICLOPEDIA DE CIENCIAS DE LA VIDA
- "Microscopía de fluorescencia multifotónica" . Primer de microscopía . Universidad Estatal de Florida . Consultado el 3 de marzo de 2018 .
- Microscopía de fluorescencia de excitación de fotones múltiples. Universidad de Wisconsin.
- Fundamentos y aplicaciones en microscopía de excitación multifotónica . Microscopía NikonU.