Óxido de estaño (II) - Tin(II) oxide
|
|

|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
Óxido de estaño (II)
|
|
| Otros nombres
Óxido de estaño, monóxido de estaño
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| Tarjeta de información ECHA |
100.040.439 |
| Número CE | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| SnO | |
| Masa molar | 134,709 g / mol |
| Apariencia | polvo negro o rojo cuando está anhidro, blanco cuando está hidratado |
| Densidad | 6,45 g / cm 3 |
| Punto de fusion | 1.080 ° C (1.980 ° F; 1.350 K) |
| insoluble | |
| −19,0 · 10 −6 cm 3 / mol | |
| Estructura | |
| tetragonal | |
| Termoquímica | |
|
Entropía molar estándar ( S |
56 J · mol −1 · K −1 |
| −285 kJ · mol −1 | |
| Riesgos | |
| Ficha de datos de seguridad | ICSC 0956 |
| punto de inflamabilidad | No es inflamable |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
|
PEL (permitido)
|
ninguno |
|
REL (recomendado)
|
TWA 2 mg / m 3 |
|
IDLH (peligro inmediato)
|
DAKOTA DEL NORTE |
| Compuestos relacionados | |
|
Otros aniones
|
Sulfuro de estaño Seleniuro de estaño Telururo de estaño |
|
Otros cationes
|
Monóxido de carbono Monóxido de silicio Óxido de germanio (II) Óxido de plomo (II) |
| Dióxido de estaño | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El óxido de estaño (II) ( óxido estannoso ) es un compuesto con la fórmula SnO. Está compuesto de estaño y oxígeno donde el estaño tiene un estado de oxidación de +2. Hay dos formas, una forma azul-negra estable y una forma roja metaestable .
Preparación y reacciones
El SnO azul-negro se puede producir calentando el hidrato de óxido de estaño (II), SnO · xH 2 O (x <1) precipitado cuando una sal de estaño (II) se hace reaccionar con un hidróxido alcalino tal como NaOH.
El SnO rojo metaestable se puede preparar calentando suavemente el precipitado producido por la acción del amoníaco acuoso sobre una sal de estaño (II).
El SnO puede prepararse como una sustancia pura en el laboratorio, mediante calentamiento controlado de oxalato de estaño (II) ( oxalato estannoso ) en ausencia de aire o bajo una atmósfera de CO 2 . Este método también se aplica a la producción de óxido ferroso y óxido manganoso .
- SnC 2 O 4 · 2H 2 O → SnO + CO 2 + CO + 2 H 2 O
El óxido de estaño (II) arde en el aire con una tenue llama verde para formar SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
Cuando se calienta en una atmósfera inerte, inicialmente se produce la desproporción dando Sn metal y Sn 3 O 4 que reacciona más para dar SnO 2 y Sn metal.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
El SnO es anfótero , se disuelve en un ácido fuerte para dar sales de estaño (II) y en una base fuerte para dar estanitos que contienen Sn (OH) 3 - . Se puede disolver en soluciones ácidas fuertes para dar los complejos iónicos Sn (OH 2 ) 3 2+ y Sn (OH) (OH 2 ) 2 + , y en soluciones menos ácidas para dar Sn 3 (OH) 4 2+ . Nótese que también se conocen los estannitos anhidros, por ejemplo, K 2 Sn 2 O 3 , K 2 SnO 2 . El SnO es un agente reductor y se cree que reduce el cobre (I) a racimos metálicos en la fabricación del llamado "vidrio rubí de cobre".
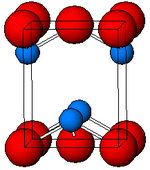
Estructura
Negro, α-SnO adopta la estructura de la capa tetragonal de PbO que contiene cuatro átomos de estaño piramidales cuadrados coordinados. Esta forma se encuentra en la naturaleza como el raro mineral romarchite . La asimetría se suele atribuir simplemente a un par solitario estéricamente activo; sin embargo, los cálculos de densidad de electrones muestran que la asimetría es causada por una interacción antienlazante de los orbitales Sn (5s) y O (2p). La estructura electrónica y la química del par solitario determinan la mayoría de las propiedades del material.
Se ha observado no estequiometría en SnO.
La banda prohibida electrónica se ha medido entre 2,5 eV y 3eV.
Usos
El uso dominante del óxido estannoso es como precursor en la fabricación de otros compuestos o sales de estaño, típicamente divalentes. El óxido estannoso también se puede emplear como agente reductor y en la creación de vidrio rubí . Tiene un uso menor como catalizador de esterificación .
El óxido de cerio (III) en forma de cerámica , junto con el óxido de estaño (II) (SnO) se utiliza para la iluminación con luz ultravioleta.

