Tavaborole - Tavaborole
 | |
 | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Kerydin |
| Otros nombres | AN2690 |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a614049 |
| Vías de administración |
Actual |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.218.130 |
| Datos químicos y físicos | |
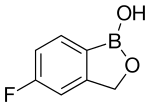
| Fórmula | C 7 H 6 B F O 2 |
| Masa molar | 151,93 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
Tavaborole , vendido bajo la marca Kerydin , es un medicamento antimicótico tópico para el tratamiento de la onicomicosis , una infección por hongos de la uña y el lecho ungueal . El tavaborol fue aprobado por la FDA de EE. UU. En julio de 2014. El medicamento inhibe una enzima fúngica esencial , la leucil-tRNA sintetasa , necesaria para la síntesis de proteínas . La inhibición de la síntesis de proteínas conduce a la interrupción del crecimiento celular y luego a la muerte celular , eliminando la infección por hongos.
Usos médicos
El tavaborol se utiliza en el tratamiento de la onicomicosis . En los ensayos clínicos, el tavaborol fue más eficaz que el vehículo (acetato de etilo y propilenglicol) solo para curar la onicomicosis. En dos estudios, la infección por hongos se eliminó usando tavaborol en el 6,5% de los casos frente al 0,5% usando el vehículo solo, y el 27,5% frente al 14,6% usando el vehículo solo.
Efectos secundarios
La exfoliación en el lugar de aplicación, el eritema (sarpullido) y la irritación son posibles efectos secundarios y pueden ocurrir en menos del 5% de las personas.
Farmacología
El tavaborol actúa como inhibidor de la leucil-tRNA sintetasa fúngica .
Farmacocinética
El tavaborol, cuando se prepara con una mezcla 1: 1 de acetato de etilo y propilenglicol, tiene la capacidad de penetrar completamente a través de la uña humana. En estudios con uñas de cadáveres, una solución al 5% de tavaborol penetró en la uña un promedio de 524,7 mcg / cm 2 después de dos semanas de uso diario.
El tavaborol es detectable en la sangre a un nivel de 3,54 ng / ml después de un solo uso de 0,2 ml de la solución al 5%. El tavaborol tiene una vida media de eliminación de 28,5 horas, una concentración máxima de 5,17 ng / ml después de dos semanas de uso diario y tarda 8 días en alcanzar la concentración máxima.
sociedad y Cultura
Ciencias económicas
Tavaborole comenzó los ensayos clínicos de fase III en diciembre de 2010 y fue aprobado por la FDA de EE. UU. En julio de 2014.
Originalmente desarrollado por Anacor , ahora se comercializa en los Estados Unidos por la subsidiaria de Novartis , Sandoz . Anacor recibió 65 millones de dólares y también entró en un plan de participación en las utilidades para futuras ventas. Una botella de 10 ml de una solución al 5% de tavaborol le costará al paciente sin seguro alrededor de $ 1356.
Ver también
Crisaborol : un medicamento tópico relacionado estructuralmente que se usa para el tratamiento de la dermatitis atópica leve a moderada (eccema).
Referencias
enlaces externos
- "Tavaborole" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
