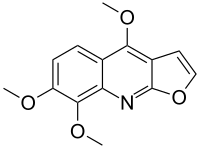
Skimmianine - Skimmianine
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
4,7,8-trimetoxifuro [2,3- b ] quinolina |
|
| Otros nombres
Skimmianin; β-fagarina; Cloroxilonina
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
| Propiedades | |
| C 14 H 13 N O 4 | |
| Masa molar | 259,261 g · mol −1 |
| Punto de fusion | 177 ° C (351 ° F; 450 K) |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
Skimmianine es un alcaloide de furoquinolina que se encuentra en Skimmia japonica , una planta con flores de la familia Rutaceae que es originaria de Japón y China. También es un inhibidor potente de la acetilcolinesterasa (AChE).
Biosíntesis
La biosíntesis de skimmianine comienza a partir del ácido antranílico , que es muy abundante en la familia Rutaceae. Combinando acetato de ácido antranílico, se forma antraniloil-CoA como unidad de partida y es capaz de extender la cadena lateral añadiendo malonil-CoA por condensación de Claisen . A continuación, la lactama se forma a través de la ciclación y genera un sistema heterocíclico, lo que lleva al tautómero dienol a adoptar el tautómero 4-hidroxi-quinolona, que es 4-hidroxi-2-quinolona.
Con la formación de quinolona, se produce la alquilación en la posición C-3 mediante la introducción de difosfato de dimetilalilo. Otro paso clave es la ciclación en la cadena lateral de dimetilalilo, formando un nuevo anillo heterocíclico de cinco miembros. La platydesmina entonces forma un intermedio a través de la reacción de escisión oxidativa al perder un grupo isopropilo para formar dictamina. Finalmente, la skimmianina se forma mediante la hidroxilación de dictamina.
Referencias
- ^ "Panel de química" . comptox.epa.gov . Consultado el 10 de junio de 2019 .
- ^ Yang, Zhong-duo; Zhang, Dong-bo; Ren, Jin; Yang, Ming-jun (2012). "Skimmianine, un alcaloide de furoquinolina de Zanthoxylum nitidum como un inhibidor potencial de la acetilcolinesterasa". Investigación en Química Medicinal . 21 (6): 722–725. doi : 10.1007 / s00044-011-9581-9 .
- ^ "Compuestos derivados del ácido antranílico". Alcaloides . 2015. págs. 163–180. doi : 10.1016 / B978-0-12-417302-6.00009-X . ISBN 9780124173026.
- ^ Manske, RH (1960). Los alcaloides: química y fisiología . Nueva York: Academic Press.
- ^ Guengerich, F. Peter; Yoshimoto, Francis K. (2018). "Formación y escisión de enlaces C-C por reacciones enzimáticas de oxidación-reducción" . Revisiones químicas . 118 (14): 6573–6655. doi : 10.1021 / acs.chemrev.8b00031 . PMC 6339258 .

