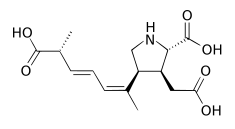
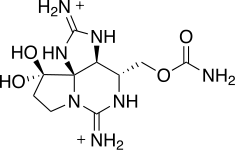
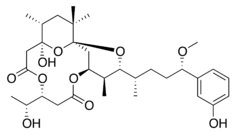
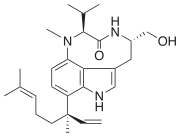
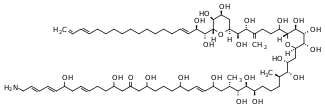
Ficotoxina - Phycotoxin
Las ficotoxinas (del griego, phykos , "algas" y toxikon , "toxina") son sustancias químicas alelopáticas complejas producidas por las vías metabólicas secundarias de las algas eucariotas y procariotas . Más simplemente, estos son productos químicos tóxicos sintetizados por organismos fotosintéticos . Estos metabolitos no son (en la mayoría de los casos) dañinos para el productor, pero pueden ser tóxicos para uno o varios miembros de la red alimentaria marina . Esta página se centra en las ficotoxinas producidas por microalgas marinas ; sin embargo, las algas de agua dulce y las macroalgas son productoras de ficotoxinas conocidas y pueden exhibir una dinámica ecológica análoga. En la cadena alimentaria marina pelágica, el fitoplancton son sometidos a pastoreo de macro y micro zooplancton , así como la competencia por los nutrientes con otras especies de fitoplancton. Las bacterias marinas intentan obtener una parte del carbono orgánico manteniendo interacciones simbióticas , parasitarias , comensales o depredadoras con el fitoplancton. Otras bacterias degradarán el fitoplancton muerto o consumirán el carbono orgánico liberado por la lisis viral . La producción de toxinas es una estrategia que utiliza el fitoplancton para hacer frente a esta amplia gama de depredadores, competidores y parásitos. Smetacek sugirió que "la evolución del plancton se rige por la protección y no por la competencia . Las muchas formas del plancton reflejan respuestas de defensa a sistemas de ataque específicos". De hecho, el fitoplancton retiene una gran cantidad de mecanismos de defensa mecánicos y químicos, incluidas las paredes celulares , las espinas, la formación de cadenas / colonias y la producción de sustancias químicas tóxicas. Estas características morfológicas y fisiológicas se han citado como evidencia de una fuerte presión depredadora en el medio marino. Sin embargo, la importancia de la competencia también se demuestra por la producción de ficotoxinas que impactan negativamente a otras especies de fitoplancton. Los flagelados (especialmente los dinoflagelados ) son los principales productores de ficotoxinas; Sin embargo, se conocen toxigénicas diatomeas , cianobacterias , primnesiofíceas y raphidophyceae . Debido a que muchos de estos aleloquímicos son grandes y energéticamente costosos de producir, se sintetizan en pequeñas cantidades. Sin embargo, se sabe que las ficotoxinas se acumulan en otros organismos y pueden alcanzar altas concentraciones durante la proliferación de algas . Además, como metabolitos biológicamente activos , las ficotoxinas pueden producir efectos ecológicos a bajas concentraciones. Estos efectos pueden ser sutiles, pero tienen el potencial de afectar las distribuciones biogeográficas del fitoplancton y la dinámica de floración.
Efectos ecológicos potenciales
Efectos anti-pastoreo
Las ficotoxinas pueden prevenir el pastoreo por varios mecanismos: muerte del pastoreo , infertilidad o disuasión. Alguna evidencia de efectos anti-pastoreo:
- Teegarden descubrió que tres especies diferentes de copépodos podían distinguir entre una Alexandrium sp. Productora de saxitoxina . y Alexandrium sp. no toxigénico morfológicamente similar. por medios quimiosensoriales . Estas tres especies de copépodos diferentes pastaron predominantemente en Alexandrium spp. y evitó el productor de saxitoxina. Sin embargo, el efecto de la disuasión de la saxitoxina varió según la especie de copépodo. Esto implica que Alexandrium sp. tienen una ventaja sobre los dinoflagelados no toxigénicos.
- Miralto y col. reportaron un bajo éxito de eclosión de huevos puestos por copépodos que se alimentaron de diatomeas que contienen aldehídos poliinsaturados . Cuando son ingeridos por copépodos, estos aldehídos parecen detener el desarrollo embrionario. Esto tiene el potencial de disminuir la población futura de copépodos y promover la supervivencia de copépodos que no comen tantas diatomeas.
Efectos antimicrobianos
La producción de ficotoxinas puede ser útil para protegerse de las bacterias heterótrofas algicidas o parásitas . Alguna evidencia de efectos antimicrobianos:
- Bates y col. fue capaz de mejorar la producción de ácido domoico en Pseudo-nitzschia multseries con la reintroducción de bacterias. Además, los cultivos de P. multiseries que eran completamente axénicos (libres de bacterias) producen menos ácido domoico que los cultivos de P. multiseries que han contenido bacterias durante varias generaciones.
- Sieburth descubrió que el ácido acrílico inhibe la microflora intestinal en los pingüinos. Los pingüinos ingirieron altas concentraciones de ácido acrílico a través de su dieta eufásida , que se había estado alimentando de Phaeocystis. El efecto antimicrobiano del ácido acrílico fue verificado por Slezak et al. quienes concluyeron que el ácido acrílico inhibirá la producción de bacterias en situaciones en las que el fitoplancton forma agregados (es decir, nieve marina o floraciones de Phaeocystis). Sin embargo, la producción de ácido acrílico también puede servir para mantener a las bacterias alejadas del fitoplancton en concentraciones más diluidas.
Efectos competitivos
Dado que muchas especies diferentes de fitoplancton compiten por una cantidad limitada de nutrientes (ver Paradoja del plancton ), es posible que la producción de ficotoxinas se use como un método para matar a los competidores o para mantener otros fitoplancton fuera del espacio de nutrientes del productor. Alguna evidencia de efectos competitivos:
- Graneli mostró que Prymnesium spp. producirá ficotoxinas que matan a los competidores bajo la limitación de nitrógeno o fósforo.
- Fistarol y col. encontró que Alexandrium spp. producen toxinas que disminuyen la tasa de crecimiento de otro fitoplancton y cambian la composición de la comunidad .
- Prince y col. demostraron que los exudados químicos del dinoflagelado Karenia brevis disminuían la tasa de crecimiento y, en ocasiones, mataban a las especies competidoras al disminuir su eficiencia fotosintética y aumentar la permeabilidad de la membrana .
Lista de ficotoxinas conocidas y mecanismos de acción
La mayoría de las ficotoxinas caracterizadas tienen algún impacto económico o de salud en los seres humanos. Otras ficotoxinas bien estudiadas son productos farmacéuticos potenciales o existentes o tienen algún uso en la investigación celular. Por lo tanto, nuestro nivel de conocimiento sobre las toxinas individuales no refleja necesariamente su relevancia ecológica. Además, el modo de acción y el nivel de toxicidad son efectos que se han documentado en macroorganismos (típicamente ratones). Estos modos de acción pueden ser diferentes en el medio marino pelágico. Sin embargo, es poco probable que la síntesis de sustancias químicas complejas y energéticamente caras se conserve a lo largo del tiempo evolutivo si no confieren alguna ventaja al productor. Incluso si aún no conocemos el efecto de muchas toxinas en su entorno natural, su mera presencia e impresionante diversidad indica que cumplen algún propósito ecológico.
Las especies de fitoplancton que se enumeran a continuación no abarcan toda la gama de especies toxigénicas conocidas. Existe evidencia experimental de especies de fitoplancton que tienen efectos inhibidores sobre los herbívoros u otras especies de fitoplancton, pero sus toxinas no han sido identificadas.
Tabla generada con información de Cembella , Shimizu
Tipos de toxinas
Toxinas excretadas
Las toxinas excretadas pueden ayudar a disuadir a los depredadores y las bacterias que son atraídas por los productos de desecho del fitoplancton. Se sabe que el fitoplancton excreta metabolitos de desecho en el medio ambiente circundante. Esta es una fuente potencial de nutrientes y carbono reducidos para las bacterias y puede actuar como una señal para los depredadores que pueden detectar y seguir los gradientes de kairomonas en su entorno. Las toxinas excretadas parecerían más ventajosas para la célula individual en su capacidad para mantener a distancia a los depredadores y / o bacterias parasitarias y algicidas . Sin embargo, la producción y excreción continua de toxinas conlleva un costo metabólico. Para que las toxinas excretadas sean eficaces, deben tener un peso molecular bajo para difundirse rápidamente en el medio marino y ser energéticamente baratas de producir. Sin embargo, es posible que las toxinas excretadas no repelan a los depredadores móviles más grandes porque la difusividad molecular es lenta y la turbulencia a escala milimétrica es grande en el agua. Las ficotoxinas excretadas pueden actuar como repelentes si su señal se registra a la misma velocidad que otras señales que los potenciales herbívoros pueden detectar (kairomonas), asumiendo que ambos son encontrados por un depredador al mismo tiempo. Además, las toxinas excretadas pueden ser un método eficaz para mantener a las bacterias dañinas y otros competidores del fitoplancton fuera de la microzona de nutrientes del productor de ficotoxinas.
Toxinas de contacto
Las toxinas de contacto son efectivas si impactan al herbívoro o bacteria dañina inmediatamente después del contacto con el productor de fitoplancton. Estas toxinas están ubicadas en la superficie celular y típicamente se clasifican como glicoproteínas , glicolípidos o polipéptidos . Estas toxinas tendrían que ser muy específicas para sus receptores diana para ser efectivas.
Toxinas posteriores a la ingestión
Para que estos tipos de toxinas surtan efecto, los productores de toxinas posteriores a la ingestión deben ser consumidos por un herbívoro. Las toxinas posteriores a la ingestión, también conocidas como toxinas suicidas, no son beneficiosas para las células individuales porque, a diferencia de las plantas terrestres, el fitoplancton no tiene tejido de sacrificio. Sin embargo, si las toxinas internas resultan en la muerte, disminuyen la tasa de crecimiento, la infertilidad o la disuasión de un depredador, los representantes restantes de la comunidad del plancton pueden beneficiarse. La defensa comunitaria es más beneficiosa en una población clonal donde las especies toxigénicas son abundantes, por ejemplo, durante una floración de fitoplancton monoespecífica.
Mecanismos de señales de defensa química
Cuadro modificado de Wolfe (2000)
| Toxinas excretadas | Toxinas de contacto | Toxinas posteriores a la ingestión | |
|---|---|---|---|
| Moléculas | Moléculas pequeñas pero estructuras variadas; orgánicos y aminoácidos , azúcares, lípidos de cadena corta y derivados | Glicoproteínas , glicolípidos , polipéptidos | Variados: tóxicos o toxinas |
| Propiedades de las toxinas | Solubilidad acuosa , difusividad , labilidad , toxicidad | Especificidad, toxicidad | Toxicidad o concentración |
| Ubicación de la toxina | Ambiente acuoso | Superficie celular | Interior de la celda |
| Efecto o modo de acción | Kinesis / taxis negativos : repelente | Liberar siguiente captura: disuasivo | La inhibición posterior de la alimentación o la toxicidad redujo la digestibilidad o la eficiencia del crecimiento. |
| Nivel de beneficio | Individuo o población, incluidos competidores | Individual | Población genéticamente similar |
Métodos de detección
Es técnicamente difícil identificar y caracterizar un metabolito que se produce en concentraciones bajas y se secreta en un líquido que contiene una diversidad de otros metabolitos. La alelopatía es muy difícil de observar en el campo (con la excepción de las floraciones de algas nocivas ) porque la producción de ficotoxinas puede ser inducida por una variedad de factores ambientales y puede crear una cascada de eventos bióticos y físicos, que son difíciles de separar de los efectos alelopáticos directos. de una especie sobre otra. Hay seis puntos (de lógica similar a los postulados de Koch ) que deben establecerse para demostrar rigurosamente que una especie inhibe químicamente a otra en un sistema ecológico.
- Debe mostrarse un patrón de inhibición de una especie [...] por otra.
- el agresor putativo [especie] debe producir una toxina
- debe haber un modo de liberación de toxinas de la [especie] al medio ambiente
- debe haber un modo de transporte y / o acumulación de toxinas en el medio ambiente
- la [especie] afectada debe tener algún medio de absorción de toxinas
- El patrón de inhibición observado no puede explicarse únicamente por factores físicos u otros factores bióticos, especialmente la competencia y la herbivoría:
- Las concentraciones que impactan a las especies de destino deben ser ambientalmente realistas dadas las tasas de transporte y difusión en el medio acuático.
Pocos (si los hay) estudios sobre las toxinas del fitoplancton han intentado cumplir rigurosamente con todos estos criterios. Todos los métodos de detección de ficotoxinas implican la extracción de la toxina candidata de un cultivo de fitoplancton; por lo tanto, es importante determinar si la toxina se secreta en el medio o se almacena en la célula del fitoplancton. También es importante saber si el organismo objetivo debe estar presente para inducir la síntesis de toxinas.
Más comúnmente, la presencia de una ficotoxina se verifica mediante fraccionamiento guiado por bioensayo . La muestra debe fraccionarse o separarse de los otros metabolitos y productos químicos en el medio mediante cromatografía . Estas diferentes fracciones se pueden probar luego en la especie objetivo para determinar qué muestra causa los síntomas alelopáticos esperados. Este enfoque es útil para aislar rápidamente un aleloquímico cuya estructura se desconoce. Sin embargo, los bioensayos tienen el potencial de generar falsos positivos . Esto puede ocurrir si el bioensayo no se controla adecuadamente. Por ejemplo, en un cultivo de lotes mixtos, la especie objetivo puede morir o tener tasas de crecimiento reducidas debido a la competencia por nutrientes, carbono inorgánico disuelto o niveles de pH que son demasiado bajos para la especie objetivo.
Los avances en genómica , transcriptómica , proteómica y metabolómica están produciendo ahora grandes volúmenes de datos bioquímicos. El " perfil metabólico " permite la comparación entre muestras biológicamente activas e inactivas y la identificación de compuestos presentes en concentraciones bajas mediante espectrometría de masas . Luego, estas muestras pueden compararse mediante análisis de componentes principales . La caracterización de los compuestos presentes en la muestra activa (pero no en la muestra inactiva) puede identificarse y caracterizarse usando métodos estándar en espectroscopía de masas. El marcaje de isótopos también se puede utilizar para identificar las vías utilizadas en la biosíntesis de ficotoxinas .
Ver también
- Alelopatía
- Adaptación antipredator
- Defensas químicas
- Ecología química
- Matanza de peces
- GEOHAB
- Floraciones de algas nocivas
- Fitotoxina
- Plancton
- Defensa de las plantas contra la herbivoría.
Referencias
- ^ Smetacek, V (2001). "Una carrera armamentística acuática" . Naturaleza . 411 (6839): 745. Bibcode : 2001Natur.411..745S . doi : 10.1038 / 35081210 . PMID 11459035 .
- ^ Verity, PG; V Smetacek (1996). "Ciclos de vida de los organismos, depredación y estructura de los ecosistemas pelicos marinos" . Serie del progreso de la ecología marina . 130 : 277-293. Código Bibliográfico : 1996MEPS..130..277V . doi : 10.3354 / meps130277 .
- ↑ a b c Cembella, AD (2003). "Ecología química de microalgas eucariotas en ecosistemas marinos". Phycologia . 42 (4): 420–447. doi : 10.2216 / i0031-8884-42-4-420.1 .
- ^ Teegarden, GJ (1999). "Selección de pastoreo de copépodos y discriminación de partículas sobre la base del contenido de toxina PSP" . Serie del progreso de la ecología marina . 181 : 163-176. Código Bibliográfico : 1999MEPS..181..163T . doi : 10.3354 / meps181163 .
- ^ Miralto, A; et al. (1999). "El efecto insidioso de las diatomeas sobre la reproducción de copépodos". Naturaleza . 402 (6758): 173-176. Código Bibliográfico : 1999Natur.402..173M . doi : 10.1038 / 46023 .
- ^ Bates, SS; DJ Douglas; GJ Doucette; C Leger (1995). "Mejora de la producción de ácido domoico mediante la reintroducción de bacterias a cultivos axénicos de la diatomea Pseudo-nitzschia multiseries". Toxinas naturales . 3 (6): 428–435. doi : 10.1002 / nt.2620030605 . PMID 8612005 .
- ^ Sieburth, JM (1960). "El ácido acrílico, un principio" antibiótico "en Phaeocystis florece en aguas antárticas" . Ciencia . 132 (3428): 676–677. Código Bibliográfico : 1960Sci ... 132..676M . doi : 10.1126 / science.132.3428.676 . PMID 14446452 .
- ^ Slezak, DM; S Puskaric; GJ Herndl (1994). "Papel potencial del ácido acrílico en las comunidades de bacterioplancton en el mar" (PDF) . Serie del progreso de la ecología marina . 105 : 191-197. Código Bibliográfico : 1994MEPS..105..191S . doi : 10.3354 / meps105191 .
- ^ Graneli, E (2006). "Mata a tus enemigos y cómelos con la ayuda de tus toxinas: una estrategia de algas". Revista Africana de Ciencias Marinas . 28 (2): 331–336. doi : 10.2989 / 18142320609504172 .
- ^ Fistarol, GA; C Legrand; E Selander; C Hummert; W Stolte; E Graneli (2004). "Alelopatía en Alexandrium spp .: efecto sobre una comunidad de plancton natural y sobre monocultivos de algas" . Ecología microbiana acuática . 35 : 45–56. doi : 10.3354 / ame035045 .
- ^ Príncipe, EK; TL Myers; J Kubanek (2008). "Efectos de las floraciones de algas nocivas sobre los competidores: mecanismos alelopáticos del dinoflagelado de marea roja Karenia brevis" . Limnología y Oceanografía . 53 (2): 531–541. Código Bibliográfico : 2008LimOc..53..531P . doi : 10.4319 / lo.2008.53.2.0531 .
- ^ Shimizu, Y (1996). "Metabolitos microbianos: una nueva perspectiva". Revisión anual de microbiología . 50 : 431–465. doi : 10.1146 / annurev.micro.50.1.431 . PMID 8905087 .
- ^ Peng, Jiangnan; Place, Allen R .; Yoshida, Wesley; Anklin, Clemens; Hamann, Mark T. (17 de marzo de 2010). "Estructura y configuración absoluta de la Karlotoxina-2, una Ictiotoxina del Dinoflagelado Karlodinium veneficum marino" . Revista de la Sociedad Química Estadounidense . Sociedad Química Estadounidense (ACS). 132 (10): 3277–3279. doi : 10.1021 / ja9091853 . ISSN 0002-7863 . PMC 2836391 .
- ↑ Rasmussen, Silas Anselm; Binzer, Sofie Bjørnholt; Hoeck, Casper; Meier, Sebastian; de Medeiros, Livia Soman; Andersen, Nikolaj Gedsted; Place, Allen; Nielsen, Kristian Fog; Hansen, Per Juel; Larsen, Thomas Ostenfeld (5 de abril de 2017). "Karmitoxina: una toxina polihidroxi-polieno que contiene amina del armiger de dinoflagelado marino Karlodinium" . Revista de productos naturales . Sociedad Química Estadounidense (ACS). 80 (5): 1287-1293. doi : 10.1021 / acs.jnatprod.6b00860 . ISSN 0163-3864 . PMC 6446557 .
- ↑ a b c Wolfe, GV (2000). "La ecología de defensa química del plancton unicelular marino: limitaciones, mecanismos e impactos". El Boletín Biológico . 198 (2): 225–244. CiteSeerX 10.1.1.317.7878 . doi : 10.2307 / 1542526 . JSTOR 1542526 . PMID 10786943 .
- ^ a b Pohnert, G; M Steinke; R Tollrian (2007). "Señales químicas, metabolitos de defensa y la formación de interacciones interespecíficas pelágicas". Tendencias en Ecología y Evolución . 22 (4): 198-204. doi : 10.1016 / j.tree.2007.01.005 . PMID 17275948 .
- ^ Willis, RJ (1985). "Las bases históricas del concepto de alelopatía". Revista de Historia de la Biología . 18 (1): 71–102. doi : 10.1007 / BF00127958 .
Otras lecturas
- Ianora, A y col. "The HT Odum Synethesis Essay Nuevas tendencias en ecología química marina". Estuarios y costas 29 (2006): 531–551.
- Ianora, A y col. "La relevancia de la ecología química marina para el plancton y la función del ecosistema: un campo emergente". Marine Drugs 9 (2011): 1625–1648.
- Taylor, P y JH Landsberg. "Los efectos de la proliferación de algas nocivas en los organismos acuáticos". Reseñas en Fisheries Science 10 (2010): 113–390.
- Weissburg, MJ. "El contexto dinámico fluido del comportamiento quimiosensorial". The Biological Bulletin 198 (2000): 188–202.
- Legrand, C, K Rengefors, GO Fistarol y E Graneli. "Alelopatía en el fitoplancton - aspectos bioquímicos, ecológicos y evolutivos". Phycologia 42 (2003): 406–419.
enlaces externos
- ROSEMEB: El papel de los metabolitos secundarios en impulsar la funcionalidad del ecosistema y mantener la diversidad
- La Revista de Ecología Química
- Red de monitoreo de fitoplancton de NOAA (PMN)
- Algas nocivas: Instituto Oceanográfico Woods Hole
- Floraciones de algas tóxicas y nocivas: lo que no puedes ver puede hacerte daño