Vacuna pentavalente - Pentavalent vaccine
| Combinación de | |
|---|---|
| Vacuna DTP | Vacuna |
| Vacuna contra la hepatitis B | Vacuna |
| Vacuna contra Haemophilus | Vacuna |
| Datos clinicos | |
| Nombres comerciales | Quintavax, Pentavac, Pentacel, otros |
| Vías de administración |
Inyección intramuscular |
| Código ATC | |
| Identificadores | |
| Número CAS | |
Una vacuna pentavalente , también conocida como vacuna 5 en 1 , es una vacuna combinada con cinco vacunas individuales conjugadas en una.
La vacuna pentavalente se refiere con frecuencia a la vacuna 5 en 1 que protege contra la difteria , el tétanos , la tos ferina , la hepatitis B y Haemophilus influenzae tipo B , que generalmente se usa en países de ingresos medios y bajos , donde la vacuna contra la polio se administra por separado.
Otra vacuna pentavalente es la vacuna 5 en 1 que protege contra la difteria, el tétanos, la tos ferina, la poliomielitis y la influenza Haemophilus tipo B , que se usó en el Reino Unido hasta 2017, después de lo cual estuvo disponible una vacuna 6 en 1 que contenía la protección adicional contra la hepatitis B.
En 2013, las vacunas pentavalentes representaron el 100% de las vacunas que contienen DTP adquiridas por UNICEF , que suministra vacunas a una gran proporción de los niños del mundo.
La seguridad
Durante estudios y pruebas, se descubrió que la vacuna líquida conjugada DTPw - HepB - Hib tiene seguridad positiva cuando se administra como refuerzo a niños pequeños que han recibido un ciclo de vacunación con otro refuerzo pentavalente que requiere un cambio en la constitución y también se encontró que ser adecuadamente inmunogénico .
Historia
En octubre de 2004, la Agencia Europea de Medicamentos concedió la autorización de comercialización dentro de la UE a la vacuna pentavalente Quintanrix, fabricada por GlaxoSmithKline . Quintanrix fue retirado voluntariamente por el fabricante en 2008.
En septiembre de 2006, la primera formulación de vacuna pentavalente recibió la aprobación de precalificación de la Organización Mundial de la Salud .
En 2012, UNICEF y la Organización Mundial de la Salud emitieron y recomendaron una declaración conjunta a la División de Inmunización, el Ministerio de Salud y Bienestar Familiar, el Gobierno de la India y otras naciones en desarrollo en documentos separados sobre el uso de vacunas pentavalentes para protegerse contra cinco de los principales causas de muerte infantil prevenible mediante vacunación.
En 2013, las vacunas pentavalentes representaron el 100% de las vacunas que contienen DTP adquiridas por UNICEF, que suministra vacunas a una gran proporción de los niños del mundo.
En 2014, Sudán del Sur se convirtió en el último de los 73 países respaldados por GAVI en introducir la vacuna cinco en uno.
sociedad y Cultura
En mayo de 2010, Crucell NV anunció un premio de 110 millones de dólares de UNICEF para suministrar su vacuna pediátrica pentavalente Quinvaxem al mundo en desarrollo.
En noviembre de 2010, el consorcio público-privado GAVI anunció que el costo de la vacuna pentavalente para los países de mercados emergentes había caído por debajo de $ 3.00 USD por dosis.
Los países de ingresos altos tienden a utilizar fórmulas alternativas que utilizan tos ferina acelular (Pa), que tiene un perfil más favorable de efectos secundarios, en lugar de componentes de tos ferina de células enteras. En Europa, las vacunas hexavalentes que también contienen vacuna antipoliomielítica inactivada ( IPV ) se utilizan ampliamente. En los EE. UU., Las dos vacunas pentavalentes que han recibido la aprobación de comercialización contienen la vacuna IPV en lugar de la vacuna contra la hepatitis B (vacuna DTaP-IPV / Hib ) o la vacuna Hib (vacuna DTaP-IPV-HepB ).
Todos los precios de las vacunas pentavalentes cayeron y la discriminación de precios casi desapareció. Gráfico de GAVI; no se muestran los precios que no son de UNICEF
India
En 2013, se descubrió que las vacunas Pentavac PFS se suministraban con dos conjuntos de envases diferentes: uno con las fechas de fabricación y de caducidad se estaba proporcionando a los hospitales privados , mientras que el otro conjunto sin las fechas de fabricación y de caducidad se distribuía a los hospitales gubernamentales . Más tarde se aclaró que las vacunas sin fecha fueron suministradas por UNICEF y cumplían con la ley india .
Sri Lanka
Sri Lanka introdujo Quinvaxem en enero de 2008. En tres meses, cuatro informes de muertes y 24 informes de presuntos episodios de hipotonía-hiporrespuesta provocaron la atención reglamentaria y la suspensión preventiva del lote de vacuna inicial. Un posterior muerte que se produjo con el siguiente lote en abril de 2009 llevó a las autoridades a suspender el uso de la vacuna pentavalente y reanudar DTwP y la hepatitis B vacunación. Tras una investigación realizada por expertos nacionales e internacionales independientes, la vacuna se reintrodujo en 2010.
Bután
Bután introdujo Easyfive-TT en septiembre de 2009. La identificación de cinco casos con encefalopatía y / o meningoencefalitis poco después de la vacunación pentavalente llevó a las autoridades a suspender la vacunación el 23 de octubre de 2009. Posteriormente, se identificaron cuatro casos graves adicionales relacionados con la vacuna administrada antes de la suspensión. e investigado. Después de una revisión exhaustiva realizada por expertos nacionales e internacionales independientes, la vacuna se reintrodujo en 2011.
Vietnam
Entre diciembre de 2012 y marzo de 2013 se notificaron nueve muertes en Vietnam de niños que habían recibido recientemente inyecciones de la vacuna pentavalente Quinvaxem. El 4 de mayo de 2013, el Ministerio de Salud de Vietnam anunció que se suspendió el uso de Quinvaxem.
Después de una revisión de los casos realizada por expertos nacionales junto con personal de la OMS y UNICEF y un médico independiente, no se pudo identificar ningún vínculo con la vacunación. Las muertes notificadas en Vietnam se atribuyeron a problemas de salud coincidentes relacionados en el tiempo pero no relacionados con el uso de Quinvaxem, o casos para los cuales la información disponible no permitió una conclusión definitiva pero no hubo signos clínicos que fueran consistentes con el uso. de la vacuna. El informe de la OMS enfatizó que se habían administrado más de 400 millones de dosis de Quinvaxem y que nunca se había asociado ningún evento adverso fatal con Quinvaxem o vacunas similares.
Luego de informes adicionales de India , Sri Lanka y Bután sobre una pequeña cantidad de eventos adversos graves luego de la inmunización con vacunas pentavalentes, la OMS solicitó a un panel global de expertos independientes que revisaran la seguridad de la vacuna. Esta revisión se llevó a cabo del 12 al 13 de junio de 2013 y concluyó que no se podía atribuir ninguna reacción inusual a las vacunas pentavalentes. El 20 de junio de 2013, el Ministerio de Salud anunció que Vietnam reanudaría el uso de Quinvaxem.
Los eventos reportados en estas naciones asiáticas causaron incertidumbre pública con respecto al uso de vacunas pentavalentes para propagarse a otras naciones en desarrollo. En respuesta a esto, y la correspondiente difusión de información inexacta sobre la seguridad de las vacunas, la Academia India de Pediatría emitió una declaración en apoyo de las vacunas pentavalentes.
Formulaciones
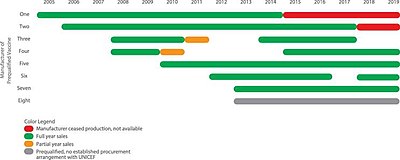
Las versiones comunes de las vacunas pentavalentes incluyen Quinvaxem, Pentavac PFS, Easyfive TT, ComBE Five, Shan5 y Pentabio.
| Vacuna | Fabricante | Fecha precalificada por la OMS |
|---|---|---|
| Quinvaxem | Crucell | 26 de septiembre de 2006 |
| Pentavac PFS | Instituto de suero de la India | 23 de junio de 2010 |
| Easyfive TT | Panacea Biotec | 2 de octubre de 2013 |
| ComBE cinco | E. biológico limitado | 1 de septiembre de 2011 |
| Shan5 | Biotecnología Shantha | 29 de abril de 2014 |
| Pentabio | Bio Farma | 19 de diciembre de 2014 |
Notas
Referencias
Otras lecturas
- Dodoo AN, Renner L, van Grootheest AC, Labadie J, Antwi-Agyei KO, Hayibor S, et al. (2007). "Vigilancia de la seguridad de una nueva vacuna pentavalente en el programa ampliado de inmunización en Ghana". Seguridad de los medicamentos . 30 (4): 347–56. doi : 10.2165 / 00002018-200730040-00007 . PMID 17408311 . S2CID 37633844 .
- Verma R, Khanna P, Chawla S (julio de 2013). "Vacuna DTP pentavalente: debe incorporarse en el programa de vacunación de la India" . Vacunas e inmunoterapias humanas . 9 (7): 1497–9. doi : 10.4161 / hv.24382 . PMID 23571225 .
enlaces externos
- Quinn B (6 de junio de 2011). "Empresas farmacéuticas para bajar el precio de las vacunas en los países en desarrollo" . The Guardian .
- Dhar A (11 de octubre de 2013). "La vacuna pentavalente se pone limpia, lista para su ampliación a escala nacional" . El hindú .
- Sinha V (10 de junio de 2011). "Organización de la salud, Fundación Gates promueven un mayor uso de vacunas" . Voice of America . Archivado desde el original el 5 de marzo de 2016.