Pseudomonas aeruginosa -Pseudomonas aeruginosa
| Pseudomonas aeruginosa | |
|---|---|

|
|
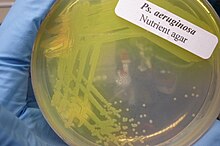
| Colonias de P. aeruginosa en agar sangre | |
|
clasificación cientifica |
|
| Dominio: | Bacterias |
| Filo: | Proteobacterias |
| Clase: | Gammaproteobacteria |
| Pedido: | Pseudomonadales |
| Familia: | Pseudomonadaceae |
| Género: | Pseudomonas |
| Grupo de especies : | Grupo Pseudomonas aeruginosa |
| Especies: |
P. aeruginosa
|
| Nombre binomial | |
|
Pseudomonas aeruginosa (Schröter 1872)
Migula 1900 |
|
| Sinónimos | |
|
|
Pseudomonas aeruginosa es una bacteria en forma de bastoncillo encapsulada común, gramnegativa , aeróbica estricta (aunque puede crecer anaeróbicamente en presencia de nitrato)que puede causar enfermedades en plantas y animales, incluidos los seres humanos. Una especie de considerable importancia médica, P. aeruginosa es un patógeno resistente a múltiples fármacos reconocido por su ubicuidad, susmecanismos intrínsecamente avanzados de resistencia a los antibióticos y su asociación con enfermedades graves: infecciones adquiridas en el hospital , como neumonía asociada al ventilador y varios síndromes de sepsis .
El organismo se considera oportunista en la medida en que a menudo se producen infecciones graves durante enfermedades o afecciones existentes , sobre todo fibrosis quística y quemaduras traumáticas. Por lo general, afecta a los inmunodeprimidos, pero también puede infectar a los inmunocompetentes, como en la foliculitis del jacuzzi . El tratamiento de las infecciones por P. aeruginosa puede resultar difícil debido a su resistencia natural a los antibióticos. Cuando se necesitan regímenes de antibióticos más avanzados, pueden producirse efectos adversos .
Es citrato , catalasa y oxidasa positiva . Se encuentra en el suelo, el agua, la flora de la piel y la mayoría de los entornos artificiales en todo el mundo. Prospera no solo en atmósferas normales, sino también en atmósferas con poco oxígeno , por lo que ha colonizado muchos entornos naturales y artificiales. Utiliza una amplia gama de materia orgánica para la alimentación; en los animales, su versatilidad permite al organismo infectar tejidos dañados o con inmunidad reducida. Los síntomas de tales infecciones son inflamación generalizada y sepsis . Si tales colonizaciones ocurren en órganos críticos del cuerpo, como los pulmones , el tracto urinario y los riñones , los resultados pueden ser fatales. Debido a que prospera en superficies húmedas, esta bacteria también se encuentra en y en equipos médicos , incluidos catéteres , y causa infecciones cruzadas en hospitales y clínicas . También es capaz de descomponer hidrocarburos y se ha utilizado para descomponer las bolas de alquitrán y el petróleo de los derrames de petróleo . P. aeruginosa no es extremadamente virulenta en comparación con otras especies bacterianas patógenas importantes, por ejemplo, Staphylococcus aureus y Streptococcus pyogenes , aunque P. aeruginosa es capaz de una colonización extensa y puede agregarse en biopelículas duraderas .
Nomenclatura
La palabra Pseudomonas significa "unidad falsa", del griego pseudēs ( griego : ψευδής, falso) y ( latín : monas , del griego : μονάς, una sola unidad). La palabra raíz mon se usó temprano en la historia de la microbiología para referirse a los gérmenes , por ejemplo, el reino Monera .
El nombre de la especie aeruginosa es una palabra latina que significa verdín ("óxido de cobre"), en referencia al color azul verdoso de los cultivos de laboratorio de la especie. Este pigmento azul verdoso es una combinación de dos metabolitos de P. aeruginosa , piocianina (azul) y pioverdina (verde), que imparten el color azul verdoso característico de los cultivos. Otra afirmación de 1956 es que aeruginosa puede derivarse del prefijo griego ae, que significa "viejo o envejecido", y el sufijo ruginosa significa arrugado o irregular.
Los nombres piocianina y pioverdina provienen del griego, con pyo- , que significa "pus", cianina , que significa "azul", y verdine , que significa "verde". Por tanto, el término "bacteria piocianica" se refiere específicamente a la característica de "pus azul" de una infección por P. aeruginosa . La pioverdina en ausencia de piocianina es de color amarillo fluorescente.
Biología
Genoma
El genoma de P. aeruginosa consiste en un cromosoma circular relativamente grande (5,5 a 6,8 Mb) que lleva entre 5.500 y 6.000 marcos de lectura abiertos y, a veces, plásmidos de varios tamaños según la cepa. La comparación de 389 genomas de diferentes cepas de P. aeruginosa mostró que solo se comparte el 17,5%. Esta parte del genoma es el genoma central de P. aeruginosa .
| cepa: | VRFPA04 | C3719 | PAO1 | PA14 | PACS2 |
|---|---|---|---|---|---|
| Tamaño del cromosoma (bp) | 6.818.030 | 6.222.097 | 6.264.404 | 6.537.648 | 6.492.423 |
| ORF | 5.939 | 5.578 | 5.571 | 5,905 | 5.676 |
Un estudio genómico comparativo (en 2020) analizó 494 genomas completos del género Pseudomonas , de los cuales 189 eran cepas de P. aeruginosa . El estudio observó que el recuento de proteínas y el contenido de GC oscilaron entre 5500 y 7352 (promedio: 6192) y entre 65,6 y 66,9% (promedio: 66,1%), respectivamente. Este análisis comparativo identificó además 1811 proteínas del núcleo de aeruginosa, que representan más del 30% del proteoma. El mayor porcentaje de proteínas del núcleo de aeruginosa en este último análisis podría atribuirse en parte al uso de genomas completos. Aunque P. aeruginosa es una especie monofilética muy bien definida, filogenómicamente y en términos de valores de ANIm, es sorprendentemente diversa en términos de contenido de proteínas, revelando así un proteoma accesorio muy dinámico, de acuerdo con varios análisis. Parece que, en promedio, las cepas industriales tienen los genomas más grandes, seguidas de las cepas ambientales y luego las cepas clínicas. El mismo estudio comparativo (494 cepas de Pseudomonas , de las cuales 189 son P. aeruginosa ) identificó que 41 de las 1811 proteínas centrales de P. aeruginosa estaban presentes solo en esta especie y no en ningún otro miembro del género, con 26 (de las 41 ) anotado como hipotético. Además, otros 19 grupos de proteínas ortólogos están presentes en al menos 188/189 cepas de P. aeruginosa y están ausentes en todas las demás cepas del género.
Estructura poblacional
La población de P. aeruginosa forma tres linajes principales, caracterizados por los genomas terminados PAO1, PA14 y el muy divergente PA7.
Aunque generalmente se piensa que P. aeruginosa es un patógeno oportunista, varios clones generalizados parecen haberse convertido en patógenos más especializados, particularmente en pacientes con fibrosis quística, incluida la cepa epidémica de Liverpool (LES) que se encuentra principalmente en el Reino Unido, DK2 en Dinamarca. y AUST-02 en Australia (también conocido anteriormente como AES-2 y P2). También hay un clon que se encuentra con frecuencia infectando el tracto reproductivo de los caballos.
Metabolismo
P. aeruginosa es un anaerobio facultativo , ya que está bien adaptado para proliferar en condiciones de agotamiento parcial o total de oxígeno. Este organismo puede lograr un crecimiento anaeróbico con nitrato o nitrito como aceptor terminal de electrones . Cuando no hay oxígeno, nitrato y nitrito, es capaz de fermentar arginina y piruvato mediante fosforilación a nivel de sustrato . La adaptación a entornos microaeróbicos o anaeróbicos es esencial para ciertos estilos de vida de P. aeruginosa , por ejemplo, durante la infección pulmonar en la fibrosis quística y la discinesia ciliar primaria , donde capas gruesas de moco pulmonar y alginato producido por bacterias que rodean las células bacterianas mucoides pueden limitar la difusión de oxígeno. El crecimiento de P. aeruginosa dentro del cuerpo humano puede ser asintomático hasta que las bacterias forman una biopelícula que abruma al sistema inmunológico. Estas biopelículas se encuentran en los pulmones de personas con fibrosis quística y discinesia ciliar primaria y pueden resultar fatales.
Cooperación celular
P. aeruginosa depende del hierro como fuente de nutrientes para crecer. Sin embargo, el hierro no es de fácil acceso porque no se encuentra comúnmente en el medio ambiente. El hierro se encuentra generalmente en una forma férrica en gran parte insoluble. Además, niveles excesivamente altos de hierro pueden ser tóxicos para P. aeruginosa . Para superar esto y regular la ingesta adecuada de hierro, P. aeruginosa utiliza sideróforos , que son moléculas secretadas que se unen y transportan el hierro. Estos complejos de hierro-sideróforo, sin embargo, no son específicos. La bacteria que produjo los sideróforos no necesariamente recibe el beneficio directo de la ingesta de hierro. Por el contrario, es igualmente probable que todos los miembros de la población celular accedan a los complejos hierro-sideróforo. Los miembros de la población celular que pueden producir eficientemente estos sideróforos se denominan comúnmente cooperadores; los miembros que producen poco o nada de sideróforos a menudo se denominan tramposos. La investigación ha demostrado que cuando los cooperadores y los tramposos crecen juntos, los cooperadores tienen una disminución en la aptitud, mientras que los tramposos tienen un aumento en la aptitud. La magnitud del cambio en la aptitud aumenta con el aumento de la limitación de hierro. Con un aumento en la aptitud, los tramposos pueden superar a los cooperadores; esto conduce a una disminución general de la aptitud del grupo, debido a la falta de suficiente producción de sideróforos. Estas observaciones sugieren que tener una mezcla de cooperadores y tramposos puede reducir la naturaleza virulenta de P. aeruginosa .
Enzimas
Las LigD forman una subfamilia de las ligasas de ADN . Todos estos tienen un dominio LigDom / ligasa, pero muchas LigD bacterianas también tienen dominios polimerasa / PolDoms y dominios nucleasa / NucDoms separados. En el caso de P. aeruginosa , los dominios de nucleasa son N-terminal , y los dominios de polimerasa son C-terminal , extensiones del dominio de ligasa central único.
Patogénesis
Un oportunista , nosocomial patógeno de inmunocomprometidos individuos, P. aeruginosa típicamente infecta las vías respiratorias, del tracto urinario , quemaduras , y heridas , y también causa otras infecciones de la sangre .
| Infecciones | Detalles y asociaciones comunes | Grupos de alto riesgo |
|---|---|---|
| Neumonía | Bronconeumonía difusa | Pacientes con fibrosis quística , bronquiectasias sin FQ |
| Shock séptico | Asociado con una lesión cutánea de color púrpura-negro ectima gangrenoso | Pacientes neutropénicos |
| Infección del tracto urinario | Cateterismo del tracto urinario | |
| Infección gastrointestinal | Enterocolitis necrotizante | Lactantes prematuros y pacientes con cáncer neutropénico |
| Infecciones de piel y tejidos blandos. | Hemorragia y necrosis. | Personas con quemaduras o infecciones de heridas. |
Es la causa más común de infecciones de quemaduras y del oído externo ( otitis externa ), y es el colonizador más frecuente de dispositivos médicos (p. Ej., Catéteres ). Las pseudomonas se pueden transmitir a través de equipos que se contaminan y no se limpian adecuadamente o en las manos de los trabajadores de la salud. Pseudomonas puede, en raras circunstancias, causar neumonías extrahospitalarias , así como neumonías asociadas al ventilador , siendo uno de los agentes más comunes aislados en varios estudios. La piocianina es un factor de virulencia de la bacteria y se sabe que causa la muerte en C. elegans por estrés oxidativo . Sin embargo, el ácido salicílico puede inhibir la producción de piocianina. Una de cada diez infecciones adquiridas en el hospital es por Pseudomonas . Los pacientes con fibrosis quística también están predispuestos a la infección de los pulmones por P. aeruginosa debido a una pérdida funcional en el movimiento del ión cloruro a través de las membranas celulares como resultado de una mutación . P. aeruginosa también puede ser una causa común de "sarpullido en la bañera de hidromasaje" ( dermatitis ), causada por la falta de atención periódica adecuada a la calidad del agua. Dado que estas bacterias prosperan en ambientes húmedos, como jacuzzis y piscinas, pueden causar sarpullido en la piel o oído de nadador. Pseudomonas también es una causa común de infección posoperatoria en pacientes de cirugía de queratotomía radial . El organismo también se asocia con la lesión cutánea ectima gangrenosa . P. aeruginosa se asocia con frecuencia con osteomielitis que implica heridas punzantes en el pie, que se cree que son el resultado de la inoculación directa con P. aeruginosa a través del acolchado de espuma que se encuentra en las zapatillas de tenis, y los pacientes diabéticos tienen un mayor riesgo.
Un análisis genómico comparativo de 494 genomas de Pseudomonas en competencia , incluidos 189 genomas completos de P. aeruginosa , identificó varias proteínas que son compartidas por la gran mayoría de las cepas de P. aeruginosa , pero que no se observan en otros genomas de Pseudomonas analizados . De manera intrínseca, se sabe que estas proteínas centrales específicas de aeruginosa, como CntL, CntM, PlcB, Acp1, MucE, SrfA, Tse1, Tsi2, Tse3 y EsrC, desempeñan un papel importante en la patogenicidad de esta especie.
Toxinas
P. aeruginosa usa el factor de virulencia exotoxina A para inactivar el factor 2 de elongación eucariota a través de ADP-ribosilación en la célula huésped, al igual que lo hace la toxina diftérica . Sin el factor de elongación 2, las células eucariotas no pueden sintetizar proteínas y necrotizarse. La liberación de contenido intracelular induce una respuesta inmunológica en pacientes inmunocompetentes . Además, P. aeruginosa usa una exoenzima, ExoU, que degrada la membrana plasmática de las células eucariotas y conduce a la lisis . Cada vez más, se reconoce que el sideróforo que adquiere hierro , la pioverdina , también funciona como una toxina al eliminar el hierro de las mitocondrias , lo que inflige daño a este orgánulo.
Fenazinas
Las fenazinas son pigmentos con actividad redox producidos por P. aeruginosa . Estos pigmentos intervienen en la detección de quórum , la virulencia y la adquisición de hierro. P. aeruginosa produce varios pigmentos todas producidas por una ruta biosintética: piocianina , 1-hydroxyphenazine, fenazina-1-carboxamida, betaína de ácido 5-metilfenazina-1-carboxílico, y aeruginosin A. Dos operones están implicados en la biosíntesis de fenazina: phzA1B1C1D1E1F1G1 y phzA2B2C2D2E2F2G2 . Estos operones convierten un ácido corísmico en las fenazinas mencionadas anteriormente. Tres genes clave, phzH , phzM y phzS convierten el ácido fenazina-1-carboxílico en las fenazinas mencionadas anteriormente. Aunque la biosíntesis de fenazina está bien estudiada, quedan dudas en cuanto a la estructura final de la piomelanina de fenazina marrón .
Cuando se inhibe la biosíntesis de piocianina, se observa in vitro una disminución de la patogenicidad de P. aeruginosa . Esto sugiere que la piocianina es la principal responsable de la colonización inicial de P. aeruginosa in vivo .
Disparadores
Con niveles bajos de fosfato , se ha descubierto que P. aeruginosa se activa a partir de un simbionte benigno para expresar toxinas letales dentro del tracto intestinal y daña gravemente o mata al huésped, lo que puede mitigarse proporcionando un exceso de fosfato en lugar de antibióticos.
Plantas e invertebrados
En plantas superiores, P. aeruginosa induce la pudrición blanda , por ejemplo en Arabidopsis thaliana (berro Thale) y Lactuca sativa (lechuga). También es patógeno para los animales invertebrados, incluidos el nematodo Caenorhabditis elegans , la mosca de la fruta Drosophila y la polilla Galleria mellonella . Las asociaciones de factores de virulencia son las mismas para las infecciones de plantas y animales.
La detección de quórum
P. aeruginosa es un patógeno oportunista con la capacidad de coordinar la expresión génica para competir con otras especies por los nutrientes o la colonización. La regulación de la expresión génica puede ocurrir a través de la comunicación célula-célula o la detección de quórum (QS) a través de la producción de pequeñas moléculas llamadas autoinductores que se liberan al ambiente externo. Estas señales, al alcanzar concentraciones específicas correlacionadas con densidades celulares específicas de población, activan sus respectivos reguladores alterando así la expresión génica y el comportamiento de coordinación. P. aeruginosa emplea cinco sistemas QS interconectados (las, rhl, pqs, iqs y pch) que producen cada uno moléculas de señalización únicas. Los sistemas las y rhl son responsables de la activación de numerosos genes controlados por QS, el sistema pqs está involucrado en la señalización de quinolonas y el sistema iqs juega un papel importante en la comunicación intercelular. QS en P. aeruginosa está organizado de manera jerárquica. En la parte superior de la jerarquía de señalización se encuentra el sistema las, ya que el regulador las inicia el sistema regulador QS activando la transcripción de varios otros reguladores, como rhl. Entonces, el sistema las define una cascada QS jerárquica desde los regulones las hasta los rhl. La detección de estas moléculas indica que P. aeruginosa está creciendo como biopelícula dentro de los pulmones de pacientes con fibrosis quística. Sin embargo, el impacto de los sistemas QS y especialmente las sobre la patogenicidad de P. aeruginosa no está claro. Los estudios han demostrado que los mutantes deficientes en lasR se asocian con resultados más graves en pacientes con fibrosis quística y se encuentran en hasta el 63% de los pacientes con fibrosis quística con infección crónica a pesar de la actividad de QS deteriorada.
Se sabe que QS controla la expresión de varios factores de virulencia de manera jerárquica, incluido el pigmento piocianina. Sin embargo, aunque el sistema inicia la regulación de la expresión génica, su ausencia no conduce a la pérdida de los factores de virulencia. Recientemente, se ha demostrado que el sistema rhl controla parcialmente los factores específicos de las, como las enzimas proteolíticas responsables de las actividades elastolíticas y estafilolíticas, pero de manera retardada. Entonces, las es un regulador directo e indirecto de genes controlados por QS. Otra forma de regulación genética que permite que las bacterias se adapten rápidamente a los cambios circundantes es a través de la señalización ambiental. Estudios recientes han descubierto que la anaerobiosis puede afectar significativamente el circuito regulador principal de QS. Este importante vínculo entre QS y anaerobiosis tiene un impacto significativo en la producción de factores de virulencia de este organismo. El ajo bloquea experimentalmente la detección de quórum en P. aeruginosa .
Formación de biopelículas y di-GMP cíclico
Como en la mayoría de las bacterias Gram negativas, la formación de biopelículas de P. aeruginosa está regulada por una sola molécula: di-GMP cíclico . A baja concentración cíclica de di-GMP, P. aeruginosa tiene un modo de vida de nado libre. Pero cuando aumentan los niveles cíclicos de di-GMP, P. aeruginosa comienza a establecer comunidades sésiles en las superficies. La concentración intracelular de di-GMP cíclico aumenta en segundos cuando P. aeruginosa toca una superficie ( por ejemplo : una roca, plástico, tejidos del huésped ...). Esto activa la producción de pili adhesivos, que sirven como "anclajes" para estabilizar la fijación de P. aeruginosa en la superficie. En etapas posteriores, las bacterias comenzarán a adherirse irreversiblemente al producir una matriz fuertemente adhesiva. Al mismo tiempo, el di-GMP cíclico reprime la síntesis de la maquinaria flagelar, impidiendo que P. aeruginosa nade. Cuando se suprimen, las biopelículas son menos adherentes y más fáciles de tratar. La matriz de la biopelícula de P. aeruginosa está compuesta de ácidos nucleicos, aminoácidos, carbohidratos y varios iones. Protege mecánica y químicamente a P. aeruginosa de la agresión del sistema inmunológico y de algunos compuestos tóxicos. La matriz de la biopelícula de P. aeruginosa está compuesta por 2 tipos de azúcares (o "exopolisacáridos") denominados PSL y PEL:
- El locus de síntesis de polisacáridos (PSL) y el di-GMP cíclico forman un circuito de retroalimentación positiva. El PSL estimula la producción de di-GMP cíclico, mientras que el di-GMP cíclico alto activa el operón y aumenta la actividad del operón. Este operón de 15 genes es responsable de las interacciones célula-célula y superficie celular necesarias para la comunicación celular. También es responsable del secuestro de la matriz de sustancia polimérica extracelular.
- PEL es un exopolisacárido catiónico que reticula el ADN extracelular en la matriz de la biopelícula de P. aeruginosa .
Ante ciertas señales o tensiones, P. aeruginosa revierte el programa de biopelícula y se desprende. Estudios recientes han demostrado que las células dispersas de las biopelículas de P. aeruginosa tienen niveles de di-GMP cíclicos más bajos y fisiologías diferentes a las de las células planctónicas y de biopelículas. Se ha descubierto que estas células dispersas son muy virulentas contra los macrófagos y C. elegans , pero muy sensibles al estrés por hierro, en comparación con las células planctónicas.
Biofilms y resistencia al tratamiento
Las biopelículas de P. aeruginosa pueden causar infecciones oportunistas crónicas , que son un problema grave para la atención médica en las sociedades industrializadas, especialmente para los pacientes inmunodeprimidos y los ancianos. A menudo, no se pueden tratar eficazmente con la terapia con antibióticos tradicional . Las biopelículas parecen proteger a estas bacterias de factores ambientales adversos. P. aeruginosa puede causar infecciones nosocomiales y se considera un organismo modelo para el estudio de bacterias resistentes a los antibióticos. Los investigadores consideran importante aprender más sobre los mecanismos moleculares que provocan el cambio del crecimiento planctónico a un fenotipo de biopelícula y sobre el papel de QS en bacterias resistentes al tratamiento como P. aeruginosa . Esto debería contribuir a un mejor tratamiento clínico de los pacientes con infección crónica y debería conducir al desarrollo de nuevos fármacos.
Recientemente, los científicos han estado examinando la posible base genética de la resistencia de P. aeruginosa a antibióticos como la tobramicina . Un locus identificado como un determinante genético importante de la resistencia en esta especie es ndvB , que codifica glucanos periplásmicos que pueden interactuar con antibióticos y hacer que sean secuestrados en el periplasma. Estos resultados sugieren que existe una base genética detrás de la resistencia bacteriana a los antibióticos, en lugar de que la biopelícula actúe simplemente como una barrera de difusión del antibiótico.
Diagnóstico
Dependiendo de la naturaleza de la infección, se recolecta una muestra apropiada y se envía a un laboratorio de bacteriología para su identificación. Como ocurre con la mayoría de las muestras bacteriológicas, se realiza una tinción de Gram , que puede mostrar bacilos gramnegativos y / o glóbulos blancos . P. aeruginosa produce colonias con un olor característico a "uva" o "tortilla fresca" en medios bacteriológicos. En cultivos mixtos, puede aislarse como colonias claras en agar MacConkey (ya que no fermenta la lactosa ) que darán positivo a oxidasa . Las pruebas de confirmación incluyen la producción del pigmento azul verdoso piocianina en agar cetrimida y el crecimiento a 42 ° C. A menudo se utiliza una inclinación TSI para distinguir las especies de Pseudomonas no fermentadoras de los patógenos entéricos en las muestras fecales.
Cuando P. aeruginosa se aísla de un sitio normalmente estéril (sangre, hueso, colecciones profundas), generalmente se considera peligroso y casi siempre requiere tratamiento. Sin embargo, P. aeruginosa se aísla con frecuencia de sitios no estériles (hisopos bucales, esputo , etc.) y, en estas circunstancias, puede representar colonización y no infección. El aislamiento de P. aeruginosa a partir de muestras no estériles debe, por lo tanto, interpretarse con cautela, y debe buscarse el consejo de un microbiólogo o médico / farmacéutico de enfermedades infecciosas antes de iniciar el tratamiento. A menudo, no se necesita ningún tratamiento.
Identificación
| Prueba | Resultados |
|---|---|
| Tinción de Gram | - |
| Oxidasa | + |
| Producción de indol | - |
| Rojo de metilo | - |
| Voges-Proskauer | - |
| Citrato | + |
| Producción de sulfuro de hidrógeno | - |
| Hidrólisis de urea | - |
| Fenilalanina desaminasa | - |
| Lisina descarboxilasa | - |
| Motilidad | + |
| Hidrólisis de gelatina | + |
| ácido de lactosa | - |
| ácido de glucosa | + |
| ácido de maltosa | - |
| ácido de manitol | + |
| ácido de sacarosa | - |
| reducción de nitratos | + |
| ADNasa | - |
| Lipasa | + |
| Pigmento | + (pigmentación verde azulada) |
| Catalasa | + |
| Hemólisis | Beta / variable |
P. aeruginosa es una bacteria gramnegativa, aeróbica (y en ocasiones facultativamente anaeróbica ), en forma de bastoncillo con motilidad unipolar . Se ha identificado como un patógeno oportunista tanto de humanos como de plantas. P. aeruginosa es la especie tipo del género Pseudomonas .
La identificación de P. aeruginosa puede complicarse por el hecho de que los aislados individuales a menudo carecen de motilidad. Además, las mutaciones en el gen lasR alteran drásticamente la morfología de la colonia y, por lo general, conducen a una falla en la hidrolización de la gelatina o la hemolización.
En ciertas condiciones, P. aeruginosa puede secretar una variedad de pigmentos, incluyendo piocianina (azul), pioverdina (amarillo y fluorescente ), piorubina (rojo) y piomelanina (marrón). Estos se pueden utilizar para identificar el organismo.
La identificación clínica de P. aeruginosa puede incluir la identificación de la producción tanto de piocianina como de fluoresceína, así como su capacidad para crecer a 42 ° C. P. aeruginosa es capaz de crecer en los combustibles diésel y de aviación , donde se le conoce como un microorganismo que usa hidrocarburos y causa corrosión microbiana . Crea esteras oscuras y gelesas a veces llamadas incorrectamente " algas " debido a su apariencia.
Tratamiento
Muchos aislados de P. aeruginosa son resistentes a una amplia gama de antibióticos y pueden demostrar una resistencia adicional después de un tratamiento fallido. Por lo general, debería ser posible orientar el tratamiento de acuerdo con las sensibilidades del laboratorio, en lugar de elegir un antibiótico empíricamente . Si los antibióticos se inician de forma empírica, se deben hacer todos los esfuerzos posibles para obtener cultivos (antes de administrar la primera dosis de antibiótico) y se debe revisar la elección del antibiótico utilizado cuando los resultados del cultivo estén disponibles.

Debido a la resistencia generalizada a muchos antibióticos comunes de primera línea, los carbapenémicos , las polimixinas y, más recientemente, la tigeciclina se consideraron los fármacos de elección; sin embargo, también se ha informado de resistencia a estos fármacos. A pesar de esto, todavía se utilizan en áreas donde aún no se ha informado de resistencia. Se ha recomendado el uso de inhibidores de la β-lactamasa como sulbactam en combinación con antibióticos para mejorar la acción antimicrobiana incluso en presencia de un cierto nivel de resistencia. Se ha descubierto que la terapia combinada después de rigurosas pruebas de sensibilidad a los antimicrobianos es el mejor curso de acción en el tratamiento de P. aeruginosa resistente a múltiples fármacos . Algunos antibióticos de próxima generación que se reportan como activos contra P. aeruginosa incluyen doripenem, ceftobiprol y ceftarolina. Sin embargo, estos requieren más ensayos clínicos para la estandarización. Por tanto, es muy necesaria la investigación para el descubrimiento de nuevos antibióticos y fármacos contra P. aeruginosa . Los antibióticos que pueden tener actividad contra P. aeruginosa incluyen:
- aminoglucósidos ( gentamicina , amikacina , tobramicina , pero no kanamicina )
- quinolonas ( ciprofloxacina , levofloxacina , pero no moxifloxacina )
-
cefalosporinas ( ceftazidima , cefepima , cefoperazona , cefpiroma , ceftobiprol , pero no cefuroxima , cefotaxima o ceftriaxona )
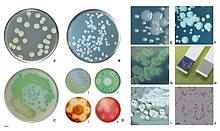
 Ejemplos de pruebas de susceptibilidad a antibióticos de P. aeruginosa . La prueba de difusión en disco (A) y la prueba de MIC (B). P. aeruginosa es intrínsecamente resistente a ampicilina / sulbactam , tigeciclina y trimetoprima / sulfametoxazol (sin puntos de corte en Img. B).
Ejemplos de pruebas de susceptibilidad a antibióticos de P. aeruginosa . La prueba de difusión en disco (A) y la prueba de MIC (B). P. aeruginosa es intrínsecamente resistente a ampicilina / sulbactam , tigeciclina y trimetoprima / sulfametoxazol (sin puntos de corte en Img. B). - penicilinas antipseudomonas : carboxipenicilinas ( carbenicilina y ticarcilina ) y ureidopenicilinas ( mezlocilina , azlocilina y piperacilina ). P. aeruginosa es intrínsecamente resistente a todas las demás penicilinas .
- carbapenémicos ( meropenem , imipenem , doripenem , pero no ertapenem )
- polimixinas ( polimixina B y colistina )
- monobactamas ( aztreonam )
Como las fluoroquinolonas son una de las pocas clases de antibióticos ampliamente eficaces contra P. aeruginosa , en algunos hospitales su uso está muy restringido para evitar el desarrollo de cepas resistentes. En las raras ocasiones en las que la infección es superficial y limitada (por ejemplo, infecciones de oído o de uñas), se puede utilizar gentamicina o colistina tópicas .
Para las infecciones de heridas por pseudomonas, el ácido acético con concentraciones de 0,5% a 5% puede ser un agente bacteriostático eficaz para eliminar las bacterias de la herida. Por lo general, se coloca una gasa estéril empapada con ácido acético sobre la herida después de la irrigación con solución salina normal. El vendaje se haría una vez al día. Las pseudomonas suelen eliminarse en el 90% de los casos después de 10 a 14 días de tratamiento.
Resistencia antibiótica
Una de las características más preocupantes de P. aeruginosa es su baja susceptibilidad a los antibióticos, que se atribuye a una acción concertada de bombas de eflujo de múltiples fármacos con genes de resistencia a antibióticos codificados cromosómicamente (p. Ej., MexAB , mexXY , etc.) y la baja permeabilidad de la bacteria. sobres celulares. Además de esta resistencia intrínseca, P. aeruginosa desarrolla fácilmente resistencia adquirida, ya sea por mutación en genes codificados cromosómicamente o por transferencia genética horizontal de determinantes de resistencia a antibióticos. El desarrollo de resistencia a múltiples fármacos por los aislados de P. aeruginosa requiere varios eventos genéticos diferentes, incluida la adquisición de diferentes mutaciones y / o la transferencia horizontal de genes de resistencia a antibióticos. La hipermutación favorece la selección de resistencia a antibióticos impulsada por mutaciones en cepas de P. aeruginosa que producen infecciones crónicas, mientras que la agrupación de varios genes de resistencia a antibióticos diferentes en integrones favorece la adquisición concertada de determinantes de resistencia a antibióticos. Algunos estudios recientes han demostrado que la resistencia fenotípica asociada a la formación de biopelículas o al surgimiento de variantes de colonias pequeñas puede ser importante en la respuesta de las poblaciones de P. aeruginosa al tratamiento con antibióticos .
Se ha descubierto que los mecanismos subyacentes a la resistencia a los antibióticos incluyen la producción de enzimas que degradan o inactivan los antibióticos, proteínas de la membrana externa para expulsar los antibióticos y mutaciones para cambiar los objetivos de los antibióticos. Presencia de enzimas que degradan antibióticos como β-lactamasas de espectro extendido como PER-1, PER-2, VEB-1, cefalosporinasas AmpC, carbapenemasas como serina oxacilinasas, metalo-b-lactamasas, carbapenemasas de tipo OXA, enzimas modificadoras de aminoglucósidos , entre otros. P. aeruginosa también puede modificar los objetivos de la acción de los antibióticos, por ejemplo, la metilación del ARNr 16S para evitar la unión de aminoglucósidos y la modificación del ADN, o la topoisomerasa para protegerlo de la acción de las quinolonas. También se ha informado que P. aeruginosa posee sistemas de bombas de eflujo de múltiples fármacos que confieren resistencia contra una serie de clases de antibióticos y la familia MexAB-OprM ( familia de división de resistencia-nodulación ( RND )) se considera la más importante . Un factor importante asociado con la resistencia a los antibióticos es la disminución de la capacidad de virulencia de la cepa resistente. Estos hallazgos se han informado en el caso de cepas resistentes a la rifampicina y a la colistina, en las que se ha documentado una disminución de la capacidad infecciosa, la detección de quórum y la motilidad.
Las mutaciones en la ADN girasa se asocian comúnmente con la resistencia a los antibióticos en P. aeruginosa . Estas mutaciones, cuando se combinan con otras, confieren una alta resistencia sin obstaculizar la supervivencia. Además, los genes implicados en la señalización cíclica de di-GMP pueden contribuir a la resistencia. Cuando se cultivan en condiciones in vitro diseñadas para imitar los pulmones de un paciente con fibrosis quística, estos genes mutan repetidamente.
Se demostró que dos ARN pequeños : Sr0161 y ErsA interactúan con el ARNm que codifica la principal porina OprD responsable de la captación de antibióticos carbapenémicos en el periplasma . Los ARNs se unen al 5'UTR de oprD provocando un aumento de la resistencia bacteriana al meropenem . Se sugirió otro ARNs: Sr006 para regular positivamente (postranscripcionalmente) la expresión de PagL, una enzima responsable de la desacilación del lípido A. Esto reduce la propiedad proinflamatoria del lípido A. Además, de manera similar al estudio en Salmonella Sr006 la regulación de PagL Se sugirió que la expresión ayudara en la resistencia a la polimixina B.
Prevención
La profilaxis con probióticos puede prevenir la colonización y retrasar la aparición de la infección por Pseudomonas en una UCI. Se está investigando la inmunoprofilaxis contra Pseudomonas . El riesgo de contraer P. aeruginosa se puede reducir evitando piscinas, jacuzzis y otros cuerpos de agua estancada; desinfectar y / o reemplazar regularmente el equipo que se encuentra regularmente con la humedad (como el equipo y las soluciones para lentes de contacto); y lavarse las manos con frecuencia (lo que también protege contra muchos otros patógenos). Sin embargo, incluso las mejores prácticas de higiene no pueden proteger totalmente a un individuo contra P. aeruginosa, dado lo común que es P. aeruginosa en el medio ambiente.
Terapias experimentales
La terapia con fagos contra P. aeruginosa se ha investigado como un posible tratamiento eficaz, que puede combinarse con antibióticos, no tiene contraindicaciones y tiene efectos adversos mínimos. Los fagos se producen como líquido estéril, adecuado para ingesta, aplicaciones, etc. La terapia con fagos contra las infecciones del oído causadas por P. aeruginosa se informó en la revista Clinical Otolaryngology en agosto de 2009.
Investigar
En 2013, João Xavier describió un experimento en el que P. aeruginosa , cuando se sometió a repetidas rondas de condiciones en las que necesitaba enjambrar para adquirir alimento, desarrolló la capacidad de "hipersensibilizarse" a velocidades un 25% más rápidas que los organismos de línea de base, al desarrollar múltiples flagelos , mientras que el organismo de base tiene un solo flagelo. Este resultado fue notable en el campo de la evolución experimental por ser altamente repetible.
P. aeruginosa se ha estudiado para su uso en biorremediación y su uso en el procesamiento de polietileno en residuos sólidos urbanos .
Ver también
Referencias
- Breidenstein EB, de la Fuente-Núñez C, Hancock RE (agosto de 2011). "Pseudomonas aeruginosa: todos los caminos llevan a la resistencia". Tendencias en microbiología . 19 (8): 419–26. doi : 10.1016 / j.tim.2011.04.005 . PMID 21664819 .
enlaces externos
- Tipo de cepa de Pseudomonas aeruginosa en Bac Dive - la base de metadatos de diversidad bacteriana
- Johanna M. Sweere y col. (2019): Los bacteriófagos desencadenan la inmunidad antiviral y previenen la eliminación de la infección bacteriana , Science 29 de marzo de 2019: Vol. 363, Edición 6434, eaat9691. doi: 10.1126 / science.aat9691 sobre fagos filamentosos de Pseudomonas aeruginosa (fagos Pf), Inoviridae . Ver también:
- Los investigadores de la UM publican nuevos descubrimientos sobre virus bacterianos . En: EurekAlert! 1 de abril de 2019. Fuente: Universidad de Montana