Superóxido de potasio - Potassium superoxide
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
Dióxido de potasio
|
|
| Otros nombres
Superóxido de potasio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Tarjeta de información ECHA |
100.031.574 |
| Número CE | |
|
PubChem CID
|
|
| Número RTECS | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| K O 2 | |
| Masa molar | 71,096 g · mol −1 |
| Apariencia | sólido amarillo |
| Densidad | 2,14 g / cm 3 , sólido |
| Punto de fusion | 560 ° C (1,040 ° F; 833 K) (se descompone) |
| Hidrólisis | |
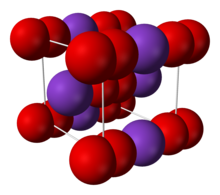
| Estructura | |
| Cúbico centrado en el cuerpo ( O- 2) |
|
| Termoquímica | |
|
Entropía molar estándar ( S |
117 J · mol −1 · K −1 |
| −283 kJ · mol −1 | |
| Riesgos | |
| Principales peligros | corrosivo, oxidante |
| Frases R (desactualizadas) | 14-8-34 |
| Frases S (desactualizadas) | 17-27-36 / 37/39 |
| NFPA 704 (diamante de fuego) | |
| Compuestos relacionados | |
|
Otros aniones
|
Óxido de potasio Peróxido de potasio |
|
Otros cationes
|
Superóxido de litio Superóxido de sodio Superóxido de rubidio |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El superóxido de potasio es un compuesto inorgánico de fórmula KO 2 . Es un sólido paramagnético amarillo que se descompone en el aire húmedo. Es un raro ejemplo de una sal estable del anión superóxido . El superóxido de potasio se utiliza como CO
2fregadora, H
2O deshumidificador y O
2generador en rebreathers , naves espaciales , submarinos y sistemas de soporte vital de trajes espaciales .
Producción y reacciones
El superóxido de potasio se produce quemando potasio fundido en una atmósfera de oxígeno .
- K + O
2 → KO
2
La sal se compone de K+
y O-
2iones, unidos por enlaces iónicos. La distancia O − O es 1,28 Å.
Reactividad
El superóxido de potasio es un oxidante fuerte , capaz de convertir óxidos en peróxidos u oxígeno molecular . La hidrólisis produce oxígeno gaseoso, peróxido de hidrógeno e hidróxido de potasio :
- 2 KO
2 + 2 H
2O → 2 KOH + H
2O
2+ O
2
El hidróxido de potasio (KOH) que absorbe dióxido de carbono produce carbonatos:
- 2 KOH + CO
2 → K 2 CO 3 + H 2 O - KOH + CO
2 → KHCO 3
La combinación de estas dos reacciones produce:
- 4 KO
2 + 2 CO
2 → 2 K 2 CO 3 + 3 O
2 - 4 KO
2 + 4 CO
2 + 2 H 2 O → 4 KHCO 3 + 3 O
2
El superóxido de potasio solo encuentra usos específicos como reactivo de laboratorio. Porque reacciona con el agua, KO
2se estudia a menudo en disolventes orgánicos. Dado que la sal es poco soluble en disolventes no polares, se utilizan típicamente éteres corona . El tetraetilamonio sal también se conoce. Las reacciones representativas de estas sales implican el uso de superóxido como nucleófilo , por ejemplo, para convertir bromuros de alquilo en alcoholes y cloruros de acilo en peróxidos de diacilo .
Aplicaciones
La Agencia Espacial Rusa ha tenido éxito utilizando superóxido de potasio en generadores químicos de oxígeno para sus trajes espaciales y la nave espacial Soyuz . KO
2También se ha utilizado en recipientes para respiradores para extinción de incendios y trabajos de rescate en minas , pero tuvo un uso limitado en respiradores de buceo debido a su reacción peligrosamente explosiva con el agua.
KO
2reacciona con CO
2 en la siguiente reacción:
- 4 KO 2 (s) + 2 CO 2 (g) → 2K 2 CO 3 (s) + 3O 2 (g)
Teóricamente, 1 kg de KO
2absorbe 0,310 kg de CO
2mientras libera 0.338 kg de O
2. Un lunar de KO
2absorbe 0,5 moles de CO
2pero libera sólo 0,75 moles de moléculas de gas oxígeno ( O 2 ).
Riesgos
El superóxido de potasio es un oxidante potente y puede producir reacciones explosivas cuando se combina con una variedad de sustancias y compuestos, incluyendo agua, ácidos, orgánicos o grafito en polvo. Incluso el superóxido seco puede producir un compuesto explosivo sensible al impacto cuando se combina con aceites orgánicos como el queroseno. En 1999, en el Laboratorio Nacional de Oak Ridge, la limpieza de óxidos de potasio de una fuga de metal NaK produjo una explosión sensible al impacto mientras estaba saturado con aceite mineral.
Referencias
- ↑ a b Zumdahl, Steven S. (2009). Principios químicos (6ª ed.). Houghton Mifflin. pag. A22. ISBN 978-0-618-94690-7.
- ^ Hayyan M .; Hashim MA; AlNashef IM (2016). "Ion superóxido: generación e implicaciones químicas" . Chem. Rev . 116 (5): 3029-3085. doi : 10.1021 / acs.chemrev.5b00407 . PMID 26875845 .Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Jakob, Harald; Leininger, Stefan; Lehmann, Thomas; Jacobi, Sylvia; Gutewort, Sven (2007). "Compuestos de peroxo, inorgánicos". Enciclopedia de química industrial de Ullmann . Wiley-VCH. doi : 10.1002 / 14356007.a19_177.pub2 . ISBN 978-3527306732.
- ^ Abrahams, SC; Kalnajs, J. (1955). "La estructura cristalina del superóxido de potasio α" . Acta Crystallographica . 8 (8): 503–6. doi : 10.1107 / S0365110X55001540 .
- ^ Kumar De, Anil (2007). Un libro de texto de química inorgánica . New Age International. pag. 247. ISBN 978-8122413847.
- ^ Johnson, Roy A .; Adrio, Javier; Ribagorda, María (2001). "Superóxido de potasio". Enciclopedia e-EROS de reactivos para síntesis orgánica . Wiley. doi : 10.1002 / 047084289X.rp250.pub2 . ISBN 0471936235.
-
^ Compañía nuclear Aerojet (1975). "Un análisis de peligros de explosivos de la solución eutéctica de NaK y KO
2". Laboratorio Nacional de Ingeniería de Idaho. - ^ "Investigación del accidente de Y-12 NaK" . Departamento de Energía de Estados Unidos. Febrero de 2000. Archivado desde el original el 28 de mayo de 2010.

