Complejo peridinina-clorofila-proteína - Peridinin-chlorophyll-protein complex
| Proteína de unión a peridinina-clorofila A | |||||||||
|---|---|---|---|---|---|---|---|---|---|
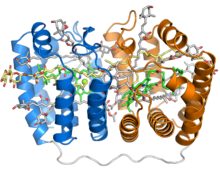
Estructura cristalina del complejo soluble peridinina-clorofila-proteína del dinoflagelado fotosintético Amphidinium carterae . Este complejo se encuentra en muchos dinoflagelados fotosintéticos e involucra una proteína en forma de bote o cuna con dos repeticiones pseudosimétricas de ocho hélices alfa (mostradas en azul y naranja) envueltas alrededor de una cavidad central llena de pigmento. Cada segmento de ocho hélices une una molécula de clorofila (verde, con el ion magnesio central mostrado como una esfera verde), una molécula de diacilglicerol (amarillo) y cuatro moléculas de peridinina (gris).
| |||||||||
| Identificadores | |||||||||
| Símbolo | PCP | ||||||||
| Pfam | PF02429 | ||||||||
| InterPro | IPR003376 | ||||||||
| Alcance | 1ppr / SUPFAM | ||||||||
| |||||||||
El complejo peridinina-clorofila-proteína ( PCP o PerCP ) es un complejo molecular soluble que consiste en la peridinina-clorofila-proteína unida a peridinina , clorofila y lípidos . Las moléculas de peridinina absorben luz en las longitudes de onda azul-verde (470 a 550 nm) y transfieren energía a las moléculas de clorofila con una eficiencia extremadamente alta. Los complejos de PCP se encuentran en muchos dinoflagelados fotosintéticos , en los que pueden ser los complejos captadores de luz primarios .
Estructura

La proteína PCP se ha identificado en genomas de dinoflagelados en al menos dos formas, una forma homodimérica compuesta por dos monómeros de 15 kD y una forma monomérica de alrededor de 32 kD que se cree que ha evolucionado a partir de la forma homodimérica por duplicación de genes . La forma monomérica consta de dos dominios pseudosimétricos de ocho hélices en los que las hélices están empaquetadas en una topología compleja que se asemeja a la de las hojas beta en un pliegue de rollo de gelatina . La disposición tridimensional de las hélices forma una molécula en forma de barco con una gran cavidad central en la que se unen los pigmentos y los lípidos. Cada segmento de ocho hélice típicamente se une cuatro peridinina moléculas, uno clorofila a molécula, y uno de lípidos molécula tal como digalactosil diacilglicerol ; sin embargo, esta estequiometría varía entre especies y entre isoformas de PCP . La relación peridinina: clorofila 4: 1 más común se predijo mediante espectroscopía en la década de 1970, pero no se confirmó hasta que se resolvió la estructura cristalina del complejo PCP de Amphidinium carterae en la década de 1990. Ya sea que se forme a partir de un monómero o un dímero de proteína, el complejo de proteína-pigmento ensamblado a veces se conoce como bPCP (para "bloque de construcción") y es la unidad estable mínima. En al menos algunas formas de PCP, incluida la de A. carterae , estos bloques de construcción se ensamblan en un trímero que se cree que es el estado biológicamente funcional.
Cuando se resolvió la estructura de cristalografía de rayos X de PCP en 1997, representaba un nuevo pliegue proteico y su topología sigue siendo única entre las proteínas conocidas. La estructura es referida por la base de datos CATH , que clasifica sistemáticamente las estructuras de proteínas, como un pliegue "solenoide alfa"; sin embargo, en otras partes de la bibliografía, el término solenoide alfa se utiliza para las estructuras proteicas helicoidales abiertas y menos compactas.
Función
Los dinoflagelados fotosintéticos contienen complejos captadores de luz unidos a la membrana similares a los que se encuentran en las plantas verdes . Además, contienen complejos de pigmentos y proteínas solubles en agua que aprovechan los carotenoides como la peridinina para ampliar su capacidad fotosintética. La peridinina absorbe la luz en las longitudes de onda azul-verde (470 a 550 nm) que son inaccesibles a la clorofila por sí sola; en cambio, el complejo PCP utiliza la geometría de las orientaciones relativas de los pigmentos para efectuar una transferencia de energía de eficiencia extremadamente alta desde las moléculas de peridinina a su molécula de clorofila vecina. La PCP ha servido como un sistema modelo común para la espectroscopia y para los cálculos teóricos relacionados con la fotofísica de la proteína.
Se cree que los complejos de PCP ocupan la luz del tilacoide . Después de la transferencia de energía de la peridinina al pigmento de clorofila, se cree que los complejos de PCP transfieren energía de la clorofila excitada a los complejos de captación de luz unidos a la membrana .

