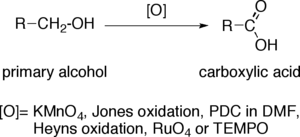
Oxidación de alcoholes primarios a ácidos carboxílicos - Oxidation of primary alcohols to carboxylic acids
La oxidación de alcoholes primarios a ácidos carboxílicos es una reacción de oxidación importante en la química orgánica .
Cuando un alcohol primario se convierte en un ácido carboxílico , el átomo de carbono terminal aumenta su estado de oxidación en cuatro. Los oxidantes capaces de realizar esta operación en moléculas orgánicas complejas, que presentan otros grupos funcionales sensibles a la oxidación, deben poseer una selectividad sustancial. Los oxidantes más comunes son el permanganato de potasio alcalino (KMnO 4 ) o el dicromato de potasio acidificado . También se utilizan reactivo de Jones , PCC en DMF , oxidación de Heyns, tetróxido de rutenio (RuO 4 ) y TEMPO .
Permanganato de potasio
El permanganato de potasio (KMnO 4 ) es un oxidante muy fuerte capaz de reaccionar con muchos grupos funcionales, como alcoholes secundarios, 1,2-dioles, aldehídos, alquenos, oximas, sulfuros y tioles. En condiciones controladas, el KMnO 4 oxida los alcoholes primarios a ácidos carboxílicos de manera muy eficiente. Esta reacción, que fue descrita por primera vez en detalle por Fournier, se lleva a cabo típicamente añadiendo KMnO 4 a una solución o suspensión del alcohol en una solución acuosa alcalina. La mezcla resultante se agita hasta que se completa la oxidación. Para que la reacción se desarrolle eficazmente, el alcohol debe estar al menos parcialmente disuelto en la solución acuosa. Esto puede facilitarse mediante la adición de un codisolvente orgánico como dioxano , piridina , acetona o t -BuOH. El KMnO 4 reaccionará fácilmente con un doble enlace carbono-carbono antes de oxidar un alcohol primario.
Normalmente, estas oxidaciones se realizan en condiciones básicas fuertes, porque esto promueve una mayor velocidad de oxidación y selectividad. En sustratos sensibles a bases fuertes, la reacción se puede llevar a cabo a un pH más bajo, o incluso en condiciones ácidas, a costa de una velocidad de reacción muy reducida.

El KMnO 4 se descompone en agua, lo que resulta en la formación de dióxido de manganeso (MnO 2 ) y oxígeno gaseoso. Esta descomposición es catalizada por ácido, base y MnO 2 . Como la extensión de esta descomposición es difícil de estimar durante la oxidación de alcoholes primarios, la cantidad de KMnO 4 debe ajustarse durante la oxidación añadiéndola secuencialmente hasta que se complete la oxidación.
Oxidación de Jones
El llamado reactivo de Jones se prepara disolviendo trióxido de cromo (CrO 3 ) en ácido sulfúrico acuoso , lo que da como resultado la formación de una solución rojiza que contiene ácido crómico (H 2 CrO 4 ) y oligómeros del mismo. La adición de reactivo de Jones a una solución de un alcohol primario en acetona (como lo describió por primera vez Jones) da como resultado la oxidación del alcohol a un ácido carboxílico. Este protocolo clásico, que implica una adición directa , se utiliza muy a menudo independientemente del hecho de que con frecuencia conduce a la formación de cantidades sustanciales de ésteres (que poseen la estructura R-CO-O-CH 2 -R) derivados de la dimerización oxidativa de alcoholes. Holland y Gilman demostraron que esta reacción secundaria se puede suprimir en gran medida siguiendo el protocolo de adición inverso mediante el cual se añade lentamente una solución del alcohol primario en acetona al reactivo de Jones en condiciones tan diluidas como sea posible.
El reactivo de Jones interactúa con alcoholes secundarios dando como resultado la oxidación a cetonas. El tratamiento de compuestos que contienen alcoholes primarios y secundarios con el reactivo de Jones conduce a la formación de cetoácidos.
Los problemas encontrados con el uso de grandes cantidades de trióxido de cromo, que es tóxico y peligroso para el medio ambiente, impulsaron el desarrollo por Zhao de un procedimiento catalítico, que implica el tratamiento con exceso de ácido periódico (H 5 IO 6 ) en presencia de aproximadamente 1,2 mol. % de CrO 3 . El procedimiento de Zhao para el uso de CrO 3 catalítico es muy adecuado para reacciones a gran escala.

PDC en DMF (Corey y Schmidt)
El dicromato de piridinio (PDC) es un sólido de color naranja brillante con las fórmulas (C 5 H 5 NH) 2 Cr 2 O 7 que se utiliza con mucha frecuencia para la oxidación de alcoholes primarios y secundarios a aldehídos y cetonas respectivamente. Por otro lado, en 1979, Corey y Schmidt informaron que la reacción de alcoholes primarios saturados con PDC, utilizando dimetilformamida (Me 2 NCHO, DMF) como disolvente, da como resultado la oxidación a ácidos carboxílicos en lugar de aldehídos. No se produce oxidación a ácidos carboxílicos en alcoholes primarios alílicos y bencílicos. El procedimiento de Corey y Schmidt para la oxidación de alcoholes primarios saturados a ácidos carboxílicos se realiza en condiciones esencialmente neutras.
Oxidación de Heyns
En la oxidación de heyns, el reactivo oxidante es una combinación de oxígeno y platino .
Tetróxido de rutenio
El tetróxido de rutenio tiene muchos usos en química orgánica como agente oxidante. Es un agente agresivo que permite condiciones de reacción suaves.
Oxidación en dos pasos de alcoholes a ácidos a través de aldehídos aislados
Dado que muchas de las condiciones antes mencionadas para la oxidación de alcoholes primarios a ácidos son duras y no compatibles con los grupos de protección comunes, los químicos orgánicos a menudo usan un procedimiento de dos pasos para la oxidación a ácidos. El alcohol primario se oxida a un aldehído usando uno de los muchos procedimientos existentes (por ejemplo , oxidación IBX , periodinano de Dess-Martin ). A continuación, el aldehído puede someterse a las condiciones de oxidación de Pinnick utilizando clorito de sodio . Esta secuencia se usa a menudo en la síntesis de productos naturales, Nicolaou et al. lo aplicó en su síntesis de Platencina.
Referencias
Otras lecturas
- Marcos Fernández; Gabriel Tojo (2006). Oxidación de alcoholes primarios a ácidos carboxílicos: una guía para la práctica común actual (reacciones básicas en síntesis orgánica) . Berlín: Springer. ISBN 0-387-35431-X .