Química organoboro - Organoboron chemistry
Los compuestos de organoborano u organoboro son compuestos químicos de boro y carbono que son derivados orgánicos de BH 3 , por ejemplo, trialquil boranos. La química de organoboro o la química de organoborano es la química de estos compuestos.
Los compuestos de organoboro son reactivos importantes en la química orgánica que permiten muchas transformaciones químicas, la más importante se llama hidroboración . Las reacciones de organoboratos y boranos implican la transferencia de un grupo nucleófilo unido al boro a un centro electrófilo ya sea inter o intramolecularmente. Los boratos α, β-insaturados, así como los boratos con un grupo saliente en la posición α, son muy susceptibles a la migración intramolecular 1,2 de un grupo desde el boro a la posición α electrofílica. La oxidación o protonólisis de los organoboranos resultantes puede generar una variedad de productos orgánicos, incluidos alcoholes, compuestos carbonílicos, alquenos y haluros.
Propiedades del enlace BC
El enlace CB tiene baja polaridad (la diferencia de electronegatividad es de 2,55 para el carbono y 2,04 para el boro) y, por tanto, los compuestos de alquil boro son en general estables aunque se oxidan fácilmente.
En parte debido a su menor electronegatividad, el boro a menudo forma compuestos deficientes en electrones , como los triorganoboranos. Los grupos vinilo y arilo donan electrones y hacen que el boro sea menos electrófilo y el enlace CB adquiere cierto carácter de doble enlace . Al igual que el borano original, el diborano , los organoboranos se clasifican en química orgánica como electrófilos fuertes porque el boro no puede obtener un octeto completo de electrones. Sin embargo, a diferencia del diborano, la mayoría de los organoboranos no forman dímeros .
Síntesis
De reactivos de Grignard
Se pueden preparar organoboranos simples tales como trietilborano o tris (pentafluorofenil) boro a partir de trifluoroborano (como el complejo de éter ) y el reactivo de Grignard de etilo o pentafluorofenilo . Los boratos (R 4 B - ) se generan mediante la adición de R - equivalentes (RMgX, RLi, etc.) a R 3 B.
De los alquenos
Los alquenos se insertan en los enlaces BH de los boranos en un proceso llamado hidroboración . El proceso implica la adición anti- Markovnikov . La hidroboración de alquenos o alquinos con borano (BH 3 ) o equivalentes de borano conduce a la conversión de solo el 33% de la olefina de partida en producto después de la oxidación o protonólisis; la olefina restante se incorpora a subproductos que contienen boro. Un reactivo de organoboro que se emplea a menudo en síntesis es el 9-BBN . Las hidroboraciones tienen lugar estereoespecíficamente en un modo de sincronización , es decir, en la misma cara del alqueno. En esta reacción concertada, el estado de transición se representa como un cuadrado con las esquinas ocupadas por carbono, carbono, hidrógeno y boro con superposición máxima entre los dos orbitales p de olefina y el orbital boro vacío.
Por borylation
Las reacciones de borilación de CH catalizadas por metales son reacciones orgánicas catalizadas por metales de transición que producen un compuesto de organoboro a través de la funcionalización de enlaces CH alifáticos y aromáticos. Un reactivo común en este tipo de reacción es el bis (pinacolato) diboro .
Clases de compuestos organoboro
Organoboranos e hidruros
Entre las clases más estudiadas de compuestos de organoboro se encuentran la fórmula BR n H 3 − n . Como se discutió anteriormente, estos compuestos se utilizan como catalizadores, reactivos e intermedios sintéticos. Los derivados de trialquilo y triarilo presentan un centro de boro plano trigonal que típicamente es solo débilmente ácido de Lewis . Excepto por algunos derivados muy voluminosos, los hidruros (BR n H 3 − n para n = 1 o 2) existen como dímeros, que recuerdan la estructura del propio diborano. Los derivados trisustituidos, por ejemplo, trietilboro son monómeros.
Ácidos y ésteres borínicos y borónicos (BR n (OR) 3-n )
Los compuestos del tipo BR n (OR) 3-n se denominan ésteres borínicos (n = 2), ésteres borónicos (n = 1) y boratos (n = 0). Los ácidos borónicos se utilizan en la reacción de Suzuki . El borato de trimetilo , que discutiblemente no es un compuesto organoboro, es un intermedio en la producción de borohidruro de sodio.
Racimos de boro
El boro es conocido por formar compuestos de racimo, por ejemplo, dodecaborato [B 12 H 12 ] 2- . Se conocen muchos derivados orgánicos para tales grupos. Un ejemplo es [B 12 (CH 3 ) 12 ] 2- y su derivado radical [B 12 (CH 3 ) 12 ] - . Los compuestos de conglomerados relacionados con vértices de carbono se denominan carboranos . El más conocido es el ortocarborano, con la fórmula C 2 B 10 H 12 . Aunque tienen pocas aplicaciones comerciales, los carboranos han atraído mucha atención porque son estructuralmente inusuales. Los derivados aniónicos, dicarbollidos, por ejemplo, [C 2 B 9 H 11 ] 2 - son ligandos que se comportan como ciclopentadienida .
Compuestos aromáticos sustituidos con bora
En borabenzene , un centro de CH en benceno es reemplazado por boro. Estos compuestos se aíslan invariablemente como aductos, por ejemplo, C 5 H 5 B-piridina. El compuesto cíclico borol , un análogo estructural del pirrol , no se ha aislado, pero se conocen derivados sustituidos conocidos como boroles. El compuesto cíclico borepin es aromático.
Compuestos de borilo
Los aniones borilo tienen la fórmula R 2 B - . Los compuestos de borilo aniónicos nucleófilos han sido esquivos durante mucho tiempo, pero un estudio de 2006 describió un compuesto de borilitio , que reacciona como un nucleófilo : Los compuestos organometálicos con enlaces de metal a boro, (es decir, M – BR 2 ), se conocen como complejos de borilo. Los ligandos relacionados son los borilenos (M – B (R) –M).
La ausencia de compuestos de borilo de litio es notable porque en otro período son comunes las sales de litio de 2 elementos, por ejemplo , fluoruro de litio , hidróxido de litio , amida de litio y metillitio . La brecha resalta la muy baja electronegatividad del boro. La reacción de la base con un borohidruro R 2 BH no da como resultado la desprotonación al anión borilo R 2 B - sino a la formación del anión borilo R 2 B - H (base) + . Este producto de reacción tiene un octeto completo . En su lugar, el compuesto de borilo se prepara mediante heterolisis reductora de un enlace boro-bromuro por metal litio . El nuevo compuesto de boril litio es muy similar e isoelectrónico con los carbenos N-heterocíclicos . Está diseñado para beneficiarse de la estabilización aromática (sistema de 6 electrones que cuenta los pares solitarios de nitrógeno y un orbital p de boro vacío , ver estructura A) y de la estabilización cinética de los voluminosos grupos 2,6-diisopropilfenilo. La difracción de rayos X confirma la hibridación sp2 en el boro y su reacción de adición nucleofílica con benzaldehído da una prueba más de la estructura propuesta.
Alquilidenboranos
Rara vez se encuentran alquilidenboranos del tipo RB = CRR con un doble enlace boro-carbono . Un ejemplo es el borabenceno . El compuesto original es HB = CH 2 que puede detectarse a bajas temperaturas. Un derivado bastante estable es CH 3 B = C (SiMe 3 ) 2 pero es propenso a la ciclodimerización .
Aductos NHC de boro
Los NHC y los boranos forman aductos de borano de NHC estables . Los aductos de trietilborano se pueden sintetizar directamente a partir de la sal de imidazolio y trietilborohidruro de litio . Los miembros de esta clase de compuestos se investigan para su uso como reactivo o catalizador.
Diborenes
Los compuestos químicos con dobles enlaces de boro a boro son raros. En 2007, Gregory Robinson de la Universidad de Georgia presentó el primer diboreno neutro (RHB = BHR) . Cada átomo de boro tiene un protón unido a él y cada átomo de boro está coordinado con un carbeno NHC . La estructura original con los ligandos de carbeno adicionales es el diborano (2) .
Un diboryne informado se basa en una química similar.
Reacciones
Los organoboranos (R 3 B) y los boratos (R 4 B - , generados mediante la adición de R - a R 3 B) poseen enlaces boro-carbono que están polarizados hacia el carbono. Por tanto, el carbono unido al boro es nucleófilo, y en los boratos esta propiedad puede aprovecharse para transferir uno de los grupos R a un centro electrófilo ya sea inter o (más a menudo) intramolecularmente. En el último caso, el grupo R nucleófilo puede experimentar una migración 1,2 hacia un carbono electrófilo unido al boro. El borano reorganizado resultante puede oxidarse o someterse a protonolisis para producir productos orgánicos. Los ejemplos cubiertos en este artículo se muestran a continuación.
La hidroboración de alquenos o alquinos es un método eficaz para la generación de boranos; sin embargo, el uso de borano (BH 3 ) o equivalentes de borano conduce a la conversión de solo el 33% de la olefina de partida en producto después de la oxidación o protonólisis; la olefina restante se incorpora a subproductos que contienen boro. El uso de una cantidad estequiométrica de 9-borabiciclo [3.3.1] nonano (9-BBN) como reactivo de hidroboración proporciona una solución a este problema.
Hidroboración-oxidación
En la síntesis orgánica, la reacción de hidroboración se lleva más allá para generar otros grupos funcionales en lugar del grupo boro. La reacción de hidroboración-oxidación ofrece una ruta a los alcoholes por oxidación del borano con peróxido de hidrógeno o al grupo carbonilo con el agente oxidante más fuerte , óxido de cromo .
Reordenamientos
Se encuentra que el monóxido de carbono reacciona con los trialquilboranos. Lo que sigue es una transposición 1,2 por la que un sustituyente alquilo migra del boro al carbono del grupo carbonilo. Los alcoholes primarios homologados resultan del tratamiento de organoboranos con monóxido de carbono e hidruro.
Allylboration
La alilboración asimétrica demuestra otra aplicación útil de los organoboranos en la formación de enlaces carbono-carbono. En este ejemplo de la síntesis de las epotilonas de Nicolaou , se usa alilboración asimétrica (usando un alilborano derivado de alfa-pineno quiral ) junto con la protección de TBS y la ozonólisis . En general, esto proporciona una secuencia de homologación de dos carbonos que entrega la secuencia de acetogenina requerida .
Como agente reductor
Los hidruros de borano como el 9-BBN y el L-selectruro (tri-sec-butilborohidruro de litio) son agentes reductores . Un ejemplo de catalizador asimétrico para reducciones de carbonilo es el catalizador CBS . Este catalizador también se basa en boro, cuyo propósito es la coordinación con el átomo de oxígeno del carbonilo.
Boratos
Los trialquilboranos, BR 3 , pueden oxidarse a los correspondientes boratos , B (OR) 3 . Un método para la determinación de la cantidad de enlaces CB en un compuesto es por oxidación de R 3 B con óxido de trimetilamina (Me 3 NO) a B (OR) 3 . A continuación, se puede titular la trimetilamina (Me 3 N) formada .
Los ácidos borónicos RB (OH) 2 reaccionan con el bifluoruro de potasio K [HF 2 ] para formar sales de trifluoroborato K [RBF 3 ] que son precursoras de los difluoruros de boro de alquilo y arilo nucleófilos, ArBF 2 . Las sales son más estables que los propios ácidos borónicos y se utilizan, por ejemplo, en la alquilación de ciertos aldehídos :
Los compuestos de organoboro también se prestan a reacciones de transmetalación , especialmente con compuestos de organopaladio . Este tipo de reacción se ejemplifica en la reacción de Suzuki , que implica el acoplamiento de ácido aril - o vinil - borónico con un haluro de aril - o vinilo - catalizado por un complejo de paladio (0) ,
-
( 1 )
Esta reacción es un método importante para formar enlaces carbono-carbono.
Mecanismo y estereoquímica
Los boranos solos generalmente no son suficientemente nucleófilos para transferir un grupo alquilo a un centro electrófilo. Sin embargo, después del ataque nucleofílico, el borato resultante es altamente nucleofílico. Si el nucleófilo contiene una funcionalidad insaturada o un grupo saliente en la posición α, uno de los grupos R unidos al boro puede migrar al carbono α electrófilo (ver la ecuación (2) a continuación). La propensión de un grupo orgánico a migrar depende de su capacidad para estabilizar la carga negativa: alquinilo> aril-alquenilo> alquilo primario> alquilo secundario> alquilo terciario. La migración tiene lugar con retención de la configuración en el carbono migratorio e inversión de la configuración en el extremo de la migración (siempre que sea sp 3 hibridado). El bis (norbornil) borano y el 9-BBN se utilizan a menudo como reactivos de hidroboración "ficticios" por esta razón: es probable que sólo el grupo R derivado de la olefina hidroborada migre tras la activación nucleófila.
Los enolatos α-halo se utilizan comúnmente como nucleófilos en este contexto. Después del ataque nucleofílico al boro, el cetoboronato resultante se reorganiza en un enolborano neutro. Tras la protonólisis, se produce un compuesto de carbonilo funcionalizado. Los enolboranos intermedios también pueden inactivarse con electrófilos.
Los alquinilboronatos son productos intermedios versátiles que se pueden convertir en cetonas u olefinas después de la migración y el ataque simultáneos del alquino en un electrófilo separado. El electrófilo y el grupo migrante terminan en trans en el alquenilborano resultante. La protonólisis de este intermedio genera olefinas, mientras que la oxidación conduce a cetonas después de la tautomerización.
Alcance y limitaciones de las reacciones.
El alcance de los organoboranos y boratos como reactivos para la síntesis orgánica es extremadamente amplio. Las reacciones de compuestos de organoboro pueden producir alcoholes, compuestos carbonílicos, haluros, peróxidos, aminas y otras funciones, dependiendo de otros materiales de partida empleados y de las condiciones de reacción. Esta sección cubre un pequeño subconjunto de estos métodos, enfocándose en la síntesis de alcoholes, compuestos carbonílicos y haluros.
La síntesis de alcohol a partir de organoboranos y boratos se basa en la transferencia de un grupo nucleófilo a un grupo carbonilo o en la oxidación de un organoborano intermedio. Los alcoholes primarios homologados resultan del tratamiento de organoboranos con monóxido de carbono e hidruro.
Los alcoholes terciarios con dos grupos idénticos unidos al carbono del alcohol se pueden sintetizar mediante una reacción de doble migración de alquinilboratos en presencia de ácido. El uso de un solo equivalente de ácido y oxidación o protonólisis conduce a cetonas u olefinas, respectivamente (consulte la sección Mecanismo y estereoquímica anterior).
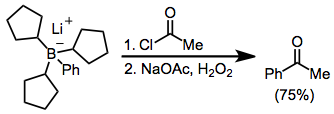
La acilación de boratos es posible en presencia de un haluro de acilo. Aquí, el borato se generó a partir de tri (ciclopentil) borano y fenil-litio; los tres grupos ciclopentilo sirven como grupos "ficticios" y no migran en una cantidad significativa.
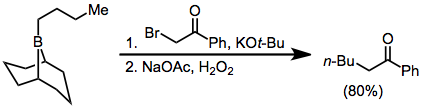
El tratamiento de trialquilboranos con α-halo enolatos conduce a cetonas funcionalizadas. Debido a que la migración es estereoespecífica (retentiva con respecto al grupo migrante e inversa en el carbono α), este método proporciona un medio para la síntesis de α-alquil o -aril cetonas enantiopuras.
Los enolatos de éster de α-halo también se añaden a los boranos para producir finalmente productos con funcionalidad α; sin embargo, los rendimientos son ligeramente inferiores. Los diazoésteres y diazocetonas también pueden usarse en este contexto sin el requisito de una base externa. Los α, α'-Dialoenolatos reaccionan con los boranos para formar compuestos α-halocarbonilo que pueden funcionalizarse más en la posición α.
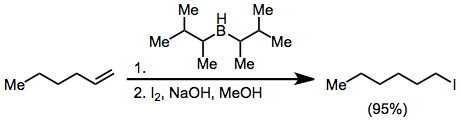
Los haluros se pueden sintetizar a partir de organoboranos mediante la activación con hidróxido o alcóxido y el tratamiento con X 2 . Dos de los tres grupos alquilo unidos al borano pueden convertirse en haluro en presencia de un exceso de base, pero el uso de disiamilborano como reactivo hidroborante permite la halogenación selectiva de sólo la olefina hidroborada.
El tratamiento de un alquenilborano con yodo o bromo conduce a la migración de uno de los grupos orgánicos unidos al boro. Los grupos alquinilo migran selectivamente, formando eninas después del tratamiento con acetato de sodio y peróxido de hidrógeno.
Otros usos
TEB: se utilizó trietilborano para encender el combustible JP-7 de los motores de ciclo variable Pratt & Whitney J58 que alimentan el Lockheed SR-71 Blackbird .









![La reacción de Suzuki {\ Displaystyle {\ begin {matrix} {} \\ {\ ce {{R1-BY2} + R2-X -> [{\ underset {\ text {catalizador}} {\ text {Pd}}}] [{ \ text {Base}}] R1-R2}} \\ {} \ end {matriz}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)