Regla de Oddo-Harkins - Oddo–Harkins rule
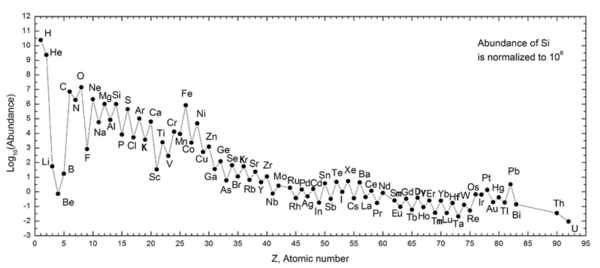
La regla de Oddo-Harkins sostiene que un elemento con un número atómico par (como el carbono : elemento 6) es más abundante que ambos elementos con los números atómicos impares adyacentes más grandes y más pequeños (como boro : elemento 5 y nitrógeno : elemento 7, respectivamente, para el carbono ). Esta tendencia de la abundancia de elementos químicos fue reportada por primera vez por Giuseppe Oddo en 1914 y William Draper Harkins en 1917.
Definición
Todos los átomos más grandes que el hidrógeno se forman en estrellas o supernovas a través de la nucleosíntesis , cuando la gravedad , la temperatura y la presión alcanzan niveles lo suficientemente altos como para fusionar protones y neutrones . Los protones y neutrones forman el núcleo atómico , que acumula electrones para formar átomos. El número de protones en el núcleo, llamado número atómico, identifica de forma única un elemento químico.
La regla Oddo-Harkins sostiene que los elementos con números atómicos impares tienen un protón no apareado y es más probable que capturen otro, aumentando así su número atómico. Es posible que en elementos con números atómicos pares, los protones estén emparejados, con cada miembro del par equilibrando el giro del otro; por tanto, incluso la paridad mejora la estabilidad de los nucleones.
Excepciones a la regla
Este postulado, sin embargo, no se aplica al elemento más abundante y simple del universo de la tabla periódica de elementos: el hidrógeno , con un número atómico de 1. Esto puede deberse a que, en su forma ionizada, un átomo de hidrógeno se convierte en un solo protón. , del cual se teoriza que fue uno de los primeros grandes conglomerados de quarks durante el segundo inicial del período de inflación del Universo , después del Big Bang . En este período, cuando la inflación del universo lo había llevado de un punto infinitesimal a aproximadamente el tamaño de una galaxia moderna, las temperaturas en la sopa de partículas cayeron de más de un billón de grados a varios millones de grados.
Este período permitió la fusión de protones individuales y núcleos de deuterio para formar núcleos de helio y litio , pero fue demasiado corto para que cada ion H + se reconstituyera en elementos más pesados. En este caso, el helio, número atómico 2, sigue siendo la contraparte par del hidrógeno. Así, el hidrógeno neutro, o el hidrógeno emparejado con un electrón , el único leptón estable, constituía la gran mayoría de las porciones de materia no aniquiladas que quedaban tras la conclusión de la inflación.
Otra excepción a la regla es el berilio , que, incluso con un número atómico par (4), es más raro que los elementos de número impar a cada lado ( litio y boro ). Esto se debe a que la mayor parte del litio, berilio y boro del universo se produce por espalación de rayos cósmicos , no por nucleosíntesis estelar ordinaria , y el berilio tiene solo un isótopo estable, lo que hace que se retrase en abundancia con respecto a sus vecinos, que ambos tienen dos estables. isótopos.
Relación con la fusión
El patrón surge después de que se produce la fusión descontrolada en una estrella masiva moribunda, en la que una masa dada de los diversos elementos pares e impares está formada por una masa ligeramente mayor de los elementos hidrógeno y helio. Los elementos recién formados son expulsados en la explosión y finalmente se unen al resto del medio interestelar de la galaxia .
Cuando se produce una fusión con núcleos cada vez más grandes, la entrada de energía se vuelve cada vez más grande y la salida de energía se vuelve cada vez más pequeña; el punto en el que estos dos potenciales se encuentran en la tabla periódica de elementos está en algún lugar alrededor de los elementos hierro , número atómico 26 y níquel , número atómico 28. La fusión de elementos más pesados que este no libera energía, por lo que la probabilidad de encontrar discrepancias en la regla Oddo-Harkins se vuelve más baja.
Ver también
- Número atómico
- Hidrógeno
- Inflación cósmica
- Lista de elementos por estabilidad de isótopos
- Fusión nuclear
- Química nuclear
