Nociceptor - Nociceptor
| Nociceptor | |
|---|---|
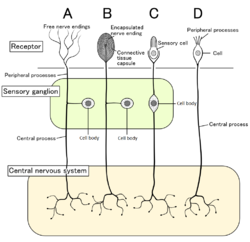 Cuatro tipos de neuronas sensoriales y sus células receptoras. Los nociceptores se muestran como terminaciones nerviosas libres tipo A
| |
| Identificadores | |
| Malla | D009619 |
| Terminología anatómica | |
Un nociceptor ("receptor del dolor") es una neurona sensorial que responde a estímulos dañinos o potencialmente dañinos enviando señales de "posible amenaza" a la médula espinal y al cerebro. Si el cerebro percibe la amenaza como creíble, crea la sensación de dolor para dirigir la atención a la parte del cuerpo, por lo que es de esperar que la amenaza pueda mitigarse; este proceso se llama nocicepción .
Historia
Los nociceptores fueron descubiertos por Charles Scott Sherrington en 1906. En siglos anteriores, los científicos creían que los animales eran como dispositivos mecánicos que transformaban la energía de los estímulos sensoriales en respuestas motoras. Sherrington utiliza muchos experimentos diferentes para demostrar que los diferentes tipos de estimulación a una fibra nerviosa aferente 's campo receptivo dado lugar a diferentes respuestas. Algunos estímulos intensos desencadenan una retirada refleja , ciertas respuestas autónomas y dolor . Los receptores específicos para estos intensos estímulos se denominaron nociceptores.
Localización
En los mamíferos, los nociceptores se encuentran en cualquier área del cuerpo que pueda detectar estímulos nocivos. Los nociceptores externos se encuentran en tejidos como la piel ( nociceptores cutáneos ), las córneas y la mucosa . Los nociceptores internos se encuentran en una variedad de órganos, como los músculos , las articulaciones , la vejiga , los órganos viscerales y el tracto digestivo. Los cuerpos celulares de estas neuronas se encuentran en los ganglios de la raíz dorsal o en los ganglios del trigémino . Los ganglios del trigémino son nervios especializados para la cara, mientras que los ganglios de la raíz dorsal están asociados con el resto del cuerpo. Los axones se extienden hacia el sistema nervioso periférico y terminan en ramas para formar campos receptivos.
Desarrollo
Los nociceptores se desarrollan a partir de células madre de la cresta neural . La cresta neural es responsable de gran parte del desarrollo temprano de los vertebrados. Es específicamente responsable del desarrollo del sistema nervioso periférico (SNP). Las células madre de la cresta neural se separan del tubo neural a medida que se cierra y los nociceptores crecen en la parte dorsal de este tejido de la cresta neural. Se forman tarde durante la neurogénesis. Las células de esta región que se forman más temprano pueden convertirse en receptores no sensibles al dolor, ya sean propioceptores o mecanorreceptores de bajo umbral . Todas las neuronas derivadas de la cresta neural, incluidos los nociceptores embrionarios, expresan TrkA, que es un receptor del factor de crecimiento nervioso (NGF). Sin embargo, los factores de transcripción que determinan el tipo de nociceptor siguen sin estar claros.
Después de la neurogénesis sensorial, se produce la diferenciación y se forman dos tipos de nociceptores. Se clasifican en nociceptores peptidérgicos o no peptidérgicos, cada uno de los cuales expresa un repertorio distinto de canales y receptores iónicos. Sus especializaciones permiten a los receptores inervar diferentes objetivos centrales y periféricos. Esta diferenciación ocurre tanto en el período perinatal como en el posnatal. Los nociceptores no peptidérgicos apagan el TrkA y comienzan a expresar Ret, que es un componente de señalización transmembrana que permite la expresión del factor de crecimiento derivado de células gliales (GDNF). Esta transición es asistida por Runx1, que es vital en el desarrollo de nociceptores no peptidérgicos. Por el contrario, los nociceptores peptidérgicos continúan usando TrkA y expresan un tipo de factor de crecimiento completamente diferente. Actualmente hay mucha investigación sobre las diferencias entre los nociceptores.
Tipos y funciones
La terminal periférica del nociceptor maduro es donde se detectan los estímulos nocivos y se transducen en energía eléctrica. Cuando la energía eléctrica alcanza un valor umbral, se induce un potencial de acción y se dirige hacia el sistema nervioso central (SNC). Esto conduce al tren de eventos que permite la conciencia consciente del dolor. La especificidad sensorial de los nociceptores se establece por el umbral alto solo para las características particulares de los estímulos. Solo cuando el umbral alto ha sido alcanzado por ambientes químicos, térmicos o mecánicos se activan los nociceptores. La mayoría de los nociceptores se clasifican según las modalidades ambientales a las que responden. Algunos nociceptores responden a más de una de estas modalidades y, en consecuencia, se denominan polimodales. Otros nociceptores no responden a ninguna de estas modalidades (aunque pueden responder a la estimulación en condiciones de inflamación) y se denominan dormidos o silenciosos.
Los nociceptores tienen dos tipos diferentes de axones. Los primeros son los axones de la fibra Aδ . Están mielinizados y pueden permitir que un potencial de acción viaje a una velocidad de unos 20 metros / segundo hacia el SNC. El otro tipo son los axones de fibra C de conducción más lenta . Estos solo conducen a velocidades de alrededor de 2 metros / segundo. Esto se debe a la luz o no mielinización del axón. Como resultado, el dolor se presenta en dos fases. La primera fase está mediada por las fibras Aδ de conducción rápida y la segunda parte debido a las fibras C (polimodales). El dolor asociado con las fibras Aδ puede estar asociado a un dolor inicial extremadamente agudo. La segunda fase es una sensación de dolor más prolongada y ligeramente menos intensa como resultado del daño agudo. Si hay una entrada masiva o prolongada a una fibra C, hay una acumulación progresiva en el asta dorsal de la médula espinal; este fenómeno es similar al tétanos en los músculos, pero se llama cuerda . Si se produce una liquidación, existe la probabilidad de que aumente la sensibilidad al dolor.
Térmico
Los nociceptores térmicos se activan por el calor o el frío nocivos a diversas temperaturas. Hay transductores nociceptores específicos que son responsables de cómo y si la terminación nerviosa específica responde al estímulo térmico. El primero en ser descubierto fue TRPV1 , y tiene un umbral que coincide con la temperatura del dolor por calor de 43 ° C. Otras temperaturas en el rango cálido-caliente están mediadas por más de un canal TRP . Cada uno de estos canales expresa un dominio C-terminal particular que corresponde a la sensibilidad cálido-caliente. Las interacciones entre todos estos canales y cómo se determina que el nivel de temperatura está por encima del umbral del dolor se desconocen en este momento. Los estímulos fríos son detectados por los canales TRPM8 . Su dominio C-terminal difiere de los TRP sensibles al calor. Aunque este canal corresponde a estímulos fríos, aún se desconoce si también contribuye en la detección del frío intenso. Un hallazgo interesante relacionado con los estímulos fríos es que la sensibilidad táctil y la función motora se deterioran mientras persiste la percepción del dolor.
Mecánico
Los nociceptores mecánicos responden al exceso de presión o deformación mecánica. También responden a las incisiones que rompen la superficie de la piel. La reacción al estímulo es procesada como dolor por la corteza, al igual que las respuestas químicas y térmicas. Estos nociceptores mecánicos tienen frecuentemente características polimodales. Por tanto, es posible que algunos de los transductores para estímulos térmicos sean los mismos para estímulos mecánicos. Lo mismo ocurre con los estímulos químicos, ya que TRPA1 parece detectar cambios tanto mecánicos como químicos. Algunos estímulos mecánicos pueden provocar la liberación de sustancias químicas intermedias, como el ATP , que puede ser detectado por los receptores purinérgicos P2 , o el factor de crecimiento nervioso , que puede ser detectado por el receptor quinasa A de la tropomiosina (TrkA) .
Químico
Los nociceptores químicos tienen canales TRP que responden a una amplia variedad de especias. El que ve la mayor respuesta y está ampliamente probado es la capsaicina . Otros estimulantes químicos son irritantes ambientales como la acroleína , un arma química de la Primera Guerra Mundial y un componente del humo del cigarrillo. Aparte de estos estimulantes externos, los nociceptores químicos tienen la capacidad de detectar ligandos endógenos y ciertas aminas de ácidos grasos que surgen de cambios en los tejidos internos. Al igual que en los nociceptores térmicos, TRPV1 puede detectar sustancias químicas como capsaicina y toxinas y ácidos de arañas. Los canales iónicos sensibles al ácido (ASIC) también detectan la acidez.
Durmiendo / silencioso
Aunque cada nociceptor puede tener una variedad de posibles niveles de umbral, algunos no responden en absoluto a los estímulos químicos, térmicos o mecánicos a menos que realmente se haya producido una lesión. Por lo general, se les conoce como nociceptores silenciosos o dormidos, ya que su respuesta se produce solo al inicio de la inflamación en el tejido circundante.
Polimodal
Muchas neuronas realizan una sola función; por lo tanto, las neuronas que realizan estas funciones en combinación reciben la clasificación "polimodal".
Ruta
Ascendente
Las fibras nociceptivas aferentes (aquellas que envían información al cerebro , en lugar de hacerlo desde él ) viajan de regreso a la médula espinal donde forman sinapsis en su asta dorsal . Esta fibra nociceptiva (ubicada en la periferia) es una neurona de primer orden. Las células del asta dorsal se dividen en capas fisiológicamente distintas llamadas láminas. Los diferentes tipos de fibras forman sinapsis en diferentes capas y utilizan glutamato o sustancia P como neurotransmisor. Las fibras Aδ forman sinapsis en las láminas I y V, las fibras C se conectan con las neuronas en la lámina II, las fibras Aβ se conectan con las láminas I, III y V.Después de alcanzar la lámina específica dentro de la médula espinal, el proyecto nociceptivo de primer orden a las neuronas de segundo orden que cruzan la línea media en la comisura blanca anterior. Las neuronas de segundo orden luego envían su información a través de dos vías al tálamo : el sistema medial-lemniscal de la columna dorsal y el sistema anterolateral . El primero se reserva más para la sensación regular no dolorosa, mientras que el segundo se reserva para la sensación de dolor. Al llegar al tálamo, la información se procesa en el núcleo posterior ventral y se envía a la corteza cerebral en el cerebro a través de fibras en la rama posterior de la cápsula interna.
Descendiendo
Como existe una vía ascendente al cerebro que inicia la realización consciente del dolor, también existe una vía descendente que modula la sensación de dolor. El cerebro puede solicitar la liberación de hormonas o sustancias químicas específicas que pueden tener efectos analgésicos que pueden reducir o inhibir la sensación de dolor. El área del cerebro que estimula la liberación de estas hormonas es el hipotálamo . Este efecto de inhibición descendente puede demostrarse estimulando eléctricamente el área gris periacueductal del mesencéfalo o el núcleo periventricular . Ambos, a su vez, se proyectan a otras áreas involucradas en la regulación del dolor, como el núcleo rafe magnus, que también recibe aferencias similares del núcleo reticularis paragigantocellularis (NPG). A su vez, el núcleo rafe magnus se proyecta a la región de la sustancia gelatinosa del asta dorsal y media la sensación de impulsos espinotalámicos. Esto se hace primero por el núcleo rafe magnus que envía neuronas serotoninérgicas a neuronas en el cordón dorsal, que a su vez secretan encefalina a las interneuronas que llevan la percepción del dolor. La encefalina funciona al unirse a los receptores opioides para producir la inhibición de la neurona postsináptica, inhibiendo así el dolor. El gris periacueductal también contiene receptores de opioides, lo que explica uno de los mecanismos por los que opioides como la morfina y la diacetilmorfina presentan un efecto analgésico.
Sensibilidad
La sensibilidad de la neurona nociceptor está modulada por una gran variedad de mediadores en el espacio extracelular. La sensibilización periférica representa una forma de plasticidad funcional del nociceptor. El nociceptor puede pasar de ser simplemente un detector de estímulos nocivos a un detector de estímulos no nocivos. El resultado es que los estímulos de baja intensidad de la actividad regular, inician una sensación dolorosa. Esto se conoce comúnmente como hiperalgesia . La inflamación es una causa común que resulta en la sensibilización de los nociceptores. Normalmente, la hiperalgesia cesa cuando la inflamación disminuye, sin embargo, a veces los defectos genéticos y / o lesiones repetidas pueden resultar en alodinia : un estímulo completamente no nocivo como un toque ligero causa un dolor extremo. La alodinia también puede ser causada cuando un nociceptor está dañado en los nervios periféricos. Esto puede resultar en desaferenciación, lo que significa el desarrollo de diferentes procesos centrales del nervio aferente superviviente. Con esta situación, los axones de la raíz dorsal supervivientes de los nociceptores pueden hacer contacto con la médula espinal, cambiando así la entrada normal.
Otros animales
La nocicepción se ha documentado en animales no mamíferos, incluidos peces y una amplia gama de invertebrados , incluidas sanguijuelas , gusanos nematodos , babosas marinas y larvas de moscas de la fruta . Aunque estas neuronas pueden tener diferentes vías y relaciones con el sistema nervioso central que los nociceptores de mamíferos, las neuronas nociceptivas en los no mamíferos a menudo se activan en respuesta a estímulos similares a los de los mamíferos, como alta temperatura (40 grados C o más), pH bajo , capsaicina. y daño tisular.
Terminología
Debido a la comprensión histórica del dolor, los nociceptores también se denominan receptores del dolor . Aunque el dolor es real, los factores psicológicos pueden influir mucho en la intensidad subjetiva.
Ver también
- Capsaicina y su mecanismo de acción en nociceptores.
- Piperina de pimienta negra
- Canal de iones TRPC
