Catálisis ácida de Lewis - Lewis acid catalysis
En la catálisis ácida de Lewis de reacciones orgánicas, un ácido de Lewis a base de metal actúa como un aceptor de pares de electrones para aumentar la reactividad de un sustrato. Los catalizadores ácidos de Lewis comunes se basan en metales del grupo principal como el aluminio , boro , silicio y estaño , así como en muchos metales de bloque D tempranos ( titanio , circonio ) y tardíos ( hierro , cobre , zinc ). El átomo de metal forma un aducto con un átomo electronegativo que lleva un par solitario en el sustrato, como oxígeno (tanto sp 2 como sp 3 ), nitrógeno , azufre y halógenos . La complejación tiene un carácter de transferencia de carga parcial y hace que el donante de par solitario sea efectivamente más electronegativo, activando el sustrato hacia el ataque nucleofílico, la escisión del enlace heterolítico o la cicloadición con 1,3-dienos y 1,3-dipolos.
Muchas reacciones clásicas que involucran la formación de enlaces carbono-carbono o carbono-heteroátomo pueden ser catalizadas por ácidos de Lewis. Los ejemplos incluyen la reacción de Friedel-Crafts , la reacción aldólica y varios procesos pericíclicos que avanzan lentamente a temperatura ambiente, como la reacción de Diels-Alder y la reacción del eno . Además de acelerar las reacciones, los catalizadores ácidos de Lewis pueden imponer regioselectividad y estereoselectividad en muchos casos.
Los primeros desarrollos en reactivos ácidos de Lewis se centraron en compuestos fácilmente disponibles como TiCl 4 , BF 3 , SnCl 4 y AlCl 3 . A lo largo de los años, los catalizadores versátiles que llevan ligandos diseñados para aplicaciones específicas han facilitado la mejora tanto en la reactividad como en la selectividad de las reacciones catalizadas por ácido de Lewis. Más recientemente, los catalizadores ácidos de Lewis con ligandos quirales se han convertido en una clase importante de herramientas para la catálisis asimétrica .
Los desafíos en el desarrollo de la catálisis ácida de Lewis incluyen un recambio de catalizador ineficaz (causado por la afinidad del catalizador por el producto) y el requisito frecuente de unión de dos puntos para la estereoselectividad, que a menudo requiere el uso de grupos auxiliares.
Mecanismo
En reacciones con mecanismos polares, la catálisis ácida de Lewis a menudo implica la unión del catalizador a los heteroátomos básicos de Lewis y la extracción de la densidad electrónica, lo que a su vez facilita la escisión del enlace heterolítico (en el caso de la reacción de Friedel-Crafts ) o activa directamente el sustrato hacia el ataque nucleofílico ( en el caso de reacciones de adición de carbonilo ). La dicotomía puede tener consecuencias importantes en algunas reacciones, como en el caso de las reacciones de sustitución de acetal promovidas por ácido de Lewis, donde los mecanismos S N 1 y S N 2 que se muestran a continuación pueden dar diferentes resultados estereoquímicos. Al estudiar la proporción de producto en un sistema bicíclico, Dinamarca y sus colegas demostraron que ambos mecanismos podrían ser operativos dependiendo de la denticidad del ácido de Lewis y la identidad del grupo R '.

En las reacciones de cicloadición de Diels-Alder y 1,3-dipolar , los ácidos de Lewis reducen la energía LUMO del dienófilo o del dipolarfilo, respectivamente, haciéndolo más reactivo hacia el dieno o el dipolo.
Catálisis ácida de Lewis con sustratos que contienen carbonilo
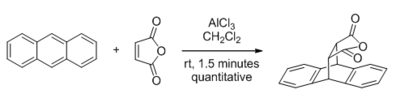
Entre los tipos de reacciones que pueden ser catalizadas por ácidos de Lewis , las que tienen sustratos que contienen carbonilo han recibido la mayor atención. El primer descubrimiento importante en esta área fue en 1960, cuando Yates y Eaton informaron de la aceleración significativa de la reacción de Diels-Alder por AlCl 3 cuando el anhídrido maleico es el dienófilo.
Los primeros estudios teóricos que dependían del análisis orbital de frontera establecieron que la catálisis ácida de Lewis opera a través de la reducción de la energía LUMO del dienophile. Sin embargo, estudios recientes han demostrado que este fundamento detrás de las reacciones de Diels-Alder catalizadas por ácido de Lewis es incorrecto. Se encuentra que los ácidos de Lewis aceleran la reacción de Diels-Alder al reducir la repulsión de Pauli estérica desestabilizadora entre el dieno que interactúa y el dienófilo y no al disminuir la energía del LUMO del dienófilo y, en consecuencia, mejorar la interacción orbital de demanda de electrones normal. El ácido de Lewis se une a través de una interacción donante-aceptor al dienófilo y, a través de ese mecanismo, polariza la densidad orbital ocupada alejándola del doble enlace C = C reactivo del dienófilo hacia el ácido de Lewis. Esta densidad orbital ocupada reducida en el doble enlace C = C del dienófilo, a su vez, se involucrará en una interacción orbital de capa cerrada-capa cerrada menos repulsiva con el dieno entrante, reduciendo la repulsión estérica desestabilizadora de Pauli y, por lo tanto, disminuye el Diels- Barrera de reacción de aliso. Además, el catalizador ácido de Lewis también aumenta la asincronicidad de la reacción de Diels-Alder, haciendo que el orbital π ocupado ubicado en el doble enlace C = C del dienófilo sea asimétrico. Como resultado, esta asincronía mejorada conduce a una reducción adicional de la repulsión estérica desestabilizadora de Pauli, así como a una presión decreciente sobre los reactivos para que se deformen, en otras palabras, redujo la tensión de activación desestabilizadora (también conocida como energía de distorsión). Este mecanismo catalítico de trabajo se conoce como catálisis de reducción de Pauli , que opera en una variedad de reacciones orgánicas.
El razonamiento original detrás de las reacciones de Diels-Alder catalizadas por ácido de Lewis es incorrecto, porque además de reducir la energía del LUMO del dienófilo, el ácido de Lewis también reduce la energía del HOMO del dienófilo y, por lo tanto, aumenta la demanda inversa de electrones LUMO-HOMO. brecha. Por lo tanto, los catalizadores ácidos de Lewis fortalecen la interacción orbital de demanda de electrones normal al disminuir el LUMO del dienófilo, pero simultáneamente debilitan la interacción orbital de demanda de electrones inversa al disminuir también la energía del HOMO del dienófilo. Estos dos fenómenos que se contrarrestan se cancelan efectivamente entre sí, lo que da como resultado interacciones orbitales casi sin cambios en comparación con las reacciones de Diels-Alder no catalizadas correspondientes, lo que hace que este no sea el mecanismo activo detrás de las reacciones de Diels-Alder catalizadas por ácido de Lewis.
Además de la aceleración de la velocidad, las reacciones catalizadas por ácido de Lewis a veces exhiben una estereoselectividad mejorada, lo que estimuló el desarrollo de modelos de estereoinducción. Los modelos tienen sus raíces en el conocimiento de las estructuras de los complejos ácido-carbonilo de Lewis que, a través de décadas de investigación en cálculos teóricos , espectroscopia de RMN y cristalografía de rayos X , se establecieron con bastante firmeza a principios de la década de 1990:
- σ-complejación: el complejo en el que el ácido de Lewis interactúa con el compuesto carbonilo a través de un enlace σ con el par de oxígeno es tanto termodinámicamente favorecido como catalíticamente relevante. Se han caracterizado cristalográficamente varios complejos de metales de transición de aldehídos y cetonas .
- Geometría doblada: el ángulo de enlace metal-oxígeno-carbono es menor de 180 °, y el metal está sincronizado con el sustituyente más pequeño, a menos que esté influenciado por un grupo quelante en el sustituyente más grande.
- Una preferencia s-trans por los compuestos α, β-insaturados.
Adición y adición conjugada a compuestos carbonílicos
La reacción aldólica de Mukaiyama y la reacción de Sakurai se refieren a la adición de éteres de silil enol y alilsilanos a compuestos de carbonilo, respectivamente. Solo bajo catálisis ácida de Lewis ocurren estas reacciones en condiciones sintéticamente útiles. Se cree que los estados de transición acíclicos están operando en ambas reacciones para la adición 1,2 o 1,4, y los factores estéricos controlan la estereoselectividad. Esto contrasta con el estado de transición cíclico rígido de Zimmerman-Traxler que ha sido ampliamente aceptado para la reacción aldólica con enolatos de litio, boro y titanio . Como consecuencia, la geometría del doble enlace en el silil enol éter o alilsilano no se traduce bien en la estereoquímica del producto. En el esquema siguiente se presenta un modelo para la adición 1,2 de Sakurai, propuesto por Kumada; el diastereoisómero sin predomina cuando se usa el (E) silano, y también se favorece ligeramente cuando se usa el (Z) silano. Un análisis similar de Heathcock explica el hecho de que, con sustratos simples, esencialmente no hay diastereoselectividad para la reacción intermolecular aldólica de Mukaiyama.
El catalizador ácido de Lewis juega un papel en la estereoselectividad cuando el aldehído puede quelarse sobre el centro metálico y formar un intermedio cíclico rígido. El resultado estereoquímico es entonces consistente con la aproximación del anti nucleófilo al sustituyente más voluminoso del anillo.
Reacción de Diels-Alder
Los ácidos de Lewis tales como ZnCl 2 , BF 3 , SnCl 4 , AlCl 3 y MeAlCl 2 pueden catalizar reacciones de Diels-Alder por demanda de electrones tanto normal como inversa . La mejora en la velocidad es a menudo espectacular, y la regioselectividad hacia productos de tipo orto o para a menudo se mejora, como se muestra en la reacción entre isopreno y acrilato de metilo .
Se cree que la reacción catalizada de Diels-Alder está concertada . Un estudio computacional en el B3LYP / 6-31G (d) nivel ha demostrado, sin embargo, que el estado de transición de la BF 3 catalizada por reacción de Diels-Alder entre propenal y 1,3-butadieno es más asíncrono que la de la reacción térmica - el enlace más alejado del grupo carbonilo se forma antes que el otro enlace.
Ene reacción
La reacción del carbonil-eno es casi siempre catalizada por ácidos de Lewis en aplicaciones sintéticas. Se ha propuesto un mecanismo escalonado o en gran parte asincrónico para la reacción catalizada basado en estudios cinéticos del efecto isotópico . No obstante, los estados de transición cíclicos se invocan con frecuencia para interpretar la diastereoselectividad. En una revisión fundamental a principios de la década de 1990, Mikami y sus colegas propusieron un estado de transición tardío, similar a una silla, que podría racionalizar muchos resultados estereoquímicos observados, incluido el papel del volumen estérico en la diastereoselectividad:
Sin embargo, más recientemente, el mismo grupo llevó a cabo cálculos de HF / 6-31G * en reacciones de eno catalizadas por ácido de Lewis de estaño o aluminio. Citando que metil gloxylate quelatos de estaño ácidos de Lewis, pero no los de aluminio, que invocan una temprana, en forma de sobre de transición de estado y racionalizar el divergente resultado estereoquímico de la reacción de eno entre (E) -2-buteno y glioxilato de metilo.
Aplicación en síntesis
Las reacciones de adición de carbonilo catalizadas por ácido de Lewis se utilizan habitualmente para formar enlaces carbono-carbono en la síntesis de productos naturales . Las dos primeras reacciones que se muestran a continuación son de la síntesis de (+) - lycoflexine y ácido zaragozic C, respectivamente, que son aplicaciones directas de las reacciones de Sakurai y Mukaiyama. La tercera reacción, en ruta a (+) - fawcettimine, es una apertura de ciclopropano catalizada por ácido de Lewis que es análoga a una reacción de Mukaiyama- Michael .
La reacción de Diels-Alder catalizada o promovida por ácidos de Lewis es un método poderoso y ampliamente utilizado en la síntesis de productos naturales para lograr la complejidad del andamio en un solo paso con control estereoquímico. Las dos reacciones que se muestran a continuación son una reacción intramolecular de Diels-Alder hacia (-) - fusarisetina A y una reacción intermolecular de hetero-Diels-Alder hacia (-) - epibatidina, respectivamente.
En la alquilación de Friedel-Crafts , un ácido de Lewis, generalmente una sal de haluro metálico simple, promueve la escisión heterolítica de un enlace carbono-halógeno en un haluro de alquilo y genera un carbocatión , que sufre una sustitución aromática electrofílica . Aunque es muy útil en la síntesis, la reacción a menudo sufre reacciones secundarias que surgen de la transposición de carbocatión , la migración de alquilo y la sobrealquilación. De manera similar, en la acilación de Friedel-Crafts , un ácido de Lewis ayuda en la generación de un ión acilio a partir de un cloruro de ácido (u ocasionalmente anhídrido de ácido). Aunque a menudo se asume que el ión acilio es el intermedio activo, existe evidencia de que la dicación del acilio protonado es el electrófilo activo que sufre la subsiguiente sustitución aromática electrófila.
Las variantes importantes de la reacción de Friedel-Crafts incluyen clorometilación (con formaldehído y HCl), formilación (con HCl y CO o CN - ) y acilación con un nitrilo como fuente de acilo. La acilación basada en nitrilo es particularmente útil porque permite la ortoacilación directa de anilina sin proteger el grupo amina. Es necesaria una combinación de un ácido de Lewis fuerte y débil para que la reacción prosiga, a través del mecanismo que se muestra a continuación. Guiados por este mecanismo y equipados con el conocimiento de que los trihaluros de galio se encuentran entre los ácidos de Lewis más fuertes, los químicos de proceso de Merck pudieron desarrollar condiciones altamente eficientes para esta condición hacia un candidato a fármaco.
Catálisis ácida asimétrica de Lewis
Ligandos quirales comunes
La catálisis asimétrica por ácidos de Lewis se basa en catalizadores con ligandos quirales coordinados con el centro metálico. A lo largo de los años, un pequeño número de armazones de ligandos quirales se han destacado por tener propiedades catalíticas "privilegiadas" adecuadas para una amplia gama de aplicaciones, a menudo de mecanismos no relacionados. Los esfuerzos de investigación actuales en catálisis ácida asimétrica de Lewis utilizan o modifican principalmente esos ligandos en lugar de crear nuevos andamios de novo . Los andamios "privilegiados" comparten algunas características comunes, incluida la estabilidad química y la relativa facilidad de elaboración. La mayoría de los andamios son multidentados . La mayoría de ellos también tienen una gran rigidez de andamio dentro del ligando. Varios de ellos tienen disponibles modelos de estereoinducción bastante maduros. Algunos andamios "privilegiados", identificados por Jacobsen y Zhou, se presentan a continuación.
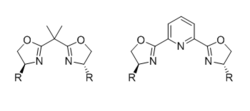
Bisoxazolinas (CAJA)
Los ligandos de bisoxazolina quiral (BOX) más comunes consisten en dos restos de oxazolina quirales idénticos, sustituidos por un grupo voluminoso en las posiciones 4, unidos por un enlazador. El ligando es bidentado cuando el enlazador es una sola unidad de carbono, pero es tridentado (normalmente meridional) cuando el enlazador lleva un átomo de coordinación adicional, como un nitrógeno de piridina en el caso de ligandos PyBOX. El impacto de la denticidad del ligando y la geometría intermedia activa en el resultado estereoquímico se ha revisado a fondo.
Muchas reacciones catalizadas por ácido de Lewis basadas en BOX bidentadas se basan en catalizadores de cobre (II) con sustratos que son adecuados para la unión de dos puntos. El resultado estereoquímico es consistente con un intermedio plano cuadrado retorcido que se propuso basándose en estructuras cristalinas relacionadas. El sustituyente en la posición 4 de la oxazolina bloquea una cara enantiotópica del sustrato, lo que conduce a la enantioselectividad. Esto se demuestra en la siguiente reacción tipo aldol , pero es aplicable a una amplia variedad de reacciones tales como reacciones tipo Mannich , reacción eno , adición de Michael , ciclación de Nazarov y reacción hetero -Diels-Alder .
Por otro lado, la unión de dos puntos en un ácido de Lewis que lleva el ligando PyBOX tridentado meridionalmente daría como resultado un complejo piramidal cuadrado . Un estudio que utilizó benciloxiacetaldehído como electrófilo mostró que el resultado estereoquímico es consistente con la unión del oxígeno del carbonilo ecuatorialmente y la unión del oxígeno del éter de manera axial.
BINAP
Desarrollado por Noyori, BINAP (2,2'-difenilfosfino-1,1'-binaftil) es una familia de ligandos de difosfina quirales que presentan dos restos de triarilfosfina instalados en un esqueleto de binaftaleno. BINAP se quela sobre un metal (generalmente un metal de transición tardío) para formar un complejo C 2 asimétrico. Como se muestra a continuación en la estructura de un complejo de rutenio (R) -BINAP , entre los cuatro sitios de coordinación restantes en un centro metálico octaédrico , los dos sitios ecuatoriales (púrpura) están fuertemente influenciados por los grupos fenilo ecuatoriales, mientras que los dos sitios axiales ( verde) están influenciados por los grupos fenilo axiales.
Sobre la base de la estructura, se han propuesto modelos para la enantioselectividad observada en muchas reacciones catalizadas por ácido de Lewis basadas en BINAP. Por ejemplo, en la reacción enantioselectiva de Diels-Alder catalizada por paladio que se muestra a continuación, se cree que el dienófilo coordina el centro metálico en los sitios ecuatoriales. Por tanto, el grupo fenilo ecuatorial del fósforo obstruye la cara Si , lo que da como resultado una excelente enantioselectividad. Se utilizó un modelo muy similar para racionalizar el resultado de una reacción de alquilación asimétrica de enolato catalizada por níquel, donde el sustrato también tiene un auxiliar que le permite quelar sobre el metal. Por otro lado, se cree que una reacción de hetero-eno catalizada por cobre (I) pasa a través de un intermedio tetraédrico , lo que ofrece un modo alternativo de estereoinducción al cambiar el centro del metal.
BINOL
BINOL (1,1'-binaftil-2,2'-diol) se usa generalmente junto con metales ácidos de Lewis oxofílicos como aluminio, titanio, circonio y varios metales de tierras raras. En los casos en los que BINOL en sí mismo no proporciona un control enantioselectivo ideal, se puede elaborar fácilmente mediante sustitución en las posiciones 3,3 '(mediante litiación ) y 6,6' (mediante el compuesto 6,6'-dibromuro preparado por electrófilos aromáticos sustitución ) para modular el volumen estérico y las propiedades electrónicas. Por ejemplo, los catalizadores de aluminio basados en voluminosos BINOL sustituidos con 3,3'-disililo se han desarrollado como ejemplos tempranos de reacción hetero -Diels-Alder asimétrica catalítica y transposición de Claisen , mientras que se introducen grupos aceptores de electrones en las posiciones 6,6 ' fue crucial para aumentar la acidez de Lewis, y por lo tanto la actividad catalítica, de los catalizadores de circonio (IV) hacia una reacción tipo Mannich . Sin embargo, hasta la fecha, no se ha aceptado generalmente ningún modelo para los factores cruciales que gobiernan la estereoinducción dirigida por BINOL.
TADDOL
TADDOL significa tetraaril-1,3-dioxolano-4,5-dimetanol. La amplia aplicación de los catalizadores de titanio TADDOLate hacia adiciones de carbonilo y cicloadiciones ha sido introducida por Seebach y sus colaboradores, y ha sido completamente resumida en una revisión seminal, en la que se puso un modelo de estereoinducción funcional que coincidía con la selectividad observada en una amplia variedad de reacciones. adelante, a pesar de la falta de una imagen clara del mecanismo.
Aplicaciones
La catálisis ácida de Lewis se ha utilizado en el paso de establecimiento de asimetría para la síntesis de muchos productos naturales . La primera reacción que se muestra a continuación, a partir de la síntesis del esqueleto de taxano , utiliza un catalizador a base de cobre soportado por un ligando de fosforamidita quiral para una reacción de adición de carbonilo conjugado. La segunda reacción, de la síntesis de ent - hiperforina , utiliza un catalizador de hierro-PyBOX para una reacción asimétrica de Diels-Alder .