Ácido hipofluoroso - Hypofluorous acid
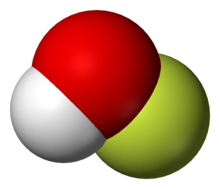
 Estructura en fase gaseosa
|
|
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
Ácido hipofluoroso
|
|
| Otros nombres
Hipofluorito de hidrógeno Fluorato de
hidrógeno (-I) Ácido (-I) fluorhídrico Monofluoroxigenato de hidrógeno (0) fluoruro de hidroxilo |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| HOF | |
| Masa molar | 36,0057 g mol −1 |
| Apariencia | líquido amarillo pálido por encima de −117 ° C sólido blanco por debajo de −117 ° C |
| Punto de fusion | −117 ° C (−179 ° F; 156 K) |
| Punto de ebullición |
se descompone a 0 ° C |
| Estructura | |
| C s | |
| Peligros | |
| Principales peligros | oxidante fuerte, corrosivo |
| NFPA 704 (diamante de fuego) | |
| Compuestos relacionados | |
|
Otros cationes
|
hipofluorito de litio |
|
Compuestos relacionados
|
ácido hipocloroso nitroxil cianuro de hidrógeno formaldehído |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
Ácido Hypofluorous , fórmula química H O F , es el único conocido oxiácido de flúor y el único conocido oxoácido en la que los principales átomo gana electrones de oxígeno para crear un estado de oxidación negativo. El estado de oxidación del oxígeno en los hipofluoritos es 0. También es el único ácido hipohaloso que puede aislarse como un sólido . HOF es un intermediario en la oxidación del agua por flúor , que produce fluoruro de hidrógeno , difluoruro de oxígeno , peróxido de hidrógeno , ozono y oxígeno . HOF es explosivo a temperatura ambiente, formando HF y O 2 :
- 2 HOF → 2 HF + O 2
Se aisló en forma pura pasando gas F 2 sobre hielo a -40 ° C, recogiendo el gas HOF y condensándolo:
- F 2 + H 2 O → HOF + HF
El compuesto se ha caracterizado en fase sólida mediante cristalografía de rayos X como una molécula doblada con un ángulo de 101 °. Las longitudes de los enlaces O – F y O – H son 144,2 y 96,4 picómetros , respectivamente. El marco sólido consta de cadenas con enlaces O – H ··· O. La estructura también se ha analizado en fase gaseosa, estado en el que el ángulo de enlace H – O – F es ligeramente más estrecho (97,2 °).
El ácido hipofluoroso en acetonitrilo (generado in situ al pasar flúor gaseoso a través de acetonitrilo "húmedo" ) se conoce comúnmente como reactivo de Rozen .
Hipofluoritos
Las hipofluoritas son formalmente derivados de OF - , que es la base conjugada del ácido hipofluoroso. Un ejemplo es el hipofluorito de trifluorometilo (CF 3 OF).
Ver también
- Ácido hipocloroso , un compuesto relacionado que es más importante tecnológicamente pero que no se ha obtenido en forma pura.

