Vesícula de gas - Gas vesicle
Las vesículas de gas , también conocidas como vacuolas de gas , son nanocompartimentos en ciertos organismos procarióticos , que ayudan a la flotabilidad. Las vesículas de gas están compuestas enteramente de proteínas ; no se han detectado lípidos ni carbohidratos.
Función
Las vesículas de gas se encuentran principalmente en organismos acuáticos, ya que se utilizan para modular la flotabilidad de la célula y modificar la posición de la célula en la columna de agua para que pueda ubicarse de manera óptima para la fotosíntesis o moverse a lugares con más o menos oxígeno. Los organismos que podrían flotar hacia la interfaz aire-líquido compiten con otros aerobios que no pueden ascender en una columna de agua, al consumir oxígeno en la capa superior.
Además, las vesículas de gas se pueden usar para mantener una salinidad óptima colocando el organismo en lugares específicos en un cuerpo de agua estratificado para prevenir el choque osmótico . Las altas concentraciones de soluto harán que el agua se extraiga de la célula por ósmosis , provocando la lisis celular. La capacidad de sintetizar vesículas de gas es una de las muchas estrategias que permiten a los organismos halófilos tolerar ambientes con alto contenido de sal.
Evolución
Las vesículas de gas son probablemente uno de los mecanismos más tempranos de motilidad entre los organismos microscópicos debido al hecho de que es la forma más extendida de motilidad conservada dentro del genoma de los procariotas, algunos de los cuales han evolucionado hace unos 3.000 millones de años. Los modos de motilidad activa, como el movimiento de los flagelos, requieren un mecanismo que pueda convertir la energía química en energía mecánica y, por lo tanto, es mucho más complejo y habría evolucionado más tarde. Las funciones de las vesículas de gas también se conservan en gran medida entre las especies, aunque el modo de regulación puede diferir, lo que sugiere la importancia de las vesículas de gas como una forma de motilidad. En ciertos organismos como la enterobacteria Serratia sp. La motilidad basada en flagelos y la producción de vesículas de gas están reguladas de manera opuesta por una única proteína de unión a ARN, RsmA, lo que sugiere modos alternativos de adaptación ambiental que se habrían desarrollado en diferentes taxones mediante la regulación del desarrollo entre la motilidad y la flotación.
Aunque existe evidencia que sugiere la evolución temprana de vesículas de gas, la transferencia de plásmido sirve como una explicación alternativa de la naturaleza extendida y conservada del orgánulo. La escisión de un plásmido en Halobacterium halobium resultó en la pérdida de la capacidad de biosintetizar vesículas de gas, lo que indica la posibilidad de transferencia horizontal de genes , lo que podría resultar en una transferencia de la capacidad de producir vesículas de gas entre diferentes cepas de bacterias.
Estructura

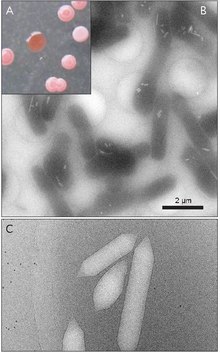
Las vesículas de gas son generalmente tubos de proteína huecos, cilíndricos o con forma de limón, con tapas cónicas en ambos extremos. Las vesículas varían más en su diámetro. Las vesículas más grandes pueden contener más aire y usar menos proteínas, lo que las convierte en las más económicas en términos de uso de recursos, sin embargo, cuanto más grande es una vesícula, estructuralmente más débil está bajo presión y menos presión se requiere antes de que la vesícula colapse. Los organismos han evolucionado para ser los más eficientes con el uso de proteínas y utilizan el diámetro máximo de vesícula más grande que resistirá la presión a la que el organismo podría estar expuesto. Para que la selección natural haya afectado a las vesículas de gas, el diámetro de las vesículas debe ser controlado por la genética. Aunque los genes que codifican las vesículas de gas se encuentran en muchas especies de haloarchaea , solo unas pocas las producen. El primer gen de vesículas de gas de Haloarchaeal, GvpA , se clonó a partir de Halobacterium sp. NRC-1. 14 genes participan en la formación de vesículas de gas en las haloarqueas.
El primer gen de vesículas de gas, GvpA, se identificó en Calothrix. Hay al menos dos proteínas que componen la vesícula de gas de una cianobacteria: GvpA y GvpC. GvpA forma nervios y gran parte de la masa (hasta el 90%) de la estructura principal. GvpA es fuertemente hidrófoba y puede ser una de las proteínas más hidrófobas conocidas. GvpC es hidrófilo y ayuda a estabilizar la estructura mediante inclusiones periódicas en las costillas de GvpA. La GvpC es capaz de eliminarse por lavado de la vesícula y, como consecuencia, se reduce la fuerza de la vesícula. El grosor de la pared de la vesícula puede oscilar entre 1,8 y 2,8 nm. La estructura acanalada de la vesícula es evidente tanto en la superficie interior como en la exterior con una separación de 4-5 nm entre las nervaduras. Las vesículas pueden tener entre 100 y 1400 nm de largo y entre 45 y 120 nm de diámetro.
Dentro de una especie, los tamaños de las vesículas de gas son relativamente uniformes con una desviación estándar de ± 4%.
Crecimiento
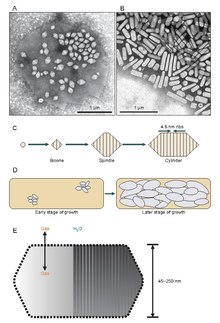
Parece que las vesículas de gas comienzan su existencia como pequeñas estructuras bicónicas (dos conos con las bases planas unidas) que se agrandan hasta el diámetro específico para luego crecer y expandir su longitud. Se desconoce exactamente qué controla el diámetro, pero puede ser una molécula que interfiera con GvpA o la forma de GvpA puede cambiar.
Regulación
La formación de vesículas de gas está regulada por dos proteínas Gvp: GvpD, que reprime la expresión de las proteínas GvpA y GvpC, y GvpE, que induce la expresión. Los factores ambientales extracelulares también afectan la formación de vesículas, ya sea regulando la producción de proteína Gvp o alterando directamente la estructura de la vesícula.
Intensidad de luz
Se ha descubierto que la intensidad de la luz afecta la producción y el mantenimiento de vesículas de gas de manera diferente entre diferentes bacterias y arqueas. Para Anabaena flos-aquae , las intensidades de luz más altas conducen al colapso de las vesículas debido a un aumento en la presión de turgencia y una mayor acumulación de productos fotosintéticos. En las cianobacterias, la producción de vesículas disminuye a alta intensidad de luz debido a la exposición de la superficie bacteriana a la radiación UV, que puede dañar el genoma bacteriano.
Carbohidratos
Se encontró que la acumulación de glucosa, maltosa o sacarosa en Haloferax mediterranei y Haloferax volcanii inhibe la expresión de proteínas GvpA y, por lo tanto, una disminución de la producción de vesículas de gas. Sin embargo, esto solo ocurrió en la fase de crecimiento exponencial temprano de la célula. La formación de vesículas también podría inducirse al disminuir las concentraciones de glucosa extracelular.
Oxígeno
Se encontró que la falta de oxígeno afecta negativamente la formación de vesículas de gas en arqueas halófilas. Halobacterium salinarum produce pocas vesículas o ninguna en condiciones anaeróbicas debido a la síntesis reducida de transcripciones de ARNm que codifican proteínas Gvp. H. mediterranei y H. volcanii no producen vesículas en condiciones anóxicas debido a una disminución en las transcripciones sintetizadas que codifican para GvpA y las transcripciones truncadas que expresan GvpD.
pH
Se ha descubierto que el aumento de los niveles de pH extracelular aumenta la formación de vesículas en las especies de Microcytis. Con un pH elevado, los niveles de transcripciones de gvpA y gvpC aumentan, lo que permite una mayor exposición a los ribosomas para la expresión y conduce a una regulación positiva de las proteínas Gvp. Puede atribuirse a una mayor transcripción de estos genes, una disminución de la descomposición de las transcripciones sintetizadas o una mayor estabilidad del ARNm.
Irradiación ultrasónica
Se descubrió que la irradiación ultrasónica, a ciertas frecuencias, colapsa las vesículas de gas en las cianobacterias Spirulina platensis , evitando que florezcan.
La detección de quórum
En enterobacterias; Serratia sp. cepa ATCC39006 , la vesícula de gas se produce solo cuando hay una concentración suficiente de una molécula de señalización, N-acil homoserina lactona. En este caso, la molécula de detección de quórum , N-acil homoserina lactona, actúa como un morfógeno que inicia el desarrollo de orgánulos. Esto es ventajoso para el organismo, ya que los recursos para la producción de vesículas de gas se utilizan sólo cuando hay limitación de oxígeno provocada por un aumento de la población bacteriana.
Papel en el desarrollo de vacunas
Gen de vesículas de gas gvp C de Halobacterium sp. se utiliza como sistema de administración para estudios de vacunas.
Varias características de la proteína codificada por el gen de la vesícula de gas gvp C permiten su uso como portador y adyuvante de antígenos: es estable, resistente a la degradación biológica, tolera temperaturas relativamente altas (hasta 50 ° C) y no patógena. a humanos. Se han recombinado varios antígenos de diversos patógenos humanos en el gen gvp C para crear vacunas de subunidades con respuestas inmunológicas de larga duración.
Diferentes segmentos genómicos que codifican varias proteínas del patógeno de Chlamydia trachomatis , incluidas MOMP, OmcB y PompD, se unen al gen gvp C de Halobacteria . Las evaluaciones in vitro de células muestran la expresión de los genes de Chlamydia en las superficies celulares a través de técnicas de imaginación y muestran respuestas inmunológicas características como las actividades de los TLR y la producción de citocinas proinflamatorias. El gen de la vesícula de gas se puede explotar como vehículo de administración para generar una vacuna potencial para la clamidia. Las limitaciones de este método incluyen la necesidad de minimizar el daño de la propia proteína GvpC al tiempo que se incluye la mayor parte del gen diana de la vacuna en el segmento del gen C de gvp .
Un experimento similar utiliza el mismo gen de vesículas de gas y la proteína efectora de fosfato de inosina secretada por el patógeno de Salmonella enterica SopB4 y SopB5 para generar un vector de vacuna potencial. Los ratones inmunizados secretan citocinas proinflamatorias IFN-γ, IL-2 e IL-9. También se detecta el anticuerpo IgG. Después de un desafío de infección, no se encontró ninguna o una cantidad significativamente menor de bacterias en los órganos recolectados, como el bazo y el hígado. Las vacunas potenciales que usan vesículas de gas como una exhibición de antígeno se pueden administrar a través de la vía mucosa como una vía de administración alternativa, aumentando su accesibilidad a más personas y provocando una gama más amplia de respuestas inmunes dentro del cuerpo.
Papel como agentes de contraste y genes informadores
Las vesículas de gas tienen varias propiedades físicas que las hacen visibles en diversas modalidades de imágenes médicas . La capacidad de la vesícula de gas para dispersar la luz se ha utilizado durante décadas para estimar su concentración y medir su presión de colapso. El contraste óptico de las vesículas de gas también les permite servir como agentes de contraste en la tomografía de coherencia óptica , con aplicaciones en oftalmología . La diferencia de impedancia acústica entre el gas en sus núcleos y el fluido circundante da a las vesículas de gas un contraste acústico robusto . Además, la capacidad de pandeo de algunas conchas de vesículas de gas genera ecos de ultrasonido armónicos que mejoran la relación de contraste con el tejido. Finalmente, las vesículas de gas se pueden utilizar como agentes de contraste para la formación de imágenes por resonancia magnética (IRM), basándose en la diferencia entre la susceptibilidad magnética del aire y el agua. La capacidad de colapsar vesículas de gas de forma no invasiva mediante ondas de presión proporciona un mecanismo para borrar su señal y mejorar su contraste. Restar las imágenes antes y después del colapso acústico puede eliminar las señales de fondo mejorando la detección de vesículas de gas.
La expresión heteróloga de vesículas de gas en células bacterianas y de mamíferos permitió su uso como la primera familia de genes indicadores acústicos . Si bien los genes informadores fluorescentes como la proteína verde fluorescente (GFP) tenían un uso generalizado en biología, sus aplicaciones in vivo están limitadas por la profundidad de penetración de la luz en el tejido, típicamente unos pocos mm. La luminiscencia se puede detectar más profundamente dentro del tejido, pero tiene una resolución espacial baja. Los genes indicadores acústicos proporcionan una resolución espacial submilimétrica y una profundidad de penetración de varios centímetros, lo que permite el estudio in vivo de los procesos biológicos en las profundidades del tejido.

