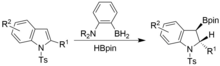Pareja de Lewis frustrada - Frustrated Lewis pair
En química, un par de Lewis frustrado ( FLP ) es un compuesto o mezcla que contiene un ácido de Lewis y una base de Lewis que, debido a un impedimento estérico , no pueden combinarse para formar un aducto clásico . Se han ideado muchos tipos de FLP y muchos sustratos simples exhiben activación.
El descubrimiento de que algunos FLP dividen el H 2 provocó un rápido crecimiento de la investigación sobre FLP. Debido a su reactividad "no apagada", tales sistemas son reactivos hacia sustratos que pueden sufrir heterolisis . Por ejemplo, muchos FLP dividen moléculas de hidrógeno . Así, una mezcla de triciclohexilfosfina (PCy 3 ) y tris (pentafluorofenil) borano reacciona con hidrógeno para dar los respectivos iones de fosfonio y borato :
Esta reactividad se ha aprovechado para producir FLP que catalizan reacciones de hidrogenación .
Activación de moléculas pequeñas
Se ha demostrado que los pares de Lewis frustrados activan muchas moléculas pequeñas, ya sea induciendo heterolisis o por coordinación.
Hidrógeno
El descubrimiento de que algunos FLP son capaces de dividir y, por tanto, activar el H 2 provocó un rápido crecimiento de la investigación en esta área. La activación y, por tanto, el uso de H 2 es importante para muchas transformaciones químicas y biológicas. El uso de FLP para liberar H 2 no contiene metales, esto es beneficioso debido al costo y el suministro limitado de algunos metales de transición que se usan comúnmente para activar el H 2 (Ni, Pd, Pt). Los sistemas FLP son reactivos frente a sustratos que pueden sufrir heterólisis (por ejemplo, hidrógeno) debido a la reactividad "no apagada" de dichos sistemas. Por ejemplo, se ha demostrado previamente que una mezcla de triciclohexilfosfina (PCy 3 ) y tris (pentafluorofenil) borano reacciona con H 2 para dar los respectivos iones de fosfonio y borato :
En esta reacción, PCy 3 (la base de Lewis) y B (C 6 F 5 ) 3 (el ácido de Lewis) no pueden formar un aducto debido al impedimento estérico de los voluminosos grupos ciclohexilo y pentafluorofenilo. El protón del fósforo y el hidruro del borato ahora están "activados" y posteriormente pueden "entregarse" a un sustrato orgánico, lo que da como resultado la hidrogenación .
Mecanismo de activación de dihidrógeno por FLP
El mecanismo para la activación de H 2 por FLP se ha discutido tanto para los casos intermoleculares como intramoleculares. Los FLP intermoleculares son donde la base de Lewis es una molécula separada del ácido de Lewis, se cree que estas moléculas individuales interactúan a través de interacciones secundarias de dispersión de Londres para unir la base de Lewis y el ácido (un efecto preorganizativo) donde las moléculas pequeñas pueden interactuar. con los FLP. La evidencia experimental de este tipo de interacción a nivel molecular no está clara. Sin embargo, existe evidencia de apoyo para este tipo de interacción basada en estudios computacionales DFT (Density Functional Theory). Los FLP intramoleculares son aquellos en los que el ácido de Lewis y la base de Lewis se combinan en una molécula mediante un enlazador covalente. A pesar de los 'efectos preorganizacionales' mejorados, se cree que los marcos rígidos de FLP intramoleculares tienen una reactividad reducida a las moléculas pequeñas debido a una reducción de la flexibilidad.
Otros sustratos de moléculas pequeñas
FLP también son reactivos frente a muchos sustratos insaturados más allá de H 2 . Algunos FLP reaccionan con CO 2 , específicamente en la reducción desoxigenante de CO 2 a metano.
El etileno también reacciona con los FLP:
Para que los pares ácido-base se comporten de forma nucleófila y electrófila al mismo tiempo, se ofrece un método para la apertura del anillo de éteres cíclicos como THF, 2,5-dihidrofurano, cumarán y dioxano.
Uso en catálisis
Hidrogenación de imina, nitrilo y aziridina
La reducción de iminas , nitrilos y aziridinas a aminas primarias y secundarias se efectúa tradicionalmente mediante reactivos de hidruro metálico, por ejemplo, hidruro de litio y aluminio y cianoborohidruro de sodio . Las hidrogenaciones de estos sustratos insaturados pueden efectuarse mediante reacciones catalizadas por metales. La hidrogenación catalítica libre de metales se llevó a cabo usando el catalizador de borato de fosfonio (R 2 PH) (C 6 F 4 ) BH (C 6 F 5 ) 2 (R = 2,4,6-Me 3 C 6 H 2 ) 1 . Este tipo de hidrogenación libre de metales tiene el potencial de reemplazar el catalizador metálico de alto costo.
Se propone que el mecanismo de reducción de imina implica la protonación en nitrógeno dando la sal de iminio. La basicidad del centro de nitrógeno determina la velocidad de reacción. Más iminas ricas en electrones se reducen a velocidades más rápidas que las iminas pobres en electrones. El centro de iminio resultante sufre un ataque nucleofílico por el anión borohidruro para formar la amina. Pequeñas aminas se unen al borano, apagando reacciones posteriores. Este problema puede superarse utilizando varios métodos: 1) Aplicación de temperaturas elevadas 2) Utilizando sustituyentes de imina estéricamente voluminosos 3) Protegiendo la imina con el grupo B (C 6 F 5 ) 3 , que también sirve como promotor ácido de Lewis.
Hidrogenación de imina enantioselectiva
El ácido de Lewis de boronato quiral derivado de (1 R ) - ( + ) -canfor forma un par de Lewis frustrado con t Bu 3 P, que se puede aislar como una sal. Este FLP cataliza la hidrogenación enantioselectiva de algunas ariliminas con alto rendimiento pero modesto ee (hasta 83%).
Aunque conceptualmente interesante, el protocolo adolece de falta de generalidad. Se encontró que el aumento del volumen estérico de los sustituyentes imina conduce a una disminución del rendimiento y ee del producto amina . Las iminas sustituidas con metoxi presentan un rendimiento superior y ee .
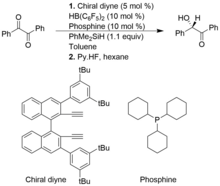
Hidrosililaciones asimétricas
Un grupo de catalizadores, los pares de Lewis frustrados de alquenilboranos quirales y fosfinas son beneficiosos para las hidrosililaciones asimétricas de tipo Piers de compuestos de 1,2-dicarbonilo y alfa-cetoésteres, lo que da como resultado productos de enantioselectividad de alto rendimiento. Sin embargo, en comparación con la hidrosilización convencional tipo Piers, las hidrosililaciones asimétricas tipo Piers no están tan bien desarrolladas.
En el siguiente ejemplo, el alquenilborano quiral se forma in situ a partir del diino quiral y el HB (C 6 F 5 ) 2 . La escisión heterolítica del enlace Si-H de PhMe 2 SiH por el catalizador FLP, forma un complejo iónico de sililio e hidridoborato.
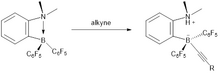
Hidrogenación de alquinos
La hidrogenación libre de metales de alquinos internos inactivados a cis- alquenos se logra fácilmente usando catalizadores basados en FLP. La condición para esta reacción eran relativamente suave utilizando 2 bar de H 2 . En términos de mecanismo, el material de alquino primero se hidrobora y luego el FLP a base de vinilborano resultante puede activar el dihidrógeno. Un paso de protodeborilación libera el producto cis -alqueno, que se obtiene debido al proceso de hidro-hidroboryilación sin , y regenerando el catalizador. Aunque activos para la hidrogenación de alquinos, los catalizadores basados en FLP no facilitan, sin embargo, la hidrogenación de alquenos a alcanos.
La reacción es una hidroboración sin, y como resultado se observa una alta selectividad cis. En la etapa final del ciclo catalítico, el grupo C 6 F 5 se escinde más fácilmente que un grupo alquilo, provocando la degradación del catalizador en lugar de la liberación de alcanos. El ciclo catalítico tiene tres pasos:
- Unión de sustrato (la hidroboración de alquinos)
- H 2 escisión con vinilborano, seguido por protodeborylation intramolecular de sustituyente de vinilo, la recuperación de N, N-dimetil-2 - [(pentafluorofenil) borilo] anilina
- Liberación del cis-alqueno
Con los alquinos internos, se produce una reacción competitiva en la que el protón unido al nitrógeno se puede añadir a los fluorobencenos. Por tanto, esta adición no avanza tanto, la formación del alqueno parece favorecida.
Pero los alquinos terminales no se unen al boro mediante hidroboración, sino mediante la activación del CH. Por tanto, la adición del protón al alquino dará como resultado el alquino terminal inicial. Por tanto, este proceso de hidrogenación no es adecuado para alquinos terminales y solo dará pentafluorobenceno.
La hidrogenación libre de metales de los alquinos terminales a los alquenos respectivos se logró recientemente usando un sistema basado en piridona borano. Este sistema activa el hidrógeno fácilmente a temperatura ambiente produciendo un complejo de piridona borano. La disociación de este complejo permite la hidroboración de un alquino por el borano libre. Tras la protodeborilación por la piridona libre, se genera el alqueno cis . La hidrogenación de alquinos terminales es posible con este sistema, porque la activación del CH es reversible y compite con la activación del hidrógeno.
Borilación
Los FLP de amina-borano catalizan la borilación de heterociclos aromáticos ricos en electrones (esquema 1). La reacción es impulsada por la liberación de hidrógeno a través de la activación de CH por el FLP. Las borilaciones aromáticas se utilizan a menudo en el desarrollo farmacéutico, particularmente debido a la abundancia, el bajo costo y la baja toxicidad de los compuestos de boro en comparación con los metales nobles.
El sustrato para la reacción tiene dos requisitos principales, fuertemente ligados al mecanismo de borilación. Primero, el sustrato debe ser rico en electrones, ejemplificado por la ausencia de reacción con el tiofeno, mientras que sus derivados más ricos en electrones, metoxitiofeno y 3,4-etilendioxitiofeno , pueden experimentar una reacción con el aminoborano. Además, la sustitución de 1-metilpirrol (que puede reaccionar) con el grupo tercbutiloxicarbonilo (Boc) fuertemente atrayente de electrones en la posición 2 inhibe completamente la reacción. El segundo requisito es la ausencia de grupos amina básicos en el sustrato, que de otro modo formarían un aducto no deseado. Esto se puede ilustrar por la falta de reacción con pirrol, mientras que los derivados de 1-metil y N-bencilpirrol son capaces de reaccionar.
El trabajo adicional de los mismos autores reveló que simplemente piperidina como grupo amina R (a diferencia de la tetrametilpiperidina, en la foto de arriba) aceleraba la velocidad de reacción. A través de estudios cinéticos y DFT, los autores propusieron que el paso de activación de CH era más fácil que con sustituyentes más grandes.
La desaromatización también se puede lograr en condiciones similares pero usando N-tosil indoles. Se obtienen indolinas sinhidroboriladas.
También se ha observado la borilación de enlaces SH en tioles mediante un proceso deshidrogenante. Los alcoholes y las aminas como el terc-butanol y la terc-butilamina forman productos estables que previenen la catálisis debido a un fuerte enlace π entre el par solitario del átomo de N / O y el boro, mientras que no ocurre lo mismo con los tioles, lo que permite una catálisis exitosa. . Además, se ha logrado la boryilación exitosa de enlaces Se-H. En todos los casos, la formación de H 2 de gas es una fuerza impulsora para las reacciones.
Captura de carbon
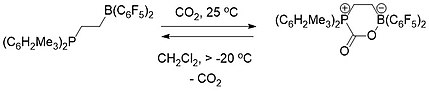
La química de FLP es conceptualmente relevante para la captura de carbono . Se utilizaron tanto un FLP intermolecular (esquema 1) como intramolecular (esquema 2) que consistía en una fosfina y un borano para capturar y liberar selectivamente dióxido de carbono. Cuando una solución de FLP se cubrió con una atmósfera de CO 2 a temperatura ambiente, el compuesto FLP-CO 2 precipitó inmediatamente como un sólido blanco.
Calentar el compuesto intermolecular FLP-CO 2 en bromobenceno a 80 ° C al vacío durante 5 horas provocó la liberación de aproximadamente la mitad del CO 2 y la regeneración de los dos componentes constituyentes del FLP. Después de varias horas más de reposo a temperatura ambiente al vacío, se produjo la liberación total de CO 2 y la regeneración de FLP.
El compuesto de FLP-CO 2 intramolecular , por el contrario, era estable como un sólido a temperatura ambiente pero se descompuso completamente a temperaturas por encima de -20 ° C como una solución en diclorometano liberando CO 2 y regenerando la molécula de FLP.
Este método de captura de carbono FLP se puede adaptar para trabajar en sistemas de química de flujo.

![{\ Displaystyle {\ ce {PCy3 + B (C6F5) 3 + H2 -> [HPCy3] + [HB (C6F5) 3] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)