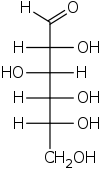
Proyección de Fischer - Fischer projection
La proyección de Fischer , ideada por Emil Fischer en 1891, es una representación bidimensional de una molécula orgánica tridimensional por proyección . Las proyecciones de Fischer se propusieron originalmente para la representación de carbohidratos y fueron utilizadas por químicos , particularmente en química orgánica y bioquímica . Se desaconseja el uso de proyecciones de Fischer en no carbohidratos, ya que tales dibujos son ambiguos cuando se confunden con otros tipos de dibujos.
Convenciones
Todos los enlaces no terminales se representan como líneas horizontales o verticales. La cadena de carbono se representa verticalmente, con los átomos de carbono a veces no mostrados y representados por el centro de las líneas cruzadas (ver figura a continuación). La orientación de la cadena de carbono es tal que el primer carbono (C1) esté en la parte superior. En una aldosa , C1 es el carbono del grupo aldehído ; en una cetosa , C1 es el carbono más cercano al grupo cetona , que normalmente se encuentra en C2.
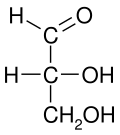
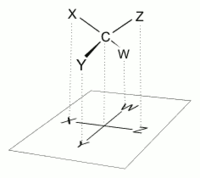
En una proyección de Fischer, todos los enlaces horizontales deben estar inclinados hacia el espectador. Las moléculas con una geometría tetraédrica simple se pueden rotar fácilmente en el espacio, de modo que se cumpla esta condición (ver figuras). Por ejemplo, un monosacárido con tres átomos de carbono ( triosa ), como el D- gliceraldehído que se muestra arriba, tiene una geometría tetraédrica, con C2 en su centro, y se puede rotar en el espacio para que la cadena de carbono sea vertical con C1 en la parte superior. , y los enlaces horizontales que conectan C2 con -H y -OH están ambos inclinados hacia el espectador.
Sin embargo, al crear una proyección de Fischer para un monosacárido con más de tres carbonos, no hay forma de orientar la molécula en el espacio para que todos los enlaces horizontales se inclinen hacia el espectador. Después de rotar la molécula de modo que ambos enlaces horizontales con C2 estén inclinados hacia el espectador, los enlaces horizontales con C3 normalmente estarán inclinados hacia afuera. Entonces, después de dibujar los enlaces con C2, antes de dibujar los enlaces con C3, la molécula debe rotarse en el espacio 180 ° alrededor de su eje vertical. Es posible que se necesiten más rotaciones similares para completar el dibujo.
Esto implica que, en la mayoría de los casos, una proyección de Fischer no es una representación precisa de la configuración 3D real de una molécula. Puede considerarse como una proyección de una versión modificada de la molécula, idealmente retorcida en múltiples niveles a lo largo de su columna vertebral. Por ejemplo, una molécula de cadena abierta de D- glucosa rotada de modo que los enlaces horizontales con C2 estén inclinados hacia el espectador, tendría los enlaces con C3 y C5 inclinados hacia afuera del espectador y, por lo tanto, su proyección precisa no coincidiría con un Proyección de Fischer. Para una representación más precisa de una molécula de cadena abierta , se puede utilizar una proyección de Natta .
De acuerdo con las reglas de la IUPAC, todos los átomos de hidrógeno deben dibujarse de forma explícita; en particular, deberían estar presentes los átomos de hidrógeno del grupo final de carbohidratos. En este sentido, la proyección de Fischer es diferente de las fórmulas esqueléticas .
Uso
Las proyecciones de Fischer se utilizan con mayor frecuencia en bioquímica y química orgánica para representar monosacáridos . También se pueden utilizar para aminoácidos o para otras moléculas orgánicas, aunque las recomendaciones de la IUPAC de 2006 no lo recomiendan.
Se puede utilizar una proyección de Fischer para diferenciar entre moléculas L y D- . Por ejemplo, por definición, en una proyección de Fischer, el penúltimo carbono de los azúcares D se representa con hidrógeno a la izquierda e hidroxilo a la derecha. Los L-azúcares se mostrarán con el hidrógeno a la derecha y el hidroxilo a la izquierda.
Otros sistemas
Las proyecciones de Haworth son una notación química relacionada que se utiliza para representar azúcares en forma de anillo. Los grupos en el lado derecho de una proyección de Fischer son equivalentes a los que están debajo del plano del anillo en las proyecciones de Haworth. Las proyecciones de Fischer no deben confundirse con las estructuras de Lewis , que no contienen información sobre geometría tridimensional . La notación de cuña y guiones se usa para representar la estereoquímica de la mayoría de las clases de compuestos orgánicos, y las proyecciones de Newman se usan para representar conformaciones específicas de enlaces rotativos de moléculas orgánicas (incluidos, entre otros, los carbohidratos).